
- •1. Формулировка задания
- •1.1Исследование 1
- •1.1.1.Расчёт изменения изобарной теплоемкости и теплового эффекта реакции
- •1.1.2. Расчёт изменения энтропии реакции
- •График зависимости ∆
- •1.1.3. Расчёт изменения стандартной энергии Гиббса
- •1.1.4. Вывод уравнения зависимости константы равновесия от температуры
- •График зависимости LnKp от обратной температуры
- •1.2.Исследование 2
- •1.2.1.Определение числа фаз, независимых компонентов и степеней свободы
- •1.2.2.Определение возможного направления реакции
- •1.2.3.Определение равновесного состава газовой смеси
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ ВПО <<Магнитогорский государственный технический университет им. Носова>>
Кафедра химической технологии неметаллических материалов и физической химии
РАСЧЁТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ 1
по курсу <Физическая химия>
раздел <Термодинамика>
вариант 3-1
Выполнил:
Студентка гр. МЧ-10 Ю.Г. Валеева
Проверил: О. В. Юдина
Магнитогорск
-2011-
1. Формулировка задания
Исследование 1
Дана реакция 2BiF3+3H2=2Bi+6HF, где– BiF3, H2, Bi, HF-вещества- участники реакции; 2, 3, 2, 6 – стехиометрические коэффициенты реакции. Выполнить следующее:
1.Составить
уравнение зависимости от температуры
величины теплового эффекта
 и изменение энтропии
и изменение энтропии

2.Вычислить
величины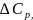
 и
lnKp
при нескольких температурах, значения
которых задаются температурным интервалом
и шагом температур. Полученные значения
используются при построение графиков
в координатах
и
lnKp
при нескольких температурах, значения
которых задаются температурным интервалом
и шагом температур. Полученные значения
используются при построение графиков
в координатах
 ;
;
 ;
;
 ;
;
 ;
и lnKp
– 1/T.
;
и lnKp
– 1/T.
3.Пользуясь графиком lnKp – 1/T , вывести приближенное уравнение вида lnKp = A/T + B, где A, B – постоянные.
Исследование 2
1.Используя правило фаз Гиббса для рассматриваемой системы, определить количество фаз независимых компонентов и число степеней свободы.
2.Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при давлении и температуре, указанных в графах 16 и 17, соответственно табл.1. При решении задачи использовать выведенное в исследование 1 эмпирическое уравнение lnKp = A/T + B и данные об исходном составе газовой фазы.
3.Установить направление смещения состояния равновесия рассматриваемой системы при:
а) увеличении давления ( постоянная температура).
б) увеличении температуры ( постоянное давление).
1.1Исследование 1
Для удобства последующих расчётов составляем таблицу исходных данных, используя материал [1-3].
Таблица 2
Исходные данные для термодинамического исследования реакции
2BiF3+3H2=2Bi+6HF
№ п/п |
Вещество |
кДж/моль |
S Дж/моль*К |
Коэффициенты в уравнение a+bT+c'T^-2, Дж/моль*К |
||
|
|
|
|
а |
b*10^3 |
c |
1 |
BiF3 |
-904,35 |
136,07 |
90,44 |
56,94 |
0 |
3 |
H2 |
0 |
130,60 |
27,28 |
3,26 |
0,50 |
3 |
Bi |
0 |
56,90 |
18,79 |
22,59 |
0 |
4 |
HF |
-268,80 |
173,86 |
26,92 |
3,43 |
1,09 |
1.1.1.Расчёт изменения изобарной теплоемкости и теплового эффекта реакции
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа
 (1)
(1)
где
 - стандартный тепловой эффект реакции
при 298 К;
- стандартный тепловой эффект реакции
при 298 К;
 -
изменение теплоёмкости системы в
результате протекания реакции.
-
изменение теплоёмкости системы в
результате протекания реакции.
Последняя величина рассчитывается по уравнению
 (2)
(2)
где Cp,i – мольная изобарная теплоёмкость i-го вещества, определяемая из уравнения
Cp,i
=
 (3)
(3)
ni-стехиометрический коэффициент i-го вещества в равнении реакции.
Для исследуемой реакции, после подстановки в уравнение (2) ni, оно примет вид
∆Cр= .
(4)
.
(4)
Определим температурные зависимости Cp,i:




Определим
расчётные уравнения
 Для чего подставим уравнения (5a,
5b,
5c,
5d)
в уравнение (4)
Для чего подставим уравнения (5a,
5b,
5c,
5d)
в уравнение (4)
 Cp
=[6*(26,92+3,43*
Cp
=[6*(26,92+3,43* +1,09*
+1,09* )+(2*(18,79+22,59*
)]-[2*(90,44+56,94*
)+3*(27,28+
)+(2*(18,79+22,59*
)]-[2*(90,44+56,94*
)+3*(27,28+ =-63,62-9,78*
+5,04*
.
(6)
=-63,62-9,78*
+5,04*
.
(6)
Рассчитаем значения при различных температурах: 400, 420, 440, 460, 480, 500,520, 540К.
Таблица 3
Величина при различных температурах для реакции
2BiF3+3H2=2Bi+6HF
T, K |
400 |
420 |
440 |
460 |
480 |
500 |
520 |
540 |
∆Cp Дж/K |
-64,3 |
-64,9 |
-65,3 |
-65,8 |
-66,2 |
-66,4 |
-66,9 |
-67 |
График зависимости ∆Cp=f(T)

Определим
значение
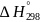
 (7)
(7)
Уравнение (7) имеет вид
 )
(8)
)
(8)
или в числовом виде
 =195900Дж.
=195900Дж.
Рассчитаем


Таблица 4
Величина
 при различных температурах для реакции
при различных температурах для реакции
2BiF3+3H2=2Bi+6HF
T,K |
400 |
420 |
440 |
460 |
480 |
500 |
520 |
540 |
,кДж |
189,31 |
188,21 |
186,85 |
185,49 |
184,13 |
182,76 |
181,39 |
180,06 |
График
зависимости ∆ =f(T)
=f(T)




 *10^-5
*10^-5