
- •1.1)Электрохимия
- •2.1) Электрохим. Цепь
- •3.1) Законы электролиза (законы Фарадея)
- •4.1) Кулонометры и кулонометрия
- •5.1) Представления об эл-литической диссоциации, модель гротгуса, представления фарадея.
- •7.1) Теория Аррениуса, ионные равновесия, недостатки классической теории диссоциации.
- •8.1) Энергия ионной кристаллической решетки,модельный метод борна, уравнение борна-ланде. Анализ уравнения. Константа маделунга (хлорид натрия).
- •2.1) Термодинамическое описание равновесий в растворе, связь хим. Потенциала и активности.
- •2.2) Активность и коэффициент активности электролитов. Ионная сила раствора. Распределение ионов в растворе
- •2.3) Теория электролитов дебая и гюккеля.
- •2.4) Применение теории Дебая-Хюккеля к слабым электролитам
- •2,5) Ионная ассоциация
- •2.6) Механизмы образования р-ров эл-литов, сольватация, гидратация кат, ан, м-л. Числа сольватации. Корреляционные подходы к сравнению р-лей. Их хар-ки.
- •2.7) Полиэлектролиты
- •2) Диффузия и ионов. Коэффициент диффузии. Определение, размерность, вывод первого закона Фика. Уравнение первого закона Фика для одномерной и трёхмерной диффузии.
- •4.3) Диффузионный потенциал. Уравнение для диффузионного потенциала. Эффективный коэффициент диффузии электролита. Способы устранения диффузионного потенциала.
- •7)Предельные электропроводности ионов. Формула Стокса. Правило Вальдена-Писаржевского. Формула Стокса-Эйнштейна.
- •8)Основы теории Дебая-Хюккеля-Онзагера
- •9) Эффекты Вина и Дебая-Фалькенгагена, релаксационный, элкектрофоретический.
- •10)Представления о переносе заряда в неводных растворах,ионных расплавах и твёрдых электролитах.
2.7) Полиэлектролиты


3.1)Общая характеристика неравновесных явлений в растворах электролитов. Причины возникновения.



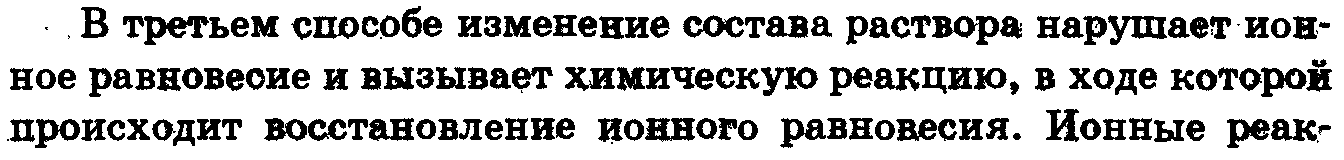
2) Диффузия и ионов. Коэффициент диффузии. Определение, размерность, вывод первого закона Фика. Уравнение первого закона Фика для одномерной и трёхмерной диффузии.


Коэффицие́нт диффу́зии — количество вещества (в массовых единицах), проходящего в единицу времени через участок единичной площади (например, 1 м²) при градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины). Коэффициент диффузии отражает скорость диффузии и определяется свойствами среды и типом диффундирующих частиц. [ {м²}/{сек} ]
3.3) Миграция ионов. Направление движения катиона и аниона. Понятие о подвижности ионов.. Электрохимический потенциал. Общий поток ионов как сумма Потока диффузии и миграции. ур-я Нернста-Эйнштейна. Поток миграции
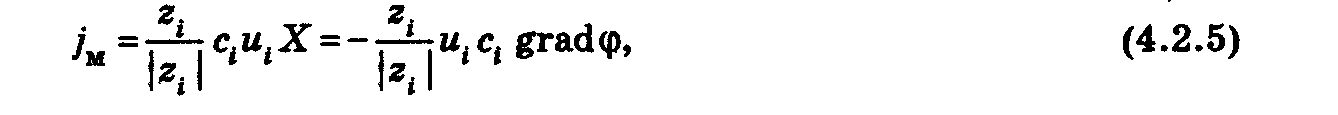 где
Х – напряженность поля, ui
– электрическая подвижность, φ –
электрический потенциал, Ci
– концентрация ионов
где
Х – напряженность поля, ui
– электрическая подвижность, φ –
электрический потенциал, Ci
– концентрация ионов
Общий поток ионов
![]()
![]()
Если ионы сорта i
в среднем не перемещаются в растворе,
т.е.
![]()
Нернста-Эйнтшейна

Электрохимический
потенциал
определяют также как умноженную на
число
Авогадро
работу переноса заряженной частицы i
из бесконечно удаленной точки в вакууме
в данную фазу![]() Формально электрохимический потенциал
разбивают на два слагаемых, характеризующих
хим. и электрич. составляющие такой
работы:
Формально электрохимический потенциал
разбивают на два слагаемых, характеризующих
хим. и электрич. составляющие такой
работы:
![]()
где![]() -
хим. потенциал частиц i в фазе
-
хим. потенциал частиц i в фазе![]() zi
- зарядовое
число
этих частиц;
zi
- зарядовое
число
этих частиц;![]() -
внутр. потенциал фазы
-
внутр. потенциал фазы![]() ,
F — число Фарадея.
,
F — число Фарадея.
Подвижность: Если ион движется с постоянной скоростью v, то сила, действующая со стороны электрического поля, равна по абсолютной величине силе трения. Сила трения равна
Fтрения = kтренияv,
где
kтрения
– коэффициент трения. Так как две силы
равны, то
![]()
Скорость движения пропорциональна напряженности электрического поля.
Коэффициент пропорциональности называют электрической подвижностью иона (u). Если ион радиуса r движется со скоростью v, то для него
kтрения = 6πηr
где η – вязкость среды.
Так как |Fполя| = |Fтрения| , то
Это значит, что большие ионы движутся медленнее маленьких
Однако в водных растворах u(Cs+) > u(K+) > u(Na+) > u(Li+). Это обусловлено более сильной гидратацией ионов металлов с меньшим радиусом.
Для отдельных ионов
λ+
= u+∙v+∙z+∙F
λ–
= u–∙v–∙z–∙F
4.3) Диффузионный потенциал. Уравнение для диффузионного потенциала. Эффективный коэффициент диффузии электролита. Способы устранения диффузионного потенциала.
Р ассмотрим
раствор, в котором D- > D+ , при этом анионы
в начальный момент будут перемещаться
слева направо быстрее, чем катионы. В
результате возникнет простраственное
разделение зарядов и возникнет
электрическое поле, к-е будет ускорять
движение катионов и замедлять движение
анионов. Через н-е время скорости движения
анионов и катионов выровняются, и в
этих условиях можно говорить об общем
потоке электролита. Однако при этом
между двумя областями раствора с
концентрациями с1
и с2
устанавливается стационарная разность
потенциалов – диффузионный потенциал
ассмотрим
раствор, в котором D- > D+ , при этом анионы
в начальный момент будут перемещаться
слева направо быстрее, чем катионы. В
результате возникнет простраственное
разделение зарядов и возникнет
электрическое поле, к-е будет ускорять
движение катионов и замедлять движение
анионов. Через н-е время скорости движения
анионов и катионов выровняются, и в
этих условиях можно говорить об общем
потоке электролита. Однако при этом
между двумя областями раствора с
концентрациями с1
и с2
устанавливается стационарная разность
потенциалов – диффузионный потенциал![]()
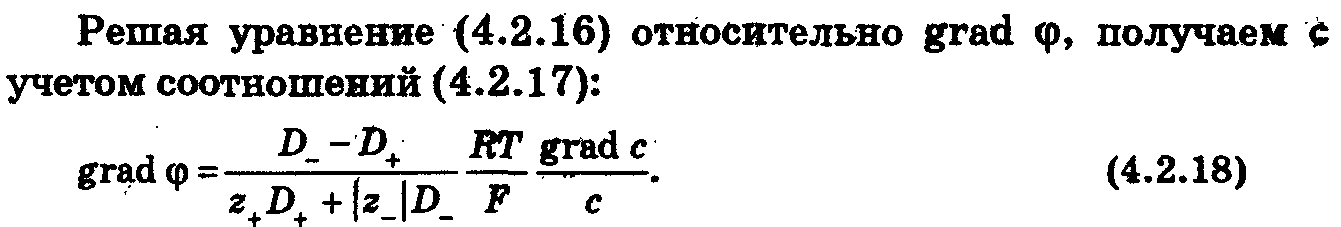


Для растворов одного электролита различной концентрации
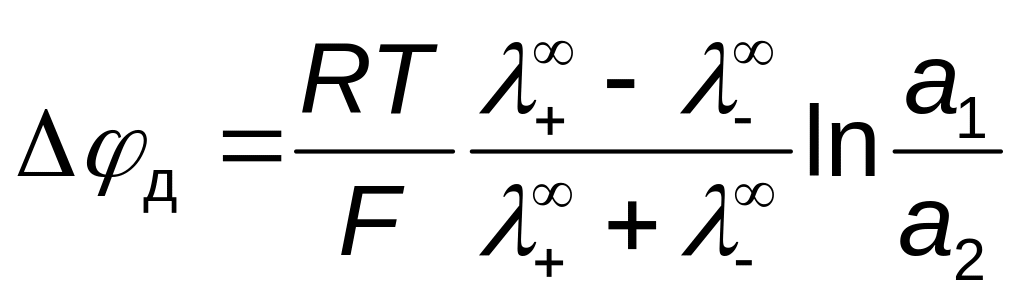
Для растворов двух солей с одинаковым ионом одной концентрации
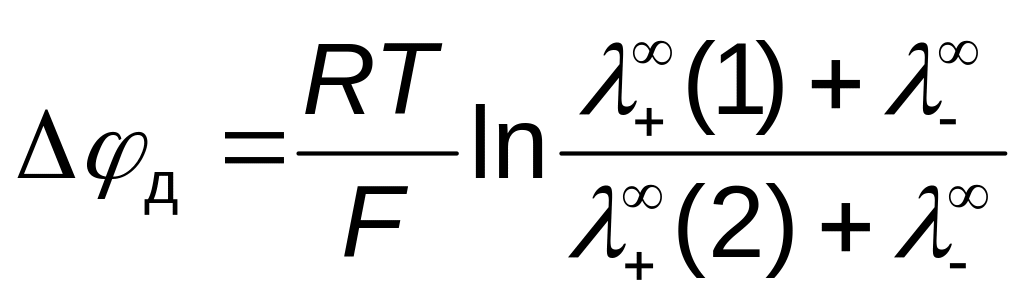
Снижение диффузионного потенциала
Наличие Δφд не позволяет проводить точные измерения э.д.с. электрохимических систем
Для его уменьшения используют метод солевого моста
Между двумя растворами помещают промежуточный концентрированный раствор электролита с близкими значениями подвижностей катионов и анионов. В этом случае одна граница между двумя растворами заменяется на две границы с меньшим потенциалом. Кроме того, потенциалы на этих границах будут меньшими по знаку.
В качестве солевых мостов используют растворы KCl и NH4NO3.
5)Удельная, эквивалентная и молярная электропроводности электролитов. определение. Размерность. Закон Кольрауша. Практическое приложение з-на Кольрауша, определение Константы скорости эд.дис., ПР труднорастворимых солей, Кондуктометрическре титрование.
Удельная электропроводность – электропроводность раствора или расплава, заключенного между двумя электродами площадью по 1 м2, расстояние между которыми равно 1 м
R – электрическое сопротивление
G – электрическая проводимость (электропроводность)
G измеряется в Ом-1 или сименсах (См)
1 Ом-1 = 1 См
![]() или
или![]()
κ – удельная электропроводность (Ом-1см-1)
При увеличении концентрации сильного электролита удельная электропроводность увеличивается вследствие увеличения общего числа ионов в растворе. Дальнейший рост концентрации приводит к уменьшению подвижности ионов вследствие их взаимодействия друг с другом
Удельная электропроводность растворов слабых электролитов значительно ниже удельной электропроводности растворов сильных электролитов вследствие их малой степени диссоциации
t = 25 1 + (t - 25)+ β(t-25)2
Эквивалентная электропроводность в м2/(г-эквОм) это электропроводность объема раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 м друг от друга.
Зависимость
![]() : для сильных электролитов соблюдается
медленное линейное уменьшение
с увеличением
,
что соответствует эмпирической формуле
Кольрауша :
: для сильных электролитов соблюдается
медленное линейное уменьшение
с увеличением
,
что соответствует эмпирической формуле
Кольрауша :
= А
предельная эквивалентная электропроводность при бесконечном разведении : с 0 , .
Или закон кубического корня при более высоких концентрациях
= B
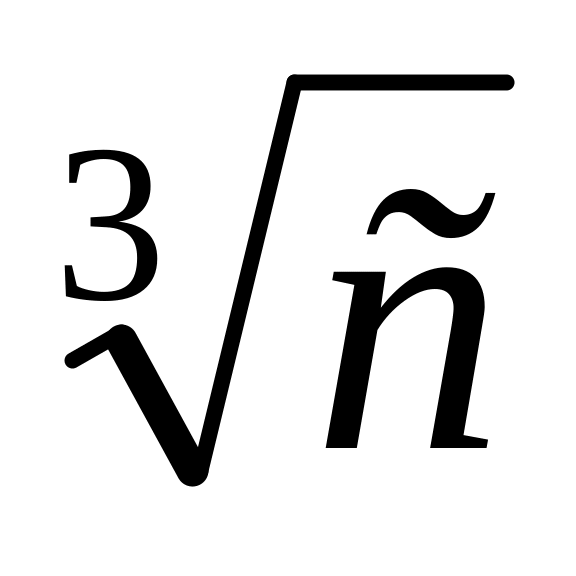
Зависимость от т (T)= (T=0)*(1+αt+βt2)
Молярная
Λm - молярная электропроводность
Единицы измерения См∙м2∙моль-1
Типичные значения ~0.01 См∙м2∙моль-1
Молярная
электропроводность – электропроводность
раствора, содержащего 1 моль соответствующих
ионов![]()
![]() κ = (u+∙v+∙z+
+ u–∙v–∙z–)c∙F
(u+∙v+∙z+
+ u–∙v–∙z–)F
κ = (u+∙v+∙z+
+ u–∙v–∙z–)c∙F
(u+∙v+∙z+
+ u–∙v–∙z–)F
Закон Кольрауша
В бесконечно разбавленном растворе электролита перенос электричества осуществляется всеми ионами независимо друг от друга:
Λm = v+λ+ + v–λ–
где λ+, λ– - подвижности ионов электролита Mv+Av–.
Из подвижностей ионов можно рассчитать молярную электропроводность электролита.
Часто в справочниках молярную электропроводность приводят не на 1 моль ионов, а на 1/z+ или 1/z– ионов, например ½Ca2+.
Зависимость молярной электропроводности для слабых электролитов выражена более сильно, чем для сильных из-за уменьшения их степени диссоциации с ростом концентрации.
Для них
Λm = αΛm
где α – степень диссоциации
методичка стр.22
3.6) Числа переноса и их экспериментальное определение методами движущейся границы и Гитторфа. Определение чисел переноса путём измерения диффузионного потенциала.
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов :
t+
=
![]() =
=
![]() =
=
![]() , t-
=
, t-
=
![]() =
=
![]() =
=
![]()
Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона.
Определение чисел переноса
Числа переноса зависят от природы электролита, его концентрации, температуры и т.д.
Для определения чисел переноса используют различные методы:
метод движущейся границы
метод Гитторфа
метод э.д.с.
Метод движущейся границы
О
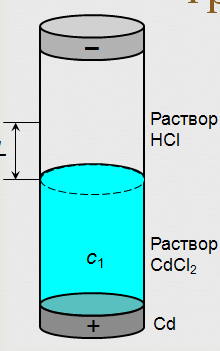 пределяют
расстояние, на которое за известный
промежуток времени переместится под
действием внешнего тока граница между
двумя растворами с одним общим анионом
пределяют
расстояние, на которое за известный
промежуток времени переместится под
действием внешнего тока граница между
двумя растворами с одним общим аниономЕсли граница перемещается на расстояние L, то ионами Cd2+ переносится с1LSz+F Кл электричества.
Тогда
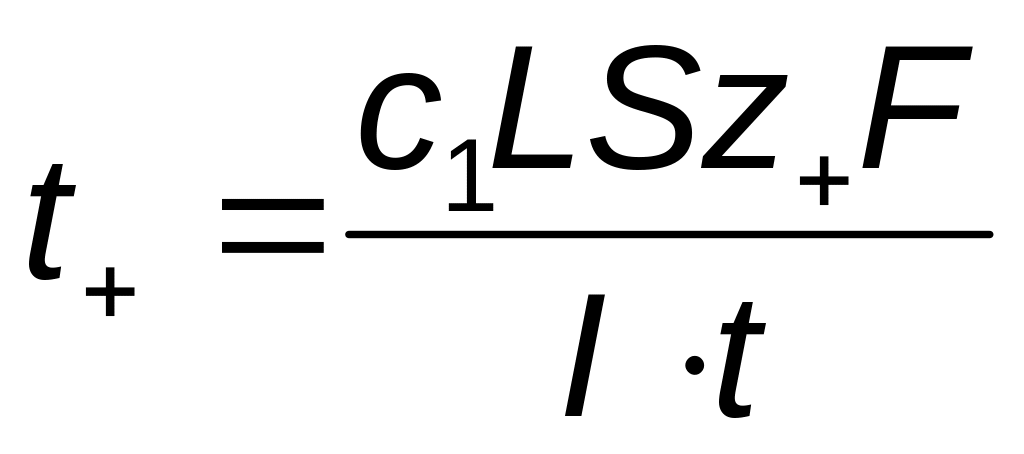
У электролитов должен быть один общий ион (Cl–)
Плотность нижнего раствора больше, чем плотность верхнего
Для сохранения границы между растворами подвижность иона в верхнем растворе должна превышать подвижность иона в нижнем (H+ и Cd2+)
В методе используется различие в показателях преломления исследуемого и индикаторного растворов, и положение границы регистрируется специальной оптической системой.
п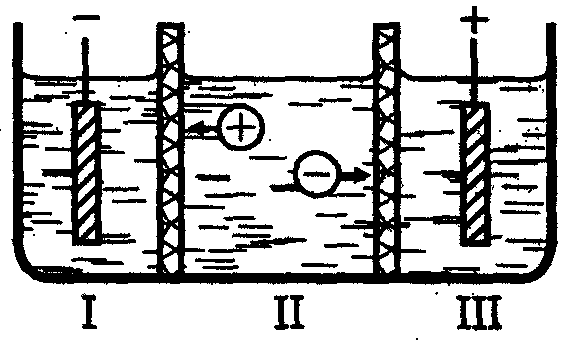 о
изменению концентрации ионов у электродов
(метод Гитторфа).
о
изменению концентрации ионов у электродов
(метод Гитторфа).
Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения : I анодная часть (анолит), II центральная часть, III катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III изменяется. Отношение убыли электролита у анода са и убыли электролита у катода ск, са/ск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей.
t+
=
![]() =
=
![]()
![]()
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса ; они не являются истинными, т.к. этот метод не учитывает сольватации ионов.
