
CuO CuSo4 Cu CuO Cu(no3)2
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+
+ SO42–
→ Cu2+
+ SO42–
+ H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
2Cu + O2 → 2CuO
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ +
2NO3–
→ Cu2+
+ 2NO3–
+ H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
Дано: |
Решение: |
mобр(CaC2) = 100 г ωприм = 15% |
85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л
mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л
|
V(C2H2) – ? |
Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2 Fe(oh)2 FeSo4 FeCl2
0 +1 –1 +2 –1 0
Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ +
2Cl–
+ 2K+
+ 2OH– →
Fe(OH)2↓
+ 2K+
+ 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2
+ 2H+
+ SO42–
→ Fe2+
+ SO42–
+ 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+
+ SO42–
+ Ba2+
+ 2Cl–
→ Fe2+
+ 2Cl–
+ BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
Дано: |
Решение: |
m(CH3COOH) = 120 г m(NaOH) = 60 г |
1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль
M(CH3COOH) = 60 г/моль M(NaOH) = 40 г/моль
m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
m(CH3COONa) – ? |
Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
Дано: |
Решение: |
m(CaC2) = 38,4 г |
38,4 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л
|
V(C2H2) – ? |
Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
Дано: |
Решение: |
m (HCl) = 73 г ω(NaOH) = 4% |
2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль
m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г
|
mр-ра(NaOH) – ? |
Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу вещества, содержащего 80% углерода и 20% водорода, если плотность по водороду равна 15.
Дано: |
Решение: |
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% |
M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль
m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г
ν(C) :
ν(H) =
M(C2H6) = 24 + 6 = 30 г/моль |
CxHy – ? |
Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4 CH3Cl C2H6 C2H4 C2H5OH
CH4 + Cl2
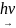 CH3Cl
+ HCl
CH3Cl
+ HCl2CH3Cl + 2Na CH3–CH3 + 2NaCl
CH3–CH3
 CH2=CH2
+ H2
CH2=CH2
+ H2CH2=CH2 + H2O
 CH3–CH2OH
CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2 CH3–CH3 CH3CH2Cl CH3CH2OH CH2=CH2
CH2=CH2 + H2 CH3–CH3
CH3–CH3 + Cl2 CH3CH2Cl + HCl
CH3CH2Cl + KOH(водный р-р) → CH3CH2OH + KCl
CH3CH2OH
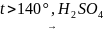 CH2=CH2
+ H2O
CH2=CH2
+ H2O

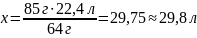
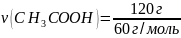 =
2 моль в избытке
=
2 моль в избытке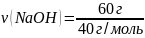 =
1,5 моль в
недостатке
=
1,5 моль в
недостатке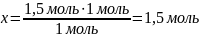

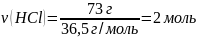

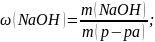
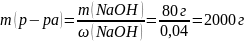

 = 2 : 6 ⇒ С2Н6
= 2 : 6 ⇒ С2Н6