
IV ГРУППА КАТИОНОВ
К IV группе относятся катионы амфотерных элементов: Al3+, Cr3+, Zn2+ ,Sn2+, Sn4+. Групповой реагент – избыток едкой щелочи, растворяющий первоначально осаждающиеся гидроксиды с образованием гидроксокомплексов:
Ме![]() +
nOH
+
nOH![]() = Me(OH)n↓
= Me(OH)n↓
Me(OH)n↓ + (m-n)OH
=
[ Me(OH)]![]()
Подобным образом ведут себя катионы
Pb![]() (II группа) и Sb
(II группа) и Sb![]() (V группа). Для солей
катионов IV группы характерен
гидролиз:
(V группа). Для солей
катионов IV группы характерен
гидролиз:
Sn
+ 2H![]() O
= Sn(OH)
↓
+ 2H
O
= Sn(OH)
↓
+ 2H![]()
2ZnCO![]() ↓
+ 2H
O
= Zn
(OH)
CO
↓
+ H
O
+ CO
↑
↓
+ 2H
O
= Zn
(OH)
CO
↓
+ H
O
+ CO
↑
Al (CO )3 ↓ + 3H O= 2Al(OH) ↓ + 3CO ↑
ОБЩИЕ РЕАКЦИИ КАТИОНОВ IV ГРУППЫ
1.Реакция с едкими щелочами, свойства гидроксидов
Небольшие количества NaOH
или KOH осаждают при
действии на растворы солей катионов IV
группы аморфные гидроксиды, проявляющие
амфотерные свойства. Образующиеся при
действии избытка щелочи комплексные
анионы имеют состав: [Al(OH)![]() ]
,
[Cr(OH)
]
,
[Zn(OH)
]
]
,
[Cr(OH)
]
,
[Zn(OH)
]![]() ,
[Sn(OH)
]
.
Действие кислот вызывает обратную
реакцию. Например:
,
[Sn(OH)
]
.
Действие кислот вызывает обратную
реакцию. Например:
[Al(OH) ] + H = Al(OH) ↓ + H O
Al(OH) ↓ + 3H = Al + 3H O
Интервал рН осаждения гидроксидов дан в справочной литературе. Гидроксохромит-ионы при кипячении легко подвергаются гидролизу:
[Сr(OH) ] + H O = Cr(OH) ↓+ OH
Гидроксоалюминаты при нагревании разлагаются только в присутствии аммонийных солей:
[Al(OH) ] + NH = Al(OH) ↓ + NH +H O
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей катионов IV группы в пробирках осторожно по каплям добавлять разбавленный раствор NaOH . Наблюдать образование осадков, отметить их цвет. Испытать действие кислот (HCl) и избытка щелочи NaOH. Записать уравнения происходящих реакций. Выписать значения ПР гидроксидов и К уст. соответствующих комплексных ионов. Какой из гидроксидов начинает растворяться в избытке ОН-- ионов первым?
2.Реакция с раствором аммиака .
NH + H O осаждает из растворов солей катионы IV группы в виде гидроксидов аналогично действию щелочи на первой ступени. В избытке реагента хорошо растворяется только Zn(OH) с образованием аммиаката [Zn(NH ) ] ; Al(OH) и Cr(OH) незначительно растворяются лишь в избытке концентрированного NH3.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей Al3+,Cr3+,Zn2+ и Sn2+ добавлять по каплям NH3.Что наблюдается? Продолжить добавлять NH3.Что произойдет? Записать уравнения происходящих реакций.
3. Реакция с карбонатом натрия .
Na2CO3 осаждает катионы Al3+,Cr3+,Sn2+ в виде гидроксидов, Zn2+- в виде гидроксосолей переменного состава Zn2(OH)2CO3, Zn3(OH)2(CO3)2. Образование осадков указанного состава связано с гидролизом карбонатов. Осадки растворимы в избытке щелочей, кислотах, а гидроксокарбонат цинка, кроме того, в аммиаке.
В ы п о л н е н и е р е а к ц и и. К растворам солей катионов IV группы добавить равный объём Na2CO3. Отметить цвет выпавших осадков, выделение газа. Испытать растворимость осадков в растворах HCl, NaOH, NH3. Записать уравнения реакций.
4. Действие сероводородной воды. Раствор H2S осаждает из солянокислых растворов катионы олова, из уксуснокислых - цинка, из аммиачных – алюминия и хрома (III). Причем, Al3+ и Cr 3+осаждаются,
вследствие полного гидролиза сульфидов, в виде гидроксидов.
В ы п о л н е н и е р е а к ц и и . К растворам солей катионов IV группы добавить раствор H2S. Проверить образование и растворение осадков в зависимости от рН среды. Записать уравнения реакций (Тяга!)
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Al
Алюминий во всех соединениях проявляет степень окисления +3. Образует большое число стабильных комплексных ионов: [AlF6]3-, [Al(C2O4)3]3-, [AlОН(Н2С4О6)2] 6-. Большое значение имеют устойчивые внутрикомплексные ионы с органическими реагентами, содержащими OH- (тартраты, цитраты). Большинство солей алюминия сильных кислот хорошо растворимо в воде.
1. Реакция с ализарином.
Ализарин и некоторые его производные (1) образуют в аммиачной среде с Al малорастворимое внутрикомплексное соединение ярко-красного цвета, называемое «алюминиевым лаком», предположительно следующего состава (П):
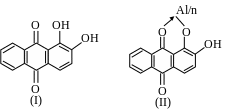
Предполагают, что осадок является адсорбционным соединением гидроксида алюминия и ализарина. Соединение образуется в результате химической адсорбции, т.е. ализарин или его анион взаимодействует с ионами алюминия на поверхности частичек геля гидроксида алюминия:
(Al2O3*x H2O)n + HR= (Al2O3*x H2O)n-1*Al(OH)2R +H2O
(Al2O3*x H2O)n + R-= (Al2O3*x H2O)n-1* Al(OH)2R + OH-
гель лак
Ионы железа, хрома, марганца и другие мешают определению алюминия, так как образуют окрашенные ализариновые лаки. Для маскировки используют K4[Fe(CN)6], который их осаждает. Реакцию лучше проводить капельным методом.
В ы п о л н е н и е р е а к ц и и . На полоску фильтровальной бумаги нанести каплю соли Al , обработать 1-2 минуты парами 25% NH , затем нанести каплю раствора ализарина и снова подержать в парах NH . Образуется ализаринат алюминия.
В присутствии мешающих ионов, образующих
окрашенные соединения с ализарином
(Cr
,
Sn
,
Fe
,Cu
,Co
,
Mn2+), полоску
фильтровальной бумаги предварительно
пропитывают K
[Fe(CN)![]() ],
с которым мешающие катионы дают
малорастворимые соли, остающиеся в
центре пятна, просушивают. Катионы Al
,
не осаждаемые K
[Fe(CN)
],
диффундируют на периферию и обнаруживаются
аналогичным путем. В
ы п о л н е н и е р е а к ц и и . Смешать
в пробирке несколько капель солей
Al
,Cr
,Sn
.Обработать
полоску фильтровальной бумаги раствором
K
[Fe(CN)
],
слегка подсушить. В центр нанести каплю
смеси и через минуту каплю воды для
вымывания адсорбированного Al
.
Пятно обработать парами NH
.
По периферии обвести пятно капилляром
с раствором ализарина и снова обработать
парами NH
.
Наблюдать появление розового кольца,
характерного для Al
,
на фиолетовом фоне, представляющем
окраску ализарина в щелочной среде.
Если полоску высушить, аммиак улетучивается
и фиолетовая окраска переходит в жёлтую.
Реакция применяется для дробного
открытия Al
.
],
с которым мешающие катионы дают
малорастворимые соли, остающиеся в
центре пятна, просушивают. Катионы Al
,
не осаждаемые K
[Fe(CN)
],
диффундируют на периферию и обнаруживаются
аналогичным путем. В
ы п о л н е н и е р е а к ц и и . Смешать
в пробирке несколько капель солей
Al
,Cr
,Sn
.Обработать
полоску фильтровальной бумаги раствором
K
[Fe(CN)
],
слегка подсушить. В центр нанести каплю
смеси и через минуту каплю воды для
вымывания адсорбированного Al
.
Пятно обработать парами NH
.
По периферии обвести пятно капилляром
с раствором ализарина и снова обработать
парами NH
.
Наблюдать появление розового кольца,
характерного для Al
,
на фиолетовом фоне, представляющем
окраску ализарина в щелочной среде.
Если полоску высушить, аммиак улетучивается
и фиолетовая окраска переходит в жёлтую.
Реакция применяется для дробного
открытия Al
.
2. Реакция сухим путем с солями кобальта(II).
Твёрдые соли алюминия после обработки разбавленным раствором Co(NO ) и прокаливания окрашиваются в синий цвет вследствие образования алюмината кобальта Co(AlO ) , называемого «тенаровой синью»:
2Al (SO ) + 2Co(NO ) =2Co(AlO ) + 6SO ↑+ 4NO ↑ + O ↑
Избыток соли кобальта вредит реакции, так как при прокаливании образуется черный оксид, маскирующий тенаровую синь.
В ы п о л н е н и е р е а к ц и и. Смочить
полоску фильтровальной бумаги раствором
соли Al
,
разбавленной HNO
и подсушить над горелкой. Затем смочить
разбавленным раствором нитрата кобальта
(0.05М) и сжечь. При наличии Al
пепел приобретает тёмно- синюю окраску.
Проведению реакции мешают катионы
Zn
,Cr![]() ,Cu
,Ni
.
,Cu
,Ni
.
Для Al3+ также характерны реакции с 8- оксихинолином при рН 4,5 – 10
( жёлтый оксихинолинат); с морином при рН 4-6 (люминесцентная реакция), алюминоном ( комплекс красного цвета).
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Cr
Хром образует два ряда устойчивых
солей: растворы солей, содержащие
гидратированные Cr
,
имеют зеленую или фиолетовую окраску;
растворы, содержащие CrO
2-
- желтую, Cr
O![]() -
оранжевую. Хромат и дихромат- ионы
являются сильными окислителями
(Е
-
оранжевую. Хромат и дихромат- ионы
являются сильными окислителями
(Е![]() Сr
O
/2Cr
= 1,33 в).
Сr
O
/2Cr
= 1,33 в).
1. Реакции окисления Cr(III) до Cr(VI).
а) Окисление в щелочной среде. При действии H O в щелочной среде и нагревании происходит изменение окраски соли хрома в жёлтую за счет окисления Cr в CrO :
Cr + 4OH = [Cr (OH) ]
2[Cr (OH) ] + 3H O + 2OH = 2CrO + 8 H O
[Cr (OH)
]
+ 4OH
=
CrO
+
4H
O
+ 3е¯
H
O
+ 2
![]() = 2OH
= 2OH
В ы п о л н е н и е р е а к ц и и . К 3-4 каплям раствора соли хрома (III) прибавить 8-10 капель раствора NaOH до образования гидроксохромита, 3-4 капли 5% Н О и нагреть в течение нескольких минут. Какие внешние изменения наблюдаются? Записать уравнения реакций, объяснить направленность второй реакции. Раствор сохранить для выполнения п. в)
б) Окисление в кислой среде. Проводится
действием более сильных окислителей,
таких как KMnO
,
(NH
)S
O![]() .
Окисление сопровождается образованием
дихромат -
.
Окисление сопровождается образованием
дихромат -
иона оранжевого цвета по уравнению:
2Сr + 3S O + 7H O = Cr O + 6SO + 14H
2Cr
+ 2MnO
![]() +
5H
O
= 2 MnO(OH)
↓+
Cr
O
+ 6H
+
5H
O
= 2 MnO(OH)
↓+
Cr
O
+ 6H
В реакции с персульфатом аммония катализатором являются катионы Ag .
В ы п о л н е н и е р е а к ц и и . В пробирку с 5-6 каплями персульфата аммония добавить по 1 капле 2N H SO и AgNO . В полученную окислительную смесь ввести 2-3 капли раствора нитрата или сульфата хрома (III). Нельзя брать CrCl , так как может идти окисление Cl в Cl .Нагреть смесь. Наблюдать изменение окраски раствора. Раствор сохранить для п.в). Написать уравнения реакций окисления Cr в щелочной и кислой средах, разобрать окислительно-восстановительные процессы, пользуясь ионно-электронным методом.
в) Получение надхромовой кислоты (H Cr O ).
При действии на подкисленный раствор хромата или дихромата H O образуется надхромовая кислота, вследствие чего раствор окрашивается в интенсивно-синий цвет:
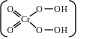
Cr O + 4H O + 2H = 2H CrO + 3H O
В водных растворах пероксидные соединения хрома неустойчивы, происходит их разложение с образованием Cr . Они устойчивы в органических растворителях (диэтиловом эфире, амиловом спирте и других).
В ы п о л н е н и е р е а к ц и и . Составить в двух пробирках смесь из равных объёмов перекиси водорода, 2N серной кислоты и эфира. Прибавить в одну пробирку несколько капель полученного раствора CrO в другую - Cr O . Наблюдать окрашивание эфирного слоя в синий цвет.
2. Реакция соосаждения.
NaOH или KOH при действии на катион Cr в присутствии Zn образует осадок цинката хрома , нерастворимого в избытке щелочи.
В ы п о л н е н и е р е а к ц и и .Смешать в пробирке по нескольку капель растворов хлорида хрома (III) и хлорида цинка. Перемешать и добавить избыток NaOH . Описать что происходит. Сравнить действие избытка щелочи на соли хрома (III) и цинка без смешивания.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Zn
Во всех соединениях степень окисления цинка равна двум. Ион Zn бесцветен.
1.Реакция с гексоцианоферратом калия (II).
K [Fe(CN) ] образует с Zn белый осадок двойной соли:
3Zn2++2K++2[Fe(CN)6]4-=K2Zn3[Fe(CN)6]2↓ .
Осадок растворим в щелочах с образованием гидроксокомплекса. K3[Fe(CN)6] осаждает коричнево- жёлтый осадок Zn3[Fe(CN)6]2 , растворимый в соляной кислоте и аммиаке.
В ы п о л н е н и е р е а к ц и и . В две пробирки с несколькими каплями соли Zn2+ добавить реагенты. Отметить цвет образующихся осадков. Проверить действие растворов HCl, NaOH, NH3. Записать уравнения происходящих реакций.
2. Реакция с дитизоном.
Раствор дитизона в хлороформе или четырёххлористом углероде образует с Zn2+ в щелочной среде внутрикомплексную соль,окрашенную в малиново- красный цвет. В отличие от дитизонатов других элементов эта соль окрашивает в щелочной среде не только слой CHCl3, но и водный слой. В кислых растворах дитизонат цинка растворим. Дитизон или дифенилтиокарбазон имеет следующий состав и строение:
S |
Цинк проявляет координационное число, равное четырём:
C
С=S S =С
C6H5 –– N = N N = N –– C6H5 |
Предел обнаружения – 1 мкг. Мешают Ag(I), Bi(III), все катионы VI группы. Их маскируют тиосульфатом, цианидом, либо осаждают в виде сульфидов.
В ы п о л н е н и е р е а к ц и и . Реакцию удобно проводить следующим образом: на полоску фильтровальной бумаги нанести каплю соли цинка, 2-3 капли раствора NaOH. Затем влажное пятно обвести по периферии капилляром с раствором дитизона. Отметить цвет кольца, характерный для Zn2+ . Если ионы Zn2+ отсутствуют, образуется кольцо оранжевого цвета, характерное для дитизона в щелочной среде. Параллельно провести холостой опыт: нанести рядом 2 капли раствора NaOH и подействовать каплей дитизона.
3. Реакция с сероводородной водой.
H2S
осаждает Zn2+ в виде
белого осадка уже в кислой среде при
рН![]() 2,5.
Более полное осаждение достигается при
добавлении ацетата натрия, связывающего
катионы водорода:
2,5.
Более полное осаждение достигается при
добавлении ацетата натрия, связывающего
катионы водорода:
Zn2+ + H2S+2CH3COO- = ZnS↓ + 2CH3COOH
В ы п о л н е н и е р е а к ц и и . К нескольким каплям раствора соли цинка добавить равный объём ацетата натрия и небольшой избыток сероводородной воды. Наблюдать образование осадка. Проверить его растворимость при рН<1.
4. Реакция сухим путём с солями кобальта (II).
При совместном прокаливании солей цинка и нитрата кобальта образуется цинкат кобальта зелёного цвета, называемый «ринмановой синью», по уравнению:
Zn(NO3)2 +Co(NO3)2 = CoZnO2 + 4NO2↑ + O2↑
Опыт проводится аналогично Al3+ и Co(NO3)2.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНОВ Sn (П) И Sn (IV)
Олово образует два типа соединений, в которых проявляет степени окисления +2 и +4. Растворы солей бесцветны.
1. Реакции восстановления, проводимые солями олова (II).
E0Sn(IY) /Sn(11) =0,15 в, соответственно этому Sn2+ -ион является довольно сильным восстановителем.
а) Реакция с нитратом висмута. В щелочной среде Bi3+ восстанавливается солями Sn2+ до свободного состояния, металлический висмут выпадает в виде чёрного осадка:
Sn2+ + 4OH- = [Sn(OH)4]2-
3[Sn(OH)4]2- +2Bi3+ + 6OH- = 2Bi↓ + 3[Sn(OH)6]2-
В щелочной среде восстановительная способность Sn2+ возрастает. Подумать, почему. Следует избегать нагревания, так как станнит может разлагаться и выпадать в виде чёрного металлического Sn0:
2[Sn(OH)4]2- = [Sn(OH)6]2- + Sn↓ + 2OH-
В ы п о л н е н и е р е а к ц и и . К 3-4 каплям Sn2+ прилить 6-8 капель раствора щелочи до образования станнита и 1-2 капли раствора соли висмута. Написать уравнения реакций и объяснить их.
б) Реакция с хлоридом ртути (II).
Взаимодействие протекает по уравнениям:
2HgCl2 + [SnCl4]2- = Hg2Cl2 + [SnCl6]2-
Hg2Cl2+ [SnCl4]2- = Hg↓+ [SnCl6]2-
и сопровождается образованием осадка, чернеющего вследствие образования металлической ртути.
В ы п о л н е н и е р е а к ц и и . К 2-3 каплям раствора хлорида олова (II) прибавить 1 каплю раствора HgCI2. Наблюдать, что с осадком происходит в течение времени.
2. Реакции окисления, производимые Sn(II).
Металлический цинк восстанавливает олово(II) до свободного состояния. Металлическое олово осаждается в виде серого губчатого слоя. В отличие от сурьмы олово растворимо в НСI , поэтому раствор не должен быть слишком кислым.
3. Реакции окисления, производимые Sn(IV).
а) Металлические Mg, Al, Fe восстанавливают ионы [SnCI6]2- до Sn2+, что может быть использовано в ходе анализа, например:
Fe↓ + [SnCI6]2- = Fe2+ + Sn2+ + 6CI¯
Реакцию ведут в присутствии НСI . При недостатке кислоты восстановление может привести к образованию металлического олова, которое при подкислении растворяется.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям раствора соли Sn(IV) добавить равный объем HCI 1:1 и одну гранулу Al. Проверить исходный раствор и образовавшийся на присутствие олова (II) реакцией с Bi(NO3)3.
4.Реакция с диметилглиоксимом .
Диметилглиоксим или реактив Чугаева образует с ионами олова(П) или олова (IV) в присутствии ионов железа (П) смешанное комплексное соединение красного цвета, экстрагируемое бутанолом.
В ы п о л н е н и е р е а к ц и и . К 1 мл солянокислого раствора Sn (IV) добавить железные опилки и нагреть до появления пузырьков газа. Олово восстанавливается
до степени окисления (П) и в раствор переходят ионы железа (П). Добавить 1 мл раствора ДМГ, 1 мл раствора гидроксида натрия и 1-2 мл бутанола, смесь взболтать. Органический слой окрашивается в красный цвет.
ХОД АНАЛИЗА КАТИОНОВ IV ГРУППЫ
Рационально проводить дробный ход анализа, используя характерные реакции катионов. Прежде всего рассмотреть цвет раствора, наличие осадка, измерить рН. Сделать выводы. Для дробного анализа можно рекомендовать следующие реакции:
а) Открытие Cr3+. В отдельной порции раствора провести реакции окисления до CrO42- или Cr2O72-.
б) Открытие Al3+. Реакция с ализарином при использовании K4[Fe(CN)6] как осадителя мешающих ионов.
в) Открытие Sn2+. Реакция с солями висмута при избытке щелочи.
г) Открытие Zn2+. 1. Реакция с дитизоном, гексацианоферратами. 2. Отделение цинка в виде аммиаката, разрушение комплекса уксусной кислотой и открытие катионов цинка характерными реакциями.
V группа катионов
К V группе относятся катионы Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb(У). Групповой реагент- раствор щелочи, осаждающий данные катионы в виде гидроксидов. В отличие от IV группы, гидроксиды катионов V группы не обладают амфотерными свойствами, кроме Sb(III). Железо, марганец и сурьма имеют переменную степень окисления, для них характерны реакции окисления-восстановления. Рассматриваемые катионы обладают тенденцией к комплексообразованию.
ОБЩИЕ РЕАКЦИИ КАТИОНОВ V ГРУППЫ
1. Реакция с едкими щелочами, свойства гидроксидов.
NaOH, KOH осаждают аморфные гидроксиды катионов V группы по уравнению:
Men+ + nOH- = Me(OH)n↓
За исключением Fe(OH)3 все окрашены в белый цвет. Свежеприготовленный Fe(OH)2 имеет белый цвет, но на воздухе в результате частичного окисления приобретает грязно- зелёную окраску. Конечный продукт окисления- Fe(OH)3:
4Fe(OH)2 ↓+ O2 + 2H2O = 4 Fe(OH)3↓
Mn(OH)2 также неустойчив и буреет вследствие окисления
2Mn(OH)2 ↓ + O2 = 2MnO(OH)2
Гидроксиды растворяются в кислотах, а Sb(OH)3 и в щелочах:
Sb(OH)3 ↓+ 3NaOH = Na3[Sb(OH)6]
Интервал рН осаждения гидроксидов дан в справочниках по аналитической химии. Выполнение реакции. К нескольким каплям растворов солей катионов V группы в пробирках добавлять по каплям раствор NaOH. Описать окраску образующихся гидроксидов. Разделить осадки с раствором на 2 части и проверить их растворимость в кислотах и щелочах. Записать уравнения реакций.
2. Реакция с раствором аммиака. NH +H O осаждает из растворов солей катионы V группы виде гидроксидов, обладающих рассмотренными свойствами. Mn(OH)2 , Mg(OH)2,
Fe(OH)2, кроме того, обладают частичной растворимостью в солях аммония. Причина заключается в сравнительно большой величине ПР этих гидроксидов (см.справочную литературу),которое не достигается при [OH-] , создаваемой аммонийной буферной смесью . Поэтому, раствор NH3 в качестве группового реагента использовать нельзя.
Выполнение реакции. К растворам солей катионов V группы добавить равный объём раствора аммиака. Наблюдать образование гидроксидов. Проверить их растворимость в NH4Cl, HCl, NaOH. Записать уравнения реакций.
3. Реакция с карбонатом натрия.
При действии Na2CO3 на соли катионов V группы образуются карбонаты MnCO3 и FeCO3, гидроксокарбонаты Mg2(OH)2CO3, FeOHCO3, BiOHCO3 и гидроксид Sb(OH)3. Состав основных солей может меняться в зависимости от концентрации раствора и температуры. Все осадки растворяются в минеральных кислотах. Гидроксокарбонат магния, кроме того, в солях аммония.
Карбонат железа (II) на воздухе быстро буреет вследствие окисления ионов железа (П).
Выполнение реакции. Подействовать на несколько капель растворов изучаемых солей равным объёмом карбоната натрия. Рассмотреть цвет осадков. Происходит ли выделение СО2? Почему? Проверить растворимость осадков в HCl, NH4Cl, NaOH. Записать уравнения реакций.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Fe2+
Растворы солей Fe2+ окрашены в бледно- зелёный цвет, разбавленные растворы бесцветны. На воздухе быстро буреют за счет окисления кислородом воздуха.
Реакция с гексацианоферратом (III) калия.
K3[Fe(CN)6] дает с катионами Fe2+ синий осадок «турнбулевой сини»:
Fe2+ + K+ + [Fe(CN)6] 3-= KFe[Fe(CN)6] ↓
Реакцию следует проводить при рН 2-3, щелочи вызывают разложение осадка. Реакция высоко избирательна.
Выполнение реакции. Налить в пробирку 2-3 капли сульфата железа (II) , добавит ь4-5 капель воды , 2-3 капли раствора соляной кислоты и 2 капли реагента. Что наблюдается?
Реакция с диметилглиоксимом (реактив Чугаева).
C4H6N2(OH)2 образует с Fe2+ в аммиачном растворе внутрикомплексную соль ярко-красного цвета, хорошо растворимую в воде, имеющую следующее строение:
 H
H
CH3 O O CH3
С = N N = C
Fe
С = N N = C
CH3 O O CH3
H
Реакция проводится при рН~ 9. Катионы Ni2+ дают аналогичный эффект. Мешающее влияние железа (III) ,образующего в аммиачной среде окрашенный гидроксид устраняют добавлением лимонной, щавелевой или винной кислот.
Выполнение реакции. К 2-3 каплям раствора содержащего Fe2+ добавляют каплю 20% раствора винной кислоты, 1 каплю диметилглиоксима и по каплям раствор аммиака до щелочной реакции. Раствор окрашивается в красный цвет.
3.Окисление Fe2+.
Ион Fe2+ представляет довольно сильный восстановитель, способный окисляться при действии окислителей с E0>E0Fe3+/Fe2+. Например, раствор азотной кислоты при нагревании действует так:
3Fe2+ + 4H+ + NO3¯ = 3Fe3++ NO↑ + 2H2O
Выполнение реакции. К 4-5 каплям раствора FeSO4 добавить 3 капли 2N H2SO4 и 2-3 капли 6N HNO3, смесь нагреть. Какие наблюдаются внешние изменения? Обосновать направленность реакции.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Fe3+
Растворы солей Fe3+ устойчивы на воздухе и имеют желтую или красно-бурую окраску.
Реакция с гексацианоферратом (II) калия.
K4[Fe(CN)6] образует с Fe3+ темно-синий осадок «берлинской лазури»:
Fe3+ + K+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓
Как показывают рентгеноструктурные исследования, турнбулева синь и берлинская лазурь имеют одинаковую кубическую решетку. Атомы Fe(II) окружены атомами углерода, а атомы Fe(III) – азота цианидных групп, таким образом, состав образующегося полимерного иона можно представить следующим образом: [FeII(CN)FeIII]. Реакцию проводят в кислой среде, так как едкие щелочи разлагают осадок с выделением Fe(OH)3. Реакция высоко избирательна.
Выполнение реакции. В пробирку с несколькими каплями FeCl3 добавить 3-4 капли дистиллята, 1-2 капли соляной кислоты и 2 капли реагента. Наблюдать образование характерного осадка.
2.Реакция с тиоцианатом аммония (калия).
NH4SCN образует с солями железа (III) тиоцианат железа кроваво- красного цвета. В зависимости от концентрации реагента могут образоваться комплексы различного состава [Fe(SCN)n]3-n , где n= 1-6. Поскольку реакция обратима, добавление избытка SCN¯ усиливает окраску. Комплексы железа хорошо экстрагируются изоамиловым спиртом или эфиром. Реакция имеет низкий предел обнаружения, высоко избирательна. Мешают анионы F¯, PO43¯, некоторые органические кислоты, дающие с Fe3+ растворимые бесцветные комплексы типа [FeF6]3-, [Fe(PO4)2]3-.
Выполнение реакции. В пробирку с 1-2 каплями хлорида железа (III) и 4-5 каплями раствора соляной кислоты по каплям добавлять раствор NH4SCN. Добавить несколько капель C5H11OH. Что наблюдается? Повторить тот же опыт в присутствии NaF. Сравнить результаты. Реакция с иодидом калия.
Поскольку катионы Fe3+ являются окислителями, при взаимодействии с KI происходит выделение свободного иода :
2Fe3+ + 2I- = 2Fe2+ + I2
Органические растворители: бензол, хлороформ экстрагируют йод из водного слоя и окрашиваются в фиолетовый цвет.
Выполнение реакции. В пробирку с несколькими каплями FeCl3 добавить равный объём KI. Отметить происходящие изменения. Добавить 1мл бензола, хорошо встряхнуть. Что наблюдается? Обосновать направленность реакции.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Mn2+
Растворы солей Mn2+ имеют бледно-розовую окраску, разбавленные растворы - бесцветны. Характерными являются окислительно- восстановительные реакции, в которых происходит окисление Mn2+ до высших степеней окисления в зависимости от природы окислителя и рН раствора. Устойчивы соединения, в которых марганец проявляет степень окисления +2, +4, +7.
Окисление Mn2+ до МnO4¯ кислой среде.
В качестве окислителей можно использовать (NH4)2S2O8, PbO2, NaBiO3. Окисление идёт по уравнениям:
2Mn2+ + 5PbO2 + 4H+ = 2MnO4¯ +5Pb2+ + 2H2O (а)
2Mn2+ + 5S2O82-+ 8 H2O=2MnO4¯ + 10 SO42- + 16H+ (б)
Обе реакции проводят в азотнокислой среде (рН<2), при умеренном нагревании, малой концентрации Mn2+. Анионы- восстановители Cl¯,Br¯,I¯ и другие, мешают, так как проводят восстановление образующегося MnO4¯, такое же действие может оказать избыток Mn2+.
2MnO4¯ + 10Cl¯ + 16H+ = 2Mn2+ + 5Cl2 ↑+8 H2O
2MnO4¯ + 3Mn2+ + 7H2O = 5MnO(OH)2 ↓+ 4H+
Реакция (б) протекает в присутствии катализатора AgNO3:
2Ag+ + S2O82- = 2Ag2+ + 2SO42-
Mn2++ 5Ag2++ 4H2O= MnO4¯ + 5Ag+ + 8H+
Катализатор регенерируется и снова вступает в реакцию. В отсутствии Ag+ и избытке Mn2+ образуется бурый осадок MnO(OH)2.
Выполнение реакций.
а) Поместить в пробирку немного PbO2, добавить 1мл 6 N HNO3, нагреть. Через 1-2 минуты рассмотреть цвет раствора. Если окраска будет малиновая, PbO2 содержит следы марганца и для опыта непригодна. Если же окраски нет, добавить 2-3 капли исследуемого раствора Mn2+ , разбавленного в 10 раз, перемешать и снова нагреть. Что наблюдается?
б) В пробирку поместить немного (NH4)2S2O8, добавить 6-8 капель раствора HNO3, 2 капли AgNO3 и нагреть. В нагретую смесь внести палочку, смоченную разбавленным раствором Mn2+. Отметить наблюдаемые явления. Если выпадает MnO(OH)2, то повторить опыт, уменьшив концентрацию соли марганца.
Разобрать обе реакции методом полуреакций, объяснить их направленность.
Окисление Mn2+ до MnO(OH)2 в щелочной среде.
H2O2, Cl2+ H2O, Br2+ H2O в щелочной среде окисляют Mn2+ до марганцоватистой кислоты, выпадающей в виде тёмно- бурого осадка:
Mn2+ + OH- + H2O2= MnO(OH)2 ↓+ H2O
MnO(OH)2 нерастворим в растворе серной кислоты. Если, кроме H2SO4 , прибавить еще 1-2 капли H2O2, то идёт растворение:
2MnO(OH)2 ↓+ 8H+ + 2 H2O2= 2Mn2++ 8 H2O + O2↑
Выполнение реакции. К нескольким каплям MnSO4 или Mn(NO3)2 добавить равные объёмы NaOH и H2O2. Слегка подогреть. Что наблюдается? Испытать действие растворов H2SO4 и H2O2. Разобрать переход электронов в окислительно- восстановительных реакциях, пользуясь методом полуреакций.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Mg2+
Растворы солей магния бесцветны.
Реакция с гидрофосфатом натрия.
Na2HPO4 даёт с Mg2+ в присутствии аммиачного буфера белый кристаллический осадок двойного фосфата:
Mg2+ + HPO42- + NH3(р-р)= MgNH4PO4↓
Кристаллы имеют характерную форму (Основы аналитической химии, практическое руководство, стр. 24). При рН>9 могут выпасть осадки Mg(OH)2 и Mg3(PO4)2.
Выполнение реакции.
а) Смешать в пробирке 3-4 капли раствора соли Mg2+, 4-6 капель 2N HCl и 1-2 капли Na2HPO4. Затем по каплям прибавлять 10% раствор аммиака. Сначала аммиак расходуется на нейтрализацию H+ с образованием NH4+, затем начинается осаждение двойного фосфата. Из разбавленных растворов осадок выпадает не сразу. Способствует созданию центров кристаллизации трение стенок пробирки стеклянной палочкой.
б) Микрокристаллоскопическая реакция.
На предметное стекло помещают каплю раствора, содержащего Mg2+, рядом помещают каплю раствора реагента (смесь Na2HPO4 , NH4Cl и NH3). Стеклянной палочкой соединяют капли и рассматривают под микроскопом образовавшиеся кристаллы.
Реакция с 8- оксихинолином.
C9H7ON образует с аммиачным раствором соли магния зеленовато- жёлтый кристаллический осадок, представляющий внутрикомплексную соль состава:
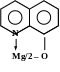
Выполнение реакции. К 2-3 каплям раствора соли магния добавить по равному объёму растворов NH3 и NH4Cl и 5% спиртового или аммиачного раствора реагента. Реакцию лучше проводить при нагревании во избежание выпадения в осадок самого спиртового раствора оксихинолина.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Bi3+
Висмут в соединениях проявляет степени окисления +3 и +5. Растворы солей висмута бесцветны.
Гидролиз.
Соли висмута гидролизуются по уравнению:
Bi3+ + Cl- +2 H2O= Bi(OH)2Cl↓ + 2H+
Образующийся гидроксохлорид неустойчив и разлагается с образованием хлористого висмутила :
Bi(OH)2Cl = BiOCl↓ + H2O
Реакцию лучше проводить с BiCl3, так как растворимость BiOCl меньше, чем BiONO3. Мешают соли сурьмы. В отличие от SbOCl , оксохлорид висмута не растворяется в винной кислоте.
Выполнение реакции. К нескольким каплям хлорида висмута добавить 5-7 кратный избыток воды. Что наблюдается? Проверить рН раствора.
2.Реакция восстановления Bi3+ до металлического Bi0.
При действии Sn2+ в щелочной среде происходит взаимодействие по уравнению:
Sn2+ +4OH- = [Sn(OH)4]2-
2Bi3+ + 3[Sn(OH)4]2- + 2OH-= 2Bi0 + 3[Sn(OH)6]2-
и сопровождается образованием металлического висмута в виде черного осадка.
Мешают соли Hg2+ и Sb3+.
Выполнение реакции. К 2 каплям свежеприготовленного раствора SnCI2 прибавить 8-10 капель раствора NaOH до образования гидроксостаннит-иона, затем каплю Bi(NO3)3. Наблюдать выпадение осадка.
3.Реакция с иодидом калия.
КI образует с солями Bi3+ черный осадок иодида висмута, растворяющийся в избытке реагента с образованием тетраиодовисмутат- иона оранжевого цвета:
Bi3+ + 3Iֿ = BiI3 ↓
BiI3↓ + I- = [ BiI4 ] –
Выполнение реакции. К нескольким каплям раствора хлорида висмута добавлять по каплям раствор КI. Что происходит?
4. Реакция с тиомочевиной.
SC(NH2)2 при действии на азотнокислые растворы солей висмута образует комплексные ионы состава [Bi[SC(NH2)2] 3]3+ оранжевого цвета. Ионы Pb2+ и Cd2+ дают с тиомочевиной малорастворимые соединения, но обнаружению ионов висмута не мешают. Аналогично реагируют с тиомочевиной катионы сурьмы.
Выполнение реакции. В пробирку с несколькими каплями соли висмута поместить несколько кристалликов тиомочевины. Отметить происходящие изменения.
5. Реакция с сероводородной водой и тиосульфатом натрия.
При действии H2S+ H2O или Na2S2O3 на соли висмута при нагревании выпадает черно-бурый сульфид висмута:
2Bi3+ + 3H2S = Bi2S3 ↓+ 6H+,
2Bi3+ + 3S2O32- + 3H2O = Bi2S3 ↓+ 6H+ + 3SO42-
Выполнение реакции. К раствору Bi(NO3)3 добавить несколько капель 2н H2SO4 и несколько кристалликов Na2S2O3. Подогреть, наблюдать выпадение сульфида висмута. Провести опыт с сероводородной водой.
ХАРАКТЕРНЫЕ РЕАКЦИИ КАТИОНА Sb3+
Сурьма образует 2 ряда соединений, в которых проявляет степени окисления +3 и +5. Растворы солей сурьмы бесцветны.
1.Гидролиз.
При действии воды на соли сурьмы они подвергаются гидролизу по уравнению:
Sb3+ + H2O + Cl¯ = SbOCl↓ + 2H+
Нагревание способствует образованию осадка, добавление винной кислоты или сегнетовой соли – препятствует, в отличие от соединений висмута.
Выполнение реакции. В пробирку к нескольким каплям хлорида сурьмы (III) добавить 2-3 кратный избыток воды. Наблюдать выпадение осадка хлористого стибила. Сравнить степень гидролиза солей сурьмы и висмута. Указать пути усиления и уменьшения степени гидролиза. Проверить действие растворов HCl и винной кислоты на осадок. Сделать вывод о возможности разделения катионов сурьмы и висмута с помощью гидролиза.
Реакция с сероводородной водой.
При пропускании H2S или добавлении H2S+ H2O в солянокислый раствор Sb(III), Sb(V) выпадает оранжевый осадок сульфида:
2Sb3++ 3 H2S= Sb2S3 ↓+ 6H+
2Sb5+ + 5 H2S= Sb2S5 ↓+ 10 H+
Осадки растворяются в избытке Na2S или NaOH при нагревании.
Выполнение реакции. В пробирку с 5-7 каплями SbCl3 добавить равный объём насыщенного раствора H2S. Описать наблюдаемые явления.
Реакция с тиосульфатом натрия.
Na2S2O3 даёт с катионом Sb3+ при нагревании красный осадок сероокиси сурьмы Sb2OS2 ( сурьмяная киноварь):
2Sb3++2 S 2O32- + 3 H2O= Sb2OS2 ↓+ 2 SO42- +6H+
При наличии Bi3+ выпадает черный осадок, который будет маскировать окраску Sb2OS2. Мешают проведению реакции Cu2+, Hg2+ и другие ионы, образующие малорастворимые сульфиды, а так же большой избыток кислоты, растворяющий реагент с выделением SO2 и S, мешающих проведению реакции.
Выполнение реакции. В пробирку с 3-4 каплями SbCl3 добавить каплю раствора H2SO4 и 1-2 кристаллика Na2S2O3 . Нагреть. Что происходит?
Реакция с Zn, Al, Fe.
Активные металлы восстанавливают Sb3+ до металлической сурьмы в кислой среде:
3Zn + 2[SbCl6]3- = 2Sb + 3Zn2+ + 12Cl-
Выполнение реакции. На хорошо очищенную наждачной бумагой цинковую, алюминиевую или железную пластинку нанести каплю подкисленной анализируемой соли. Через 2-3 минуты поверхность пластинки должна под каплей почернеть.
Реакция с метиловым фиолетовым.
При добавлении к солянокислому раствору хлорида сурьмы растворов KNO2 или NaNO2 происходит окисление [SbCl6]3- в [SbCl6]¯. С метиловым фиолетовым, находящимся в кислом растворе в виде катиона, образуется ионная пара [B]+ [SbCl6]-, хорошо экстрагируемая бензолом, при этом органический слой окрашивается в синий цвет. В отсутствии Sb(V) раствор имеет желто- зелёную окраску.
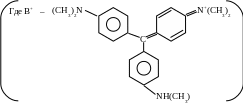
Открытие сурьмы этой реакцией возможно в присутствии Sn2+, Fe3+, Zn2+, Cu2+ в количествах, превышающих содержание Sb>1000 раз.
Выполнение реакции. К капле исследуемого раствора добавить 1-2 капли концентрированной соляной кислоты, кристаллик KNO2, 1-2 капли 0,2% реагента и 0,5 мл бензола. Встряхнуть, что наблюдается?
ХОД АНАЛИЗА СМЕСИ КАТИОНОВ V ГРУППЫ
1.Предварительные испытания. Отметить цвет раствора, наличие осадка, измерить рН. Проверить отношение осадка к кислотам, щелочам. Сделать вывод.
2.Дробное обнаружение катионов Fe2+ и Fe3+. В отдельных порциях открыть указанные катионы избирательными реагентами.
3.Систематический ход анализа.
а) Отделение Sb3+. К 2мл анализируемого раствора прилить NaOH или Na2CO3 до щелочной реакции, отфильтровать. Затем осадок обработать в фарфоровой чашке при нагревании небольшим количеством раствора HNO3. Все катионы, кроме Sb3+ , переходят в раствор в виде нитратов. Снова отфильтровать. Открыть Sb3+ из осадка характерными реакциями: окуриванием сероводородом или реакцией с Na2S2O3 .
б) Осаждение катионов Mg2+, Mn2+, Bi3+, Fe3+. К фильтрату после отделения сурьмы добавить NaOH до рН>9 и раствор H2O2. Нагреть. Гидроксиды железа (II) и марганца (II) окисляются. Обратить внимание на цвет осадка. Отфильтровать его и промыть водой. Записать уравнения происходящих реакций.
в) Отделение и открытие Mg2+. Промыть осадок раствором NH4NO3, причем несколько раз одной и той же порцией в 1-2 мл. Почему Mg(OH)2 растворяется? Открыть в фильтрате Mg2+ реакцией с Na2HPO4 в аммиачном буфере, создавая нужное значение рН. Рассмотреть кристаллы под микроскопом.
г) Отделение Fe3+ и Bi3+ и открытие Bi3+. Промыть оставшийся осадок на фильтре раствором HNO3. Гидроксиды Fe(OH)3 и Bi(OH)3 переходят в раствор. Отделить Bi3+ гидролизом в виде BiOCl . Для этого нейтрализовать раствором NH3, добавить несколько капель HCl и прокипятить. Отфильтровать осадок и внести часть его в приготовленный раствор станнита натрия. Сделать вывод о присутствии катионов Bi3+.
д) Открытие Mn2+. На фильтре останется MnO(OH)2. Приготовить окислительную смесь, нагреть и внести палочкой немного осадка. При наличии Mn2+ раствор розовеет.
Сделать вывод о составе исходной смеси. Составить отчет с уравнениями происходящих реакций.

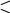 C
C
 6H5
–– NH – N –– Zn ––
N – NH –– C6H5
6H5
–– NH – N –– Zn ––
N – NH –– C6H5