
- •Лабораторная работа № 6 Тема. Электрохимические процессы.
- •Алгоритм уравнивания окислительно-восстановительных реакций
- •Записать уравнение овр в ионном виде.
- •Теория гальванических элементов Гальванические элементы. Электродный потенциал металла
- •Электролиз
- •Порядок протекания реакций на электродах при электролизе
- •Опыт 6.2. Измерение эдс (е) гальванического элемента
- •Mметалла
- •M металла практ
Лабораторная работа № 6 Тема. Электрохимические процессы.
Теоретические вопросы по теме «Основы электрохимии».
Понятие об окислительно – восстановительных реакциях.
Электрохимические процессы. Понятие об электроде.
Механизм возникновения двойного электрического слоя.
Электродный потенциал. Уравнение Нернста.
Водородный электрод.
Токовые и бестоковые реакции.
Процессы, протекающие на катоде и аноде при работе гальванического элемента.
Электролиз. Закон Фарадея.
Теоретическая часть.
Электрохимия - это раздел химии, который изучает процессы, протекающие на границе раздела двух фаз, например металл-раствор, с участием заряженных частиц (ионов и электронов).
Окислительно – восстановительные реакции - это реакции, протекающие с изменением степеней элементов и сопровождающиеся передачей электронов.
Степень окисления элемента (СО)- это условный заряд элемента, согласно его электроотрицательности.
Окисление (о-е) – процесс повышения степени окисления элемента.
Восстановитель (в-е) - процесс понижения степени окисления элемента.
Окислитель (о-ль) – элемент, который понижает свою степень окисления (принимает электроны).
Восстановитель (в-ль) - элемент, который повышает свою степень окисления (отдаёт электроны).
Алгоритм уравнивания окислительно-восстановительных реакций
Схема окислительно-восстановительных реакций.
KMnO4
+ Na2SO3
+ H2SO4
![]() MnSO4
+ H2O
+ K2SO4
+ Na2SO4
MnSO4
+ H2O
+ K2SO4
+ Na2SO4
Проставить степени окисления (СО) у всех элементов участвующих в реакции.
Определить пары элементов, изменяющих СО.
Записать уравнение ОВР в ионном виде.
K+ + MnO4- + 2Na+ + SO32- + 2H+ + SO42- Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
рН<7
Подчеркнуть ионы, в состав которых входят элементы, изменяющие СО.
2KMn+7O4 + 5Na2S+4O3 + 3H2SO4 2Mn+2SO4 + 3H2O + K2SO4 + 5Na2S+6O4
Записать уравнение овр в ионном виде.
K+ + MnO4- + 2Na+ + SO32- + 2H+ + SO42- Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
рН<7
Определить рН среды. (Наличие ионов H+ - показатель кислой среды, рН<7; наличие ионов ОH- - показатель щелочной среды, рН>7; НОН – нейтральная среда рН=7)
Записать полуреакции окисления и восстановления:
а) уравнять число элементов в правой и левой частях полуреакций ( в кислой среде используют для уравнивания атомов водорода H – ионы Н+, а для уравнивания атомов кислорода O –молекулы Н2О; в щелочной и нейтральной средах для уравнивания атомов водорода H используют Н2О; а для уравнивания атомов кислорода O – гидроксид –ион ОН-, причем, на каждый недостающий атом О добавляют 2ОН-);
б) над каждой частью полуреакции записать «степень окисления»;
в) определить и записать процесс (о-е или в-е) и восстановитель или окислитель;
г) привести полуреакцию к электронному балансу.
То же (а-г) проделать со второй полуреакцией
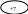

MnO4- + 8H+ + 5e Mn2+ + 4HOH, в-е
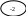
 о-ль
о-ль
SO32- + HOH – 2e SO42- + 2H+, ок-е
 в-ль
в-ль
![]()
Найти наименьшее общее краткое числа электронов (n) и соответствующие коэффициенты для каждой полуреакции.
n

 MnO4-
+ 8H+
+ 5e
Mn2+ +
4 HOH, в-е
2
MnO4-
+ 8H+
+ 5e
Mn2+ +
4 HOH, в-е
2
о-ль
10
SO32- + HOH – 2e SO42- + 2H+, ок-е 5
в-ль

Сложить правые и левые части полуреакций, умножая на коэффициенты.
В полученном уравнении привести подобные члены. Получить сокращенное полное уравнение ОВР.
MnO4- + 8H+ + 5e Mn2+ + 4 HOH, в-е 2
о-ль
SO32- + HOH – 2e SO42- + 2H+, ок-е 5
в-ль
 6
3
6
3
2
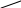 MnO4-
+ 16H+
+ 5SO32-
+ 5 HOH
2Mn2+
+ 8 HOH + 5SO42-
+ 10H+
MnO4-
+ 16H+
+ 5SO32-
+ 5 HOH
2Mn2+
+ 8 HOH + 5SO42-
+ 10H+
Из этого уравнения перенести коэффициенты в уравнение в молекулярной форме
2KMnO4 + 5Na2SO3 + 3H2SO4 2MnSO4 + 3 HOH + K2SO4 + 5Na2SO4
Проверить равенство количества элементов в правой и левой частях уравнения.
