- •Б 1. Классификация э/х методов анализа: принципы, лежащие в основе различных способов классификации.
- •Б 2. Потенциометрия. Потенциометрическое титрование, преимущества потенциометрической индикации ктт.
- •Б 3. Индикаторные электроды и их выбор для реакции нейтрализации, о-в, осаждения и комлексообразования.
- •Б 4. Методы определения кт потенциометрического титрования. Дифференциальное титрование. Метод Грана.
- •Б 7. Изменение буферности в ходе нейтрализации слабой кислоты сильным основанием, кривая титрования и ее расчет.
- •Б 10. Нейтрализация смесей кислот. Возможность и точность раздельного определения кислот в водной среде.
- •Б 13. Факторы, определяющие выбор растворителя для титрования индивидуальных слабых протолитов и дифференциального анализа смесей протолитов.
- •1. Твердые мембраны
- •3. Особые электроды.
- •Б 20. Газочувствительные и ферментные электроды.
- •(Потенциометрические биосенсоры) ферментные электроды.
- •21.Весовой электроанализ (электрогравиметрИя) при контролируемом потенциале. Внутренний электролиз.
- •Электрогравиметрический анализ
- •Б 23. Кулонометрическое титрование с внутренней генерацией титранта; методы индификации конечной точки титрования; преимущества метода.
- •Б 26. Уравнение Ильковича; диффузионный ток и его зависимость от концентрации деполяризатора.
- •Б 35. Амперометрическое титрование с двумя заполяризованными электродами.
- •Б 36. Емкостный ток и чувствительность постояннотоковой полярографии.
- •Б 37. Вольтамперометрия с быстрой разверткой (хроновольтамперометрия).
- •Прямая полярография с импульсами прямоугольной формы.
- •Б39.Дифференциальная импульсная полярография.
- •Б 41.Хронопотенциометрия.
- •Б 42. Инверсионная вольтамперометрия.
Б 7. Изменение буферности в ходе нейтрализации слабой кислоты сильным основанием, кривая титрования и ее расчет.
Нейтрализация слабой кислоты сильным основанием характеризуется тем, что концентрация анионов в ходе титрования не остается постоянной. Если представить уравнение константы диссоциации слабой кислоты в виде
![]() (12)
(12)
и учесть, что концентрация непродиссоциировавшей кислоты [HA]=C0-[A-], то можно записать
![]() (13)
(13)
Подставляя полученное выражение в уравнение
y = [B+] = [A-] − [H+] + Kw / [H+],
получим уравнение кривой титрования слабой кислоты сильным основанием
![]() (14)
(14)
Это уравнение третьей степени и точный расчет [H+] затруднен.
На практике поступают обычно проще. В начальный момент титрования, когда y=0, справедливо равенство
![]() .
(15)
.
(15)
Величина KW/[H+] на несколько порядков меньше первого слагаемого правой части уравнения (15), поэтому ей можно пренебречь. Тогда
![]() .
(16)
.
(16)
Решая это квадратное уравнение, имеем
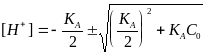 (17)
(17)
Если С0КА, то хорошим приближением концентрацию ионов водорода в исследуемом растворе кислоты до начала титрования можно рассчитать по формуле
![]() .
(18)
.
(18)
Для недотитрованных растворов, когда y C0, концентрацию ионов водорода рассчитывают, используя уравнение константы диссоциации
![]() .
(19)
.
(19)
Пренебрегая диссоциаций слабой кислоты в присутствии ее соли, можно считать, что равновесная концентрация [HA][недотитрованной кислоты], а равновесная концентрация анионов [A-] [образовавшейся соли]. Тогда
![]() (20)
(20)
или
![]() (21)
(21)
В точке эквивалентности, когда y=C0, вследствие гидролиза образовавшейся соли В+А- + H2O = HA + B+OH-
раствор будет не нейтральным, а щелочным. Концентрация ионов водорода может быть вычислена по известному уравнению
![]() ,
(22)
,
(22)
а рН раствора по уравнению
![]() .
(23)
.
(23)
Концентрацию соли в эквивалентной точке С можно приравнять исходной концентрации кислоты С0, если не учитывать разбавление раствора в ходе титрования.
Для того чтобы выяснить форму кривой титрования слабой кислоты и имеющиеся характерные точки на этой кривой, проанализируем уравнение (14), воспользовавшись опять величиной буферности
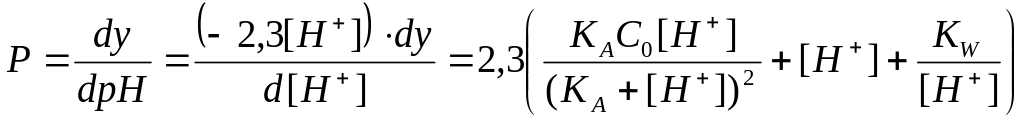 .
(24)
.
(24)
Эта производная ни при каких значениях рН не может равняться нулю, следовательно, кривая титрования не должна иметь экстремум. Не проводя расчетов буферности, выясним, как будет вести себя зависимость P=f(pH). Для этого необходимо продифференцировать уравнение (24) по рН. Учитывая, что в области недотитрованных (yC0) растворов слабой кислоты (КА≤10-5) выполняется неравенство
 ,
(25)
,
(25)
уравнение (24) можно записать в виде
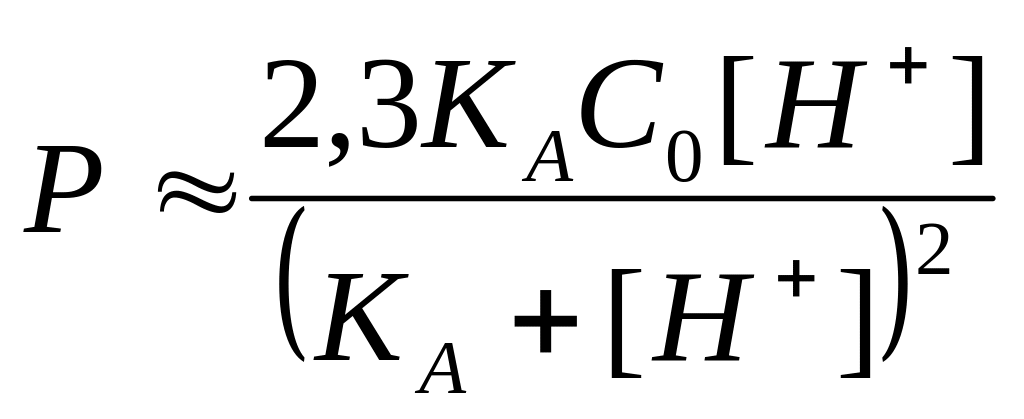 .
(26)
.
(26)
Дифференцируя последнее выражение по рН, получим
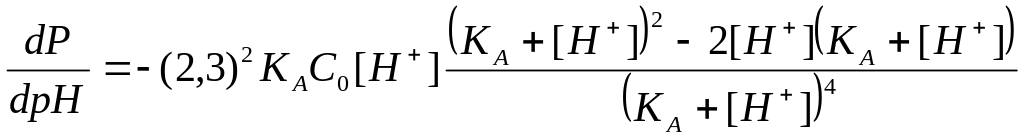 . (27)
. (27)
Производная dP/dpH=0, если [H+]=KA или pH=pKA. Этому значению pH на кривой P=f(pH) отвечает максимальное значение буферности Pmax имеет значение
![]() (28)
(28)
и не зависит от силы кислоты, а определяется только ее концентрацией.
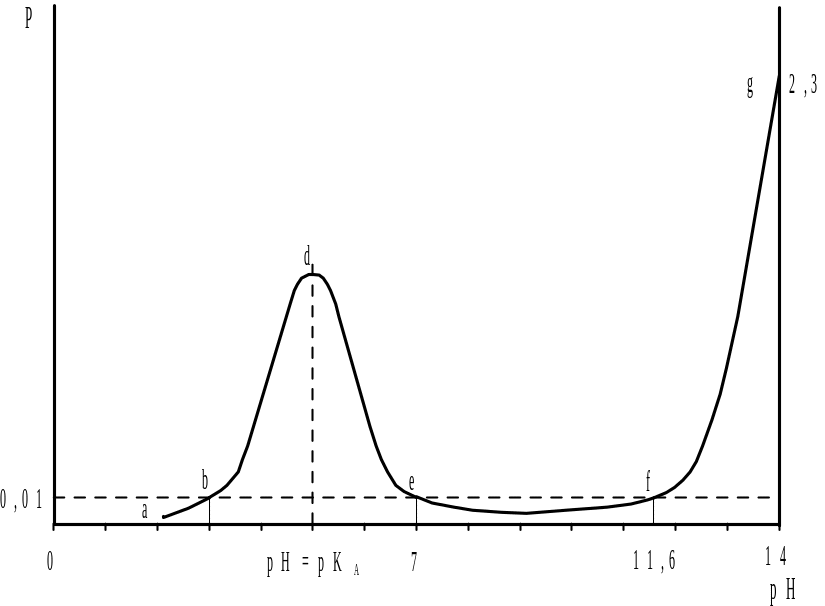
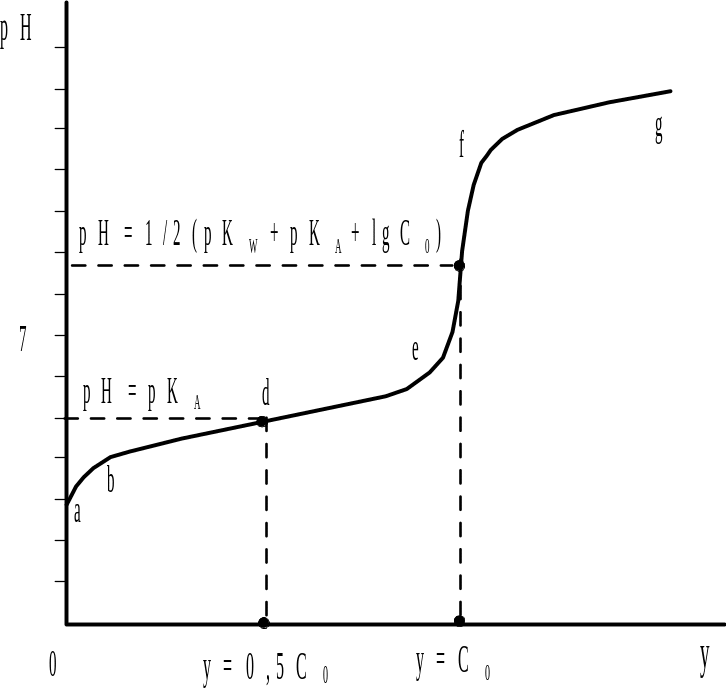
Равенство [H+]=KA, в соответствии с уравнением (20), отвечает условию y=0,5C0, т.е. полуоттитрованному раствору слабой кислоты. Если, например, сильным основанием титруется 0,1 н. слабая кислота, у которой КА=10-5, то изменение буферности системы в ходе титрования можно представить в виде кривой, приведенной на рис. В данном случае наблюдается два участка повышенной буферности. первый соответствует области недотитрованного раствора и обусловлен присутствием слабой кислоты и ее соли, а второй участок − избытком титранта.
|
|
Рис. Изменение буферности при титровании слабой кислоты сильным основанием |
Рис. Кривая титрования слабой кислоты (КА=10-5)сильным основанием |
Согласно диаграмме буферности на кривой титрования pH=f(y) слабой кислоты полуоттитрованному раствору отвечает точка перегиба, ордината которой соответствует рН=рКА. Последнее равенство позволяет достаточно просто определять методом потенциометрического титрования концентрационные константы слабых кислот.
Протяженность участков низкой буферности, наблюдающихся в начале (ab) и в конце титрования (ef), зависит от силы кислоты. Чем слабее кислота (чем меньше КА), тем больше изменения рН в начале титрования и тем меньше протяженность участка низкой буферности (ef), который обуславливает величину скачка на кривой титрования.
На рис. представлены кривые титрования трех слабых кислот: хлоруксусной, уксусной и дихлорфенола, рКА которых равны соответственно 2,81, 4,76 и 7,85. Как видно, с уменьшением силы указанных кислот величина скачка рН уменьшается, а рассчитанное с учетом гидролиза рН в точке эквивалентности увеличивается. Если константы диссоциа-ции кислот малы, то в точке эквивалентности вообще не наблюдается скачка потенциала или перегиба на кривой |
|
титрования. |
Рис. Кривые титрования слабых кислот. |
Б 8. определение константы диссоциации слабого протолита по кривой
титрования.
|
Рис. Кривая титрования слабой кислоты (КА=10-5)сильным основанием |
Б 9. возможность и точность определения слабых кислот в водной среде методом потенциометрического титрования.
|
|
|
Рис. Кривые титрования слабых кислот. |
Рис.изменение буферности при титровании слабой кислоты сильным основанием |
|
С уменьшением силы указанных кислот величина скачка рН уменьшается, а рассчитанное с учетом гидролиза рН в точке эквивалентности увеличивается. Если константы диссоциации кислот малы, то в точке эквивалентности вообще не наблюдается скачка потенциала или перегиба на кривой титрования. Допустим, мы титруем слабую кислоту и добавили такую порцию титранта, когда нейтрализованной оказалась 0,1% первоначального количества кислоты. Тогда, согласно уравнению
рН анализируемого раствора имеет значение
![]() .
.
Титрование можно считать законченным, если оттитровано 99,9 % (максимальная точность объемного анализа) исходной кислоты. Тогда рН анализируемого раствора
![]() .
.
Таким образом, при определении слабой кислоты с точностью 0,1%, мы должны учитывать, что изменение рН раствора в ходе титрования составляет 6 единиц
![]() .
(29)
.
(29)
Если титруется 0,1 н. кислота с рКА=8,6, то она практически полностью будет нейтрализована при рН=11,6. Рассчитав для данного рН по уравнению (1)
буферность системы, образованной слабой кислотой и сильным основанием, можно убедиться, что значение буферности практически будет равно 0,01. В этом случае скачок рН в области точки эквивалентности отсутствует и на кривой титрования можно зарегистрировать только точку перегиба. Таким образом, количественное определение слабой кислоты в водных растворах с точностью 0,1% возможно, если выполняется условие
![]() . (30)
. (30)
Более слабые кислоты в водной среде титрованием определить невозможно.
Т.к. в уравнение (1) входит концентрация кислоты С0, то более точно условие определимости можно записать в виде
![]() .
(31)
.
(31)
Если удовлетворяет точность анализа 1%, то условие возможности определения слабой кислоты в водных растворах можно записать следующим образом
![]() (32)
(32)
или с учетом исходной концентрации кислоты
![]() .
(33)
.
(33)