
- •В.М. Сутягин, л.И. Бондалетова химия и физика полимеров
- •Часть I. Основы химии полимеров
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5 анионно-координационная полимеризация 5.1. Общие положения
- •Глава 6 полимеризация по карбонильной группе
- •Анионная полимеризация
- •Катионная полимеризация
- •Полимеризация с двумя различными полимеризующимися группами
- •Глава 7 полимеризация циклов
Катионная полимеризация
Соединения
с карбонильной группой также полимеризуются
под действием кислотных катализаторов:
HCl,
CH3COOH,
кислоты Льюиса и др.
Схему полимеризации можно представить следующим образом:
R -
CH =
O +
HA K-
>
rCh - OH,A-
H - (O - CHR)n - O - ChR,A- + R - CH = O
KpH - (O - CHR)n+1 - O - ChR,A-
Реакция обрыва - это передача цепи на воду или какую-нибудь другую частицу системы.
h
- (O - CHR)n+1 - o
- Chr,a-+H2O >
H - (O - CHR)n+1 - O -
ChR - OH + HA
Полимеризация с двумя различными полимеризующимися группами
К
таким мономерам относят диметилкетен
(GH3)2C=C=O,
акролеин GH2=CH-CH=O.
Диметилкетен полимеризуется под влиянием анионных инициаторов по связи С=С:
п(СНз)2С
= C = O -[C(CH)2
-CO-]n
А также полимеризуется по карбонильной связи с образованием ненасыщенного ацеталя:
n(CH3)2
С = C = О >~ -[ С - О-]п
C(CH3)2
Или протекает полимеризация обеих групп с образованием ненасыщенного полиэфира:
2n(CH3)2 С = C = О >~ -[C(CH3)2 - CO - О - с -L
C(CH3)2
Полимеризации по более полярной карбонильной группе способствуют полярные растворители. Полимеризация по менее полярной алкеновой связи способствуют неполярные растворители.
На образование поликетона благоприятно влияют противоионы Li, Mg, Al, а на образование полиэфира - Na, K.
Что же касается акролеина, то он может быть превращен в полимер под действием радикальных инициаторов и ионных катализаторов. Так, радикальная полимеризация протекает исключительно по двойной связи с образованием полиальдегида:
CH2 = CH - CHO > -[CH2 - CH(CH0)-]n
При
катионной полимеризации акролеина под
влиянием катализаторов таких, как BF3,
H2S04
образуются полимеры, содержащие
повторяющиеся единицы двух типов:
(n
+ m)CH2
= CH - CHO -[CH2
- CC -]П
- [О
- CH(CH = CH2)-]m
CHO
Аналогичное
поведение установлено для анионной
полимеризации указанного выше мономера
в присутствии С 4H9Li
и Na-нафталина.
Единственным исключением является полимеризация с Na или NaCN в тетрагидрофуране или толуоле при температуре от -50 до -40 оС, которая протекает полностью по карбонильной группе:
nCH(CH = CH2) = О > -[CH(CH = CH2) - 0-]П
Таким образом, полимеризация по карбонильной группе приводит к образованию полимеров, содержащих ацетальные структурные единицы. Из соединений такого типа значительно более широко изучена полимеризация формальдегида. Основные закономерности этой полимеризации аналогичны закономерностям ионной полимеризации алкенов.
Глава 7 полимеризация циклов
Общие положения
Ранее нами была рассмотрена полимеризация алкенов. Однако кроме указанных мономеров, в полимеризации используют циклические соединения, такие как окись этилена и пропилена, s-капролактам и другие. Последние включены в производство полимерных материалов. В настоящее время получено большое число гетероцепных полимеров, и полимеризация циклов приобретает все большее значение как общий метод синтеза полимеров.
Процесс превращения циклов в линейные полимеры описывается уравнением вида:
R^^Z -[R-Z-]n
ch2-ch2
-[ac^-c^n
n 2 22
O
Как видно, процесс превращения циклов в линейные полимеры не сопровождается выделением низкомолекулярных веществ, и элементный состав полимера не отличается от элементного состава мономера (концевыми группами можно пренебречь).
При образовании полимеров из циклов не изменяется электронная структура химических связей и их общее число в системе. В процессе превращения циклов в линейные полимеры не возникает новых типов связей. Например, в случае цепной полимеризации алкенов в последних изменяется электронная структура химических связей, т. е. разрывается п-связь и образуется a-связь, что сопровождается выделением энергии, равной 22,5 ккал/моль.
Полимеризация же циклов сопровождается изменением только порядка расположения связей, но характер в образовавшейся макромолекуле остается таким же, как и в исходном цикле.
Например, в случае полимеризации оксида этилена в молекуле его разрывается связь С-О в цикле и образуется такая же связь в линейной макромолекуле.
При полимеризации капролактама разрывается связь C-N в цикле и образуется такая же связь в линейной макромолекуле поликапроамида. Природа химических связей в полимере и мономере одинакова.
Термодинамика превращения циклов в линейные полимеры
Термодинамическая возможность полимеризации циклов, а также положение равновесия, достигаемое в процессе превращения циклов и линейных полимеров, определяется изменением свободной энергии Гиббса:
AG = AH - TAS,
где AH - молярное изменение энтальпии системы; AS - изменение энтропии системы.
Реакция превращения цикла в линейный полимер возможна, если она протекает с уменьшением свободной энергии Гиббса.
AG уменьшается с понижением AH и повышением AS системы.
Тепловой эффект реакции полимеризации циклов и соответственно изменение AH равен разности в энтальпиях цикла и линейного полимера. В процессе превращения циклов в линейный полимер, как уже отмечалось ранее, не возникает новых типов связей и не изменяется их число. Поэтому AH ненапряженного цикла не должна отличаться от AH элементного звена полимера. Тепловой эффект полимеризации ненапряженного цикла и величина AH равна нулю. Согласно теории напряжения циклов, вероятность циклизации бифункциональных соединений определяется разностью между энергиями образования одних и тех же связей в цикле и в соединении с открытой цепью. Наиболее легко образуются пяти- и шестичленные циклы. Образование циклов с меньшим или большим числом членов затруднительно.
Термодинамически наиболее выгодна полимеризация трех-, четырехчленных циклов (у них наблюдается наибольшее уменьшение AG 21,5 и 22,1 ккал/моль). Наименее термодинамически выгодна полимеризация пятичленных циклов (AG =12,2 ккал/моль).
При полимеризации трех- и четырехчленных циклов AG уменьшается только за счет выигрыша в AH , для восьмичленных циклов AG в значительной степени обусловлена возрастанием энтропии. Трехчленные циклы являются очень напряженными и в
отношении способности к реакциям присоединения близки к двойной связи олефинов. Поэтому равновесие цикл - полимер для них полностью сдвинуто в сторону образования полимера, и реакция в этом случае является необратимой.
Полимеризация циклов с числом звеньев от 7 до 18 сопровождается уменьшением АН и, возможно, в некоторых случаях увеличением энтропии.
Итак, способность к полимеризации циклов определяется соотношением АН и AS. Процесс идет при уменьшении свободной энергии, что достигается за счет энтальпийного члена в случае сильнонапряженных циклов и за счет энтропийного - в случае малонапряженных или ненапряженных циклов.
Полимеризация эпоксидов
Эпоксиды (оксид этилена, пропилена и др.) полимеризуются под действием как анионных, так и катионных катализаторов.
Анионная полимеризация эпоксидов
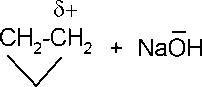 В
качестве катализаторов анионной
полимеризации эпоксидов используются
гидроксиды, алкоксиды, оксиды металлов,
металлоорганические соединения и др.
Так полимеризацию оксида этилена (ОЭ)
с гидроксидом натрия можно представить
следующей схемой. Полимеры, полученные
в присутствиии щелочи, имеют низкую
степень полимеризации, а концевые звенья
содержат гидроксильные группы.
В
качестве катализаторов анионной
полимеризации эпоксидов используются
гидроксиды, алкоксиды, оксиды металлов,
металлоорганические соединения и др.
Так полимеризацию оксида этилена (ОЭ)
с гидроксидом натрия можно представить
следующей схемой. Полимеры, полученные
в присутствиии щелочи, имеют низкую
степень полимеризации, а концевые звенья
содержат гидроксильные группы.
+
HO-(CH2-CH2)n-CH2-CH2-O-
, Na
При
полимеризации оксида этилена в
присутствии алкоголятов или фенолятов
концевыми группами становятся алкокси-
или фенокси- группы: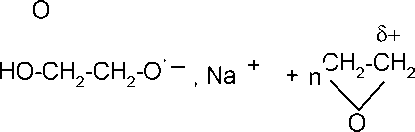



С6Н5
- ONa
< >
С6Н5
- о-,Na+
С6Н5
- O-,Na+
+ C2H4O
> С6Н5
- O
- СН2
- CH2O-
Na+
Степень конверсии мономера линейно возрастает во времени, одновременно увеличивается степень полимеризации и повышается температура плавления полимера.
При использовании в качестве катализатора системы метилат натрия - метанол скорость полимеризации оксида этилена описывается уравнением:
Vp = Kp[CH3O - ][Na+ ПС2Н4О],
[C2H4OL - [C2H4O] r
Pn = i—2—4—-——4—— или в общем виде
n [CH3O- ][Na+ ]
p = [M]o
- [M]t
n [C] ,
где [С] - концентрация катализатора.
Кинетика соответствует схеме без реакции обрыва:
CT3ONa
+ C2H4O
Kp
>
СН30
- СН2
- CH2O-,Na+
> nC2ll4()
>
СН30
- (СН2
- CH2O)n
- СН2
- CH2O-,Na
+ >
CH<O
>
СН30
- (СН2
- CH2O)n+1
- СН2
- CH2O-,Na+
Средняя молекулярная масса полимера снижается в присутствии спиртов. Дело в том, что в спиртовой среде уменьшается устойчивость системы макроанион-катион и возрастает вероятность передачи цепи на спирт. Спирт применяется для получения гомогенной системы путем растворения катализатора:
~O
- (СН2
- CH2O)n
- СН2
- CH2O-,Na+
+ROH
>
RO-,Na+
+
+
~O
- (СН2
- CH2O)n
- OH
Эта реакция, естественно, уменьшает молекулярную массу полимера. Тогда для этого случая степень полимеризации равна:
p = [M]o - [M]t n [C]o + [ROH]o ’
Этилат и пропилат натрия ведут себя так же, как метилат натрия, в случае фенолята натрия имеет место индукционный период.
Это объясняется более сильными кислотными свойствами фенола. Равновесие реакции взаимодействия фенола с оксидом этилена смещается вправо, препятствуя росту цепи до тех пор, пока не израсходуется весь фенол.
При полимеризации эпоксидов образуются олигомеры с молекулярной массой менее 5000 и редко выше 10000. Причиной этого ограничения является относительно низкая активность эпоксидного кольца по отношению к росту цепи.
При анионной полимеризации нежелательны реакции передачи цепи на мономер. Последнее особенно заметно в замещенных оксидах этилена (оксид пропилена). Реакция передачи цепи включает отщепление водорода от алкильного заместителя в эпоксидном цикле и последующее очень быстрое расщепление кольца с образованием аниона:
~
CH2
- CH(CH3)
- O-,Na+
+ C3H6O
Km
>
>~
CH2
- CH(CH3)
- OH + CH2
- C2H3O
очень
быстро
>
CH
2= CH - CH2O-Na+
^ = (Kp + KmMMHCL,
dt
d^=Km[M]|C]„,
dt
где [N] - концентрация полимерных цепей.
Разделив последнее уравнение на предпоследнее, учитывая, что CM=KM/Kp , и проинтегрировав, получим:
[N]
=
[N]
+
-+^([М]0
- [M]t),
В.М. Сутягин, Л.И. Бондалетова ХИМИЯ И ФИЗИКА ПОЛИМЕРОВ 1
/ X 18
^ Ph - c(ch3)=o+Ch3 + Oh 26
~ cH 2 - cHx- cH 2 - cH 2 x - cH 2 - cH 2 - cHx- cHx- cH 2 - 31
R n + R m ^ П 35
Rn + S8 ^ Rn - S75* 53
M = ин 86
Ks[S] 105
Cs[S] 105
-со" 107
R 107
1 Ks
~ CH2 - CH(X) + RS - SR'— ~ CH2 - CH(X)- SR + R'S*
Скорость этих реакций можно представить уравнением:
Vs = Ks[R n][S].
Отношение Ks/Kр носит название константы передачи цепи
через растворитель (CS). Наиболее высокие значения CS наблюдаются для СС14, CBr4, меркаптанов. Являясь активными передатчиками цепи, эти вещества понижают молекулярную массу полимеров.
Подбирая растворители и условия процесса, можно получить низкомолекулярные олигомеры, концевые звенья которых содержат продукты распада молекул растворителя. Такой процесс называют теломеризацией, а сами олигомеры - теломерами. Кстати, эти реакции используются в промышленности для получения соединений с активными функциональными группами. Например, при полимеризации этилена в присутствии CC14 под действием изотопа Со60 получают теломеры, содержащие группы C1 и CC13 на концах цепи.
2 _ 1+См+Сп„„ iIn]+сп 1П1+Cs-iS!. (5)
