
Замещение в углеводородном радикале:
-
CH3—CH2—COOH
+ Cl2
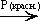
CH3—CHCl—COOH
+ HCl
пропионовая кислота

-хлорпропионовая кислота
Замещение протекает в
-положение.
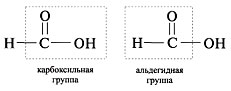
Особенность муравьиной кислоты HCOOH состоит в том, что это вещество - двуфункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом:
![]()
Поэтому муравьиная кислота кроме всего прочего реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала; качественная реакция):
HCOOH + Ag2O(аммиачный раствор)
![]()
CO2 + H2O + 2Ag
Получение карбоновых кислот
Окисление альдегидов. В промышленности: 2RCHO + O2 2RCOOH Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др.
Окисление спиртов: RCH2OH + O2 RCOOH + H2O
Окисление углеводородов: 2C4H10 + 5O2 4CH3COOH + 2H2O
Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц. CH3COOH + NaHSO4
Пример. Определите массу сложного эфира, который можно получить при взаимодействии 8 г метилового спирта и 23 г муравьиной кислоты.
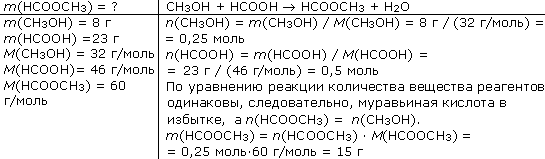
Ответ: m(HCOOCH3) = 15 г
Убедившись, что все необходимые понятия усвоены, переходите к выполнению заданий. Желаем успеха.
Карбоновые кислоты
Урок-ярмарка
Цели. Рассмотреть строение, свойства, получение и применение карбоновых кислот; развить навыки самостоятельной работы учащихся с учебной и дополнительной литературой; воспитывать культуру коллективной работы; проконтролировать знания учащихся по теме и практические навыки в решении экспериментальных задач.
Оборудование и реактивы. Колбы, выставка поделок учащихся (модели молекул, этикетки продуктов и изделий, содержащих кислоты); наборы кислот (муравьиная, уксусная, стеариновая, пальмитиновая, щавелевая), вода, аспирин, раствор FeCl3.
Подготовка к уроку. За две недели класс распределяется на фирмы-поставщики. Фирма «Муравей» поставляет муравьиную кислоту. Деятельность фирмы «Фея» связана с уксусной кислотой. Фирма «СПК» занимается стеариновой и пальмитиновой кислотами.
В каждой фирме – 5–6 учащихся, есть директор, отдел рекламы, историк, специалисты-химики. Реклама включает информацию о физических и химических свойствах кислоты, ее применении, содержании в природных объектах и получении. Представляя свою фирму, учащиеся говорят о том, как она называется, демонстрируют эмблему. Рекламу сопровождают демонстрацией подготовленных таблиц и опытов, иллюстрирующих свойства кислот, показывают маленькие выставки, связанные с конкретными кислотами, записывают уравнения реакций, можно подобрать музыку. Каждое выступление длится не более 10–12 мин.
В выступлениях оценивается химическая грамотность, полнота подачи материала, оригинальность замысла.
Еще одна фирма («Посредник») покупает продукцию. Представители этой фирмы ведут урок, подводят итоги ярмарки.
Ход урока
Учитель. Мы живем в мире рыночных отношений. Каждая фирма заинтересована в быстром и выгодном сбыте своей продукции. У нас на ярмарке присутствуют представители фирм «Муравей», «Фея», «СПК» и «Посредник». Там, где есть товар, должен быть и покупатель. А покупатели – вы. Для лучшей совместной работы и организована наша ярмарка. Не стесняйтесь! Рекламируйте свой товар, свои знания. Попутно делайте записи в тетради, внимательно слушайте информацию. Успешной вам работы! Каждая фирма может получить поощрительные очки за умные ответы на вопросы. Жюри – вы сами.
Ведущий (из фирмы «Посредник»). Итак, ярмарка открыта! Слово для представления своего товара имеет фирма «Муравей».
Директор. Чтобы знать химию, необходимо учить каждый урок. Наша фирма «Муравей» призывает к этому всех учащихся. Ведь мир химии настолько интересен! Каждый человек должен знать, что его окружает, чем он дышит и чем питается. Все это – химия. Нас заинтересовало, что можно сказать о муравьиной кислоте. Итак, фирма «Муравей» представляет муравьиную кислоту.
Историк. Впервые муравьиная кислота была открыта в 1670 г. английским естествоиспытателем Джоном Реем в выделениях муравьев, откуда и пошло это название. Об открытии Ю.Либихом безводной муравьиной кислоты мы знаем по воспоминаниям его ученика – К.Фогта.
Сценка. К доске выходят двое учащихся в старинной одежде, они изображают Ю.Либиха и К.Фогта.
В руках у Либиха склянка с притертой пробкой. Он обращается к Фогту: «Ну-ка обнажите руку» – и влажной пробкой прикасается к его руке. «Жжет, не правда ли? – спрашивает Либих. – Я только что добыл безводную муравьиную кислоту». Либих рассказывает, что он прижег руки многим студентам, а у него самого на щеке вскочил волдырь от брызг кислоты. Фогт говорит, что он получил самую большую порцию и всю жизнь ходил с белым шрамом на руке.
Директор. Я приведу некоторые интересные факты. Муравьи дают людям муравьиную кислоту. Около 70% содержимого ядовитой железы рыжего муравья – это муравьиная кислота. Муравьиная кислота содержится также в листьях крапивы (вызывает ожоги), в хвое ели. Издавна люди использовали муравьиную кислоту как средство для лечения ревматизма. Использовали весьма своеобразным способом. Люди, страдающие подагрой, засовывали ноги в муравейник и некоторое время терпели укусы его обитателей. Иногда использовали крапиву. В начале XVIII в. ученые научились вовлекать муравьиную кислоту в реакции с различными спиртами, получая вещества с узнаваемыми запахами. Например, в реакции фенилэтилового спирта и муравьиной кислоты получали вещество с запахом хризантем; при нагревании бензилового спирта с муравьиной кислотой получали вещество с запахом жасмина.
1-й специалист-химик. Раньше муравьиную кислоту получали, вымачивая муравьев в воде с последующей перегонкой раствора. В настоящее время ее получают по схеме:
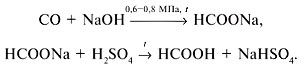
В промышленности муравьиную кислоту получают из метана, спиртов и альдегидов – их окислением:
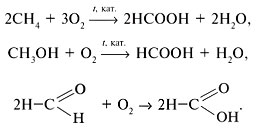
2-й специалист-химик. Я расскажу о свойствах кислоты. По физическим свойствам муравьиная (метановая) кислота – это бесцветная подвижная жидкость с резким запахом, tпл = 8,25 °C,
tкип = 100,7 °С,
![]()
= 1,220 г/см3. Муравьиная кислота смешивается с водой, спиртом, эфиром. Ее молекулы не связаны в единый пространственный каркас, а объединены водородными связями попарно. Отсюда следует невысокая вязкость и заметная летучесть муравьиной кислоты:
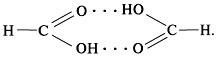
По химическим свойствам муравьиная кислота самая реакционноспособная из всех карбоновых кислот. Это объясняется тем, что ее карбоксильная группа связана с водородом, а не с углеводородным радикалом. Благодаря присутствию в молекуле альдегидной группы муравьиная кислота обладает свойствами альдегидов.
Специалист-химик демонстрирует опыт окисления муравьиной кислоты аммиачным раствором оксида серебра(I) при нагревании – реакцию «серебряного зеркала»:
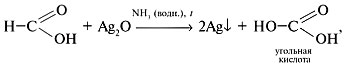
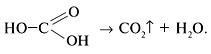
2-й специалист-химик. При нагревании муравьиная кислота разлагается:
![]()
Муравьиная кислота проявляет свойства, общие с другими карбоновыми кислотами, – взаимодействует с металлами, основными оксидами, щелочами, спиртами:
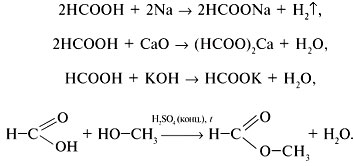
Соли муравьиной кислоты называют формиатами.
Отдел рекламы (демонстрируя выставку). Муравьиная кислота находит широкое применение в различных отраслях народного хозяйства. В технике кислоту и ее соли применяют в качестве протравы при крашении тканей, в кожевенном производстве – для отмывания извести, используемой при обработке шкур. В медицине смесь кислоты с водой, так называемый муравьиный спирт, используется как раздражающее кожу, рефлекторно действующее средство при ревматических и неврологических болях. Муравьиная кислота применяется в промышленном органическом синтезе в качестве восстановителя, а также для получения щавелевой кислоты. В пищевой отрасли промышленности ее используют в качестве дезинфицирующего и консервирующего средства.
Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ. Муравьиная кислота обладает хорошим бактерицидным действием.
В ней – сочетанье двух начал,
Одно – в рождении зеркал.
Конечно, не для созерцанья,
А для науки пониманья.
Другая ее суть.
Она ведь прежде кислота, не позабудь.
И в царстве леса встречается она,
Меньшие братья здесь ее друзья,
Им сердце отдано сполна.
Нет жизни ей, исчезнет вдруг трудяга-муравей.
Сестрицы ей – пчела и жгучая крапива.
Обидно сильно колется она,
Зато и сердце радует, и глаз,
Когда под Новый год сверкает как алмаз.
Кто без нее не может обойтись –
Текстиль, бумага, кожа –
Для них она всего дороже.
Здесь кислота – протрава для храненья,
И для отделки здесь она.
Законсервирует вдруг соки без предупрежденья,
Дезинфицирует и бочки для пива и вина.
Нужна и в медицине кислота,
Муравьиный спирт – ее раствор,
Он – от некоторых хворь.
Формиаты соли – вот ее семья.
Как поняли, нужна нам эта кислота.
Ведущий. А теперь свой товар – уксусную кислоту – представляет фирма «Фея».
Директор фирмы представляет ее специалистов и вывешивает на доске плакат – план ответа.
Визитная карточка уксусной кислоты.
• История вопроса.
• Содержание в природных объектах.
• Получение.
• Физические свойства.
• Xимические свойства.
• Применение.
Историк. Уксусная кислота известна с древнейших времен (Китай, Египет, Вавилон) и была, очевидно, первой кислотой, которую узнал человек. Кислоту выделяли из уксуса, а последний получался при скисании вина. В 1648 г. немецкий химик И.Р.Глаубер обнаружил уксусную кислоту в подсмольной воде сухой перегонки дерева. В 1789 г. русский химик Т.Е.Ловиц впервые получил кристаллическую, так называемую ледяную уксусную кислоту. Ее химический состав был определен в 1814 г. шведским химиком Й.Я.Берцелиусом. Первый лабораторный синтез уксусной кислоты был осуществлен в 1845 г. немецким химиком А.В.Г.Кольбе. Промышленный способ получения уксусной кислоты основан на окислении ацетальдегида в присутствии солей Mn при 56–75 °С и давлении 0,2–0,3 МПа; окислитель – технический О2.
Директор. Уксусная кислота широко распространена в природе. Она содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности, в зеленых листьях). Эта кислота встречается как в свободном виде, так и в виде солей и эфиров, она присутствует в кислом молоке и сыре.
1-й специалист-химик. Уксусная кислота образуется при брожении, гниении, скисании вина и пива, при окислении многих органических веществ.
Промышленные способы
получения уксусной кислоты
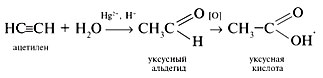
• Из ацетилена по реакции Кучерова получают уксусный альдегид (ацетилен получают из доступного сырья – метана), окисление альдегида дает кислоту:
• Окисление бутана:
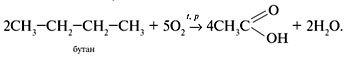
• Окисление этилового спирта:
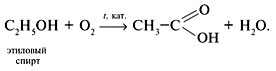
• Оксосинтез по схеме:
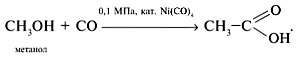
• Пиролиз ацетона с последующей гидратацией образовавшегося кетена:

2-й специалист-химик. Уксусная кислота – жидкость, кислая на вкус, с резким запахом. Безводная уксусная кислота плавится при +16,6 °С, ее кристаллы прозрачны как лед, отсюда название ледяная уксусная кислота. Обычная техническая уксусная кислота имеет концентрацию 70–80%. Температура кипения 100%-й уксусной кислоты – 118 °C. Смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
|
Ледяная уксусная кислота при охлаждении ниже 16,6 °С – бесцветные кристаллы |
Директор. Ледяная уксусная кислота доставляет химикам немало хлопот. Принесенную с холодного склада бутыль с уксусной кислотой обычно приходится ставить на сутки возле теплой батареи, чтобы кислота расплавилась. Только потом ее можно наливать из бутыли. Переливать уксусную кислоту тоже непросто, т. к. она имеет резкий раздражающий запах, а при попадании на кожу дает болезненные ожоги. Приходится пользоваться респиратором и резиновыми перчатками.
1-й специалист-химик. Уксусная кислота СН3СООН – одноосновная карбоновая кислота жирного ряда. По химическим свойствам уксусная кислота уступает муравьиной, что является результатом влияния радикала СН3 на карбоксильную группу:
![]()
Подобно минеральным кислотам в водных растворах уксусная кислота диссоциирует на ионы:
СН3СОOН
![]()
СН3СОО– + Н+.
Поскольку уксусная кислота относится к слабым электролитам, то ионов водорода и ацетат-ионов образуется мало.
Как и минеральные кислоты, уксусная кислота взаимодействует с металлами, основными оксидами, основаниями и солями:
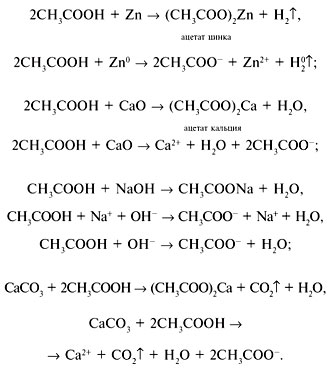
Cвойства уксусной кислоты,
характерные для карбоновых кислот
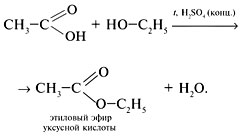
• Взаимодействие со спиртами:
• Образование ангидридов:
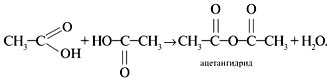
• Взаимодействие с хлором:
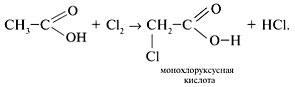
В результате электроноакцепторного влияния галогена на карбоксильную группу монохлоруксусная кислота более сильная, чем уксусная кислота, и приближается в этом отношении к сильным неорганическим кислотам.
Отдел рекламы (рассказ сопровождается демонстрацией выставки). Уксусную кислоту используют при консервации и как приправу к пище. Из уксусной кислоты синтезируют лекарства, соли, ацетатный шелк, фруктовые эссенции, растворители лаков, красители для тканей, средства борьбы с насекомыми и болезнями растений, стимуляторы роста растений.
Уксусный ангидрид применяется в производстве пластических масс, искусственного шелка, ацетанилида.
Из монохлоруксусной кислоты получают негорючую кинопленку, органическое стекло, пропускающее ультрафиолетовые лучи. В результате применения 2,4-дихлорфеноксиуксусной кислоты и ее солей на полях с зерновыми погибают только широколиственные сорняки, что используется при выращивании зерновых культур.
1-й специалист-химик. Знаете ли вы, что если потребуется отвинтить ржавую гайку, то рекомендуется вечером положить на нее тряпку, смоченную в уксусной кислоте? Утром отвинтить эту гайку будет значительно легче.
2-й специалист-химик. Знаете ли вы, что в течение суток в организме человека образуется 400 г уксусной кислоты? Этого хватило бы для изготовления 8 л обычного уксуса.

