
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
6. Углеводы: моно, ди- и полисахариды
Углеводы разделяют на простые (моносахариды) и сложные (полисахариды).
Моносахариды (монозы). Это гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды имеют молекулярную формулу Сп(Н2О)п, которая послужила основой для названия данного класса соединений (углерод + вода). По своей структуре монозы относятся к полиоксиальдегидам (альдозам) или полиоксикетонам (кетозам). В зависимости от числа атомов углерода монозы делят на триозы (три атома), тетрозы (четыре атома), пентозы (пять атомов) и гексозы (шесть атомов). В зависимости от строения карбонильной группы монозы обозначают: альдотриоза, альдогексоза, кетогексоза и т.п.
6.1 Оптическая изомерия моносахаридов.
Моносахариды являются оптически активными соединениями, могут содержат от 1 до 4 асимметрических атомов углерода.
Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех асимметрических атомов углерода и образуют D-форму (см. Приложение 2) и L-форму — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части асимметрических атомов углерода и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами. Обычно к названию добавляют номер эпимерного атома углерода, 2-эпимеры называют просто эпимерами. Например, D-аллоза и D-альтроза – эпимеры, D-аллоза и D-глюкоза – 3-эпимеры, D-аллоза и D-гулоза – 4-эпимеры.
В качестве стандарта для определения принадлежности соединения стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она находится справа, то соединение относят к D-ряду, если слева — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.

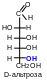

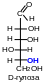
6.2 Цикло-оксо-таутомерия моносахаридов. В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических пяти- и шестичленных полуацеталей. Таким образом, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси):
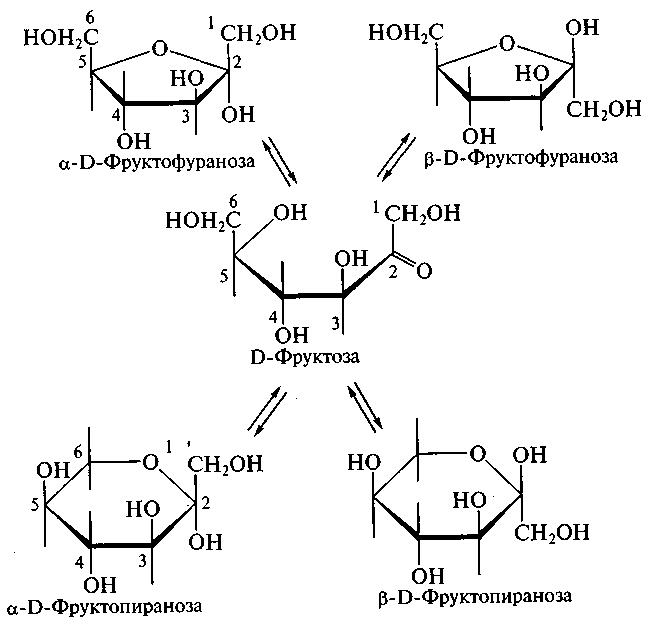
Рисунок 8 – Схема цикло-оксо-таутомерии D-фруктозы
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса.
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны.
В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1 в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа –ОН, называемая полуацетальным гидроксилом. Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют -аномером, если не совпадает — -аномером.
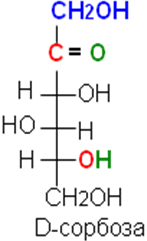
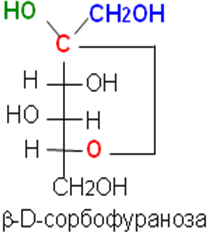
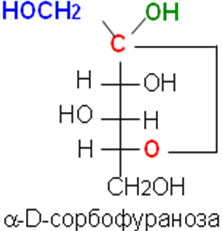
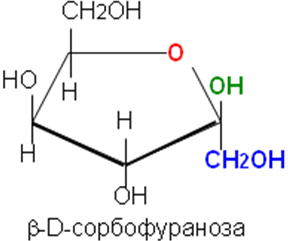
Таким образом, - и -аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм осуществляется только через открытую оксо-форму.
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание - или -аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как -, так и -D- глюкопираноз, содержит 36 % -изомера и 64 % -формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глкжозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме.
6.3 Химические свойства моносахаридов. В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей.
1. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа.
Простые эфиры получают при взаимодействии гидроксильных групп моноз с алкилгалогенидами. Одновременно в реакцию вступают как полуацетальная, так и спиртовые гидроксигруппы. Полуацетальная группа –ОН более реакционноспособна, поэтому образование простого эфира по этой группе протекает быстрее и может протекать и при взаимодействии моноз с низшими спиртами в присутствии хлороводорода. Образующиеся при этом моноэфиры называют гликозидами (пиранозидами и фуранозидами).
П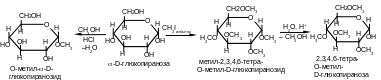 ростые
эфиры, образованные спиртовыми
гидроксильными группами не гидролизуются,
а гликозидная связь легко подвергается
гидролизу в щелочной среде. Растворы
гликозидов не мутаротируют.
ростые
эфиры, образованные спиртовыми
гидроксильными группами не гидролизуются,
а гликозидная связь легко подвергается
гидролизу в щелочной среде. Растворы
гликозидов не мутаротируют.
Молекулы этанола или йодистого метила выступают в данной реакции в роли нуклеофилов. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов.
Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов — нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения.
При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза.
Б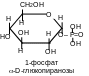
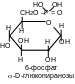
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты.
2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться только карбонильная группа — «мягкое» окисление с образованием –оновых кислот
Окисление карбонильной и первичная гидроксильной группы — «жесткое» окисление, например, раствором HNO3 до гликаровых кислот.
Окисление только первичной гидроксильной группы в мягких условиях (например, при действии ферментов) при защите альдегидной группы приводит к образованию гликуроновых кислот.
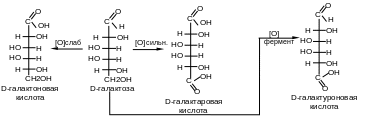
Гликурониды при нагревании декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу.
Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой.
Восстанавливающие моно- и дисахариды восстанавливают ионы меди(П), входящие в состав реактива Фелинга или в состав реактива Бенедикта до оксида меди (I) Сu2О, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов.
3. Моносахариды подвергаются химическому либо билогическому восстановлению. Восстановление моноз приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты.
П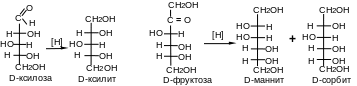 ри
восстановлении альдоз образуется один
спирт, а при восстановлении кетоз
получают два стеоизомерных многоатомных
спирта, т.к. неасиметрический 2-й атом
углерода в кетозе (атом кетогруппы)
после восстановления становится
асимметрическим и возможны две ориентации
гидроксильной группы, связанной с ним.
ри
восстановлении альдоз образуется один
спирт, а при восстановлении кетоз
получают два стеоизомерных многоатомных
спирта, т.к. неасиметрический 2-й атом
углерода в кетозе (атом кетогруппы)
после восстановления становится
асимметрическим и возможны две ориентации
гидроксильной группы, связанной с ним.

4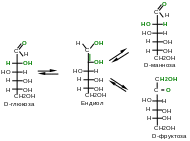 .
Реакция изомеризации (эпимеризации)
всегда происходит по кислотному центру
моносахаридов, которым является атом
углерода, непосредственно связанный с
карбонильной группой. Реакция протекает
под действием разбавленных растворов
щелочей или ферментативно и сопровождается
внутримолекулярным окислением-восстановлением
атомов углерода С1
и С2.
В ходе этой перегруппировки из-за
переноса протона, осуществляемого под
влиянием иона ОН–,
возникает промежуточное соединение —
ендиол (двойная связь (-ен) между двумя
гидроксильными группами (диол)).
Превращения ендиола могут привести к
образованию как кетозы, так и двух
альдоз.
.
Реакция изомеризации (эпимеризации)
всегда происходит по кислотному центру
моносахаридов, которым является атом
углерода, непосредственно связанный с
карбонильной группой. Реакция протекает
под действием разбавленных растворов
щелочей или ферментативно и сопровождается
внутримолекулярным окислением-восстановлением
атомов углерода С1
и С2.
В ходе этой перегруппировки из-за
переноса протона, осуществляемого под
влиянием иона ОН–,
возникает промежуточное соединение —
ендиол (двойная связь (-ен) между двумя
гидроксильными группами (диол)).
Превращения ендиола могут привести к
образованию как кетозы, так и двух
альдоз.
Рисунок 9 – Схема кето-енольной таутомерии моноз
В результате реакции постепенно образуется равновесная смесь изомеров. Например, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
