
- •В.И. Вшивцев, с.В. Жуковин основные свойства элементов и их соединений
- •Печатается в авторской редакции
- •Некоторые универсальные постоянные
- •Электроотрицательность элементов по полингу
- •Продолжение табл. 2
- •Продолжение табл. 2
- •Продолжение табл. 2
- •Продолжение табл. 2
- •Окончание табл. 2
- •Константы диссоциации некоторых слабых электролитов
- •Растворимость солей, кислот и оснований в воде
- •Важнейшие степени окисления элементов а) Главные подгруппы
- •Б) Побочные подгруппы
- •Окислительно-восстановительные переходы. Важнейшие окислители и восстановители окислители
- •Восстановители
- •Окислительно-восстановительная двойственность
- •Реакции самоокисления и самовосстановления
- •Перенапряжение выделения водорода и ионизации кислорода на различных металлах (в), плотность тока 1 мА/см2
- •Стандартные электродные потенциалы систем по отношению
- •Продолжение табл. 11
- •Продолжение табл. 11
- •Продолжение табл. 11
- •Окончание табл. 11
- •Общие константы нестойкости кн комплексов [mLn] в водном растворе
- •Продолжение табл. 12
- •Продолжение табл. 12
- •Окончание табл. 12
- •Тривиальные названия некоторых веществ и смесей
Важнейшие степени окисления элементов а) Главные подгруппы
Элементы I – III групп имеют единственные степени окисления – положительные и по величине равные номеру группы.
Элементы IV – VI групп, кроме высшей положительной, равной номеру группы, и низшей отрицательной, равной (-8 + № группы), имеют промежуточную положительную степень окисления, на две единицы меньшую, чем высшая степень окисления.
Элемент V группы висмут (Bi) встречается только в степени окисления +3.
Элементы VII группы имеют все нечетные степени окисления от +7 до –1.
Исключения составляют кислород (степень окисления равна –2 и –1 в пероксидах) и фтор (степень окисления –1), которые не имеют положительных степеней окисления.
Б) Побочные подгруппы
Из побочных подгрупп отметим степень окисления некоторых элементов.
В I группе: медь (Cu) - +2 и +1
серебро (Ag) - +1
золото (Au) - +3 и +1
Во II группе: цинк (Zn) - +2
кадмий (Cd) - +2
ртуть (Hg) - +2 и +1 (в последнем случае формулы все гда сдвоенные: Hg2Cl2)
В VI группе: хром (Cr) - +6, +3, (+2)
В VII группе: марганец (Mn) - +7, +6, +4, +2
В VIII группе: железо (Fe) - +3 и +2
кобальт (Co) - +3 и +2
никель (Ni) - +3 и +2
Окислительно-восстановительные переходы. Важнейшие окислители и восстановители окислители
Свободные элементы (неметаллы):
О2 (О2-) Н2О, ОН-
F2 F-
Cl2 +восстановитель → Cl-
Br2 Br-
I2 I-
(Преимущественно) высшие кислородные кислоты и их соли.
H2SO4 (конц.) + восстановитель → SO2
+ сильный восстановитель → H2S
(KI, активный металл)
HNO3 (конц.) + восстановитель → NO2
HNO3 (разб.) + восстановитель → NO
HNO3 (сильно разб.) + активный металл → NH4+
M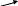 nO4-
кислая среда Mn2+
nO4-
кислая среда Mn2+
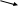 + восстановитель
+ восстановитель
MnO42- нейтральная или щелочная среда MnO2
В сильно щелочной среде в условиях недостатка восстановителя KMnO4 можно перевести в K2MnO4.
Cr2O72- -
+ восстановитель → Cr3+ (хроматы и дихроматы проявляют окисли-
CrO42- тельные свойства чаще в кислой среде)
ClO3- Cl-
BrO3- в кислой среде + восстановитель → Br-
IO3- I-
Металлы с переменной валентностью в высшей степени окисления.
Fe3+ Fe2+
PbO2 преимущественно в кислой среде + восстановитель → Pb2+
MnO4- Mn2+
H+ со свободными активными металлами → H2
