
- •Физическая химия
- •Магнитогорск
- •Расчетно-графическоезадание№1
- •1. Составить уравнение зависимости от температуры величины теплового эффекта и изменения энтропии.
- •2. Вычисление величин , , и 1пКр при различных температурах и построение графиков в координатах: -т; - т; -т и lпКр-1/т
- •4. Определение количества фаз, независимых компонентов и числа степеней свободы
- •5. Определение возможного направления протекания реакции и равновесного состава газовой смеси
- •6. Установление направления смещения равновесия
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВПО «МАГНИТОГОРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. Г. И.НОСОВА»
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ НЕМЕТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
И ФИЗИЧЕСКОЙ ХИМИИ
 http://www.magtu.ru/index.php?option=com_datsogallery&func=slideshow&catid=103&id=695&format=raw
http://www.magtu.ru/index.php?option=com_datsogallery&func=slideshow&catid=103&id=695&format=raw
Физическая химия
Методические указания
к выполнению расчетно-графического задания № 1
Магнитогорск
2012
Введение
Расчеты
химических равновесий являются важнейшим
этапом рассмотрения
любых металлургических процессов.
Предлагаемое руководство
позволяет на основе термодинамических
характеристик простых
веществ и соединений рассчитать изменения
термодинамических функций
 ,
,
 ,
,
 и
далее
и
далее
 для различных химических превращений
и определить состав равновесной системы
при различных условиях
протекания процесса. Необходимость
подобных расчетов возникает
на всем протяжении учебного процесса:
в курсах физической химии,
теории металлургических процессов,
специальных курсах, а также в курсовых
научно-исследовательских работах,
курсовых и дипломных проектах.
для различных химических превращений
и определить состав равновесной системы
при различных условиях
протекания процесса. Необходимость
подобных расчетов возникает
на всем протяжении учебного процесса:
в курсах физической химии,
теории металлургических процессов,
специальных курсах, а также в курсовых
научно-исследовательских работах,
курсовых и дипломных проектах.
Цель задания - освоение методики расчета термодинамических характеристик химической реакции с помощью таблиц стандартных термодинамических величин. При выполнении задания студент определяет по таблицам необходимые характеристики компонентов реакции и находит далее стандартные изменения энтальпии , энтропии , энергии Гиббса а затем константы равновесия Кр . Располагая этими величинами, можно определить направление реакции, ее тепловой эффект при заданной температуре, оценить выход продуктов реакции, рассчитать состав равновесной системы и изменение всех этих характеристик при изменении внешних параметров, подобрать оптимальные условия проведения процесса.
1. ФОРМУЛИРОВКА ЗАДАНИЯ
Для реакции протекающей по схеме аА + bВ= сС + dD, где А, В, С, D - вещества - участники реакции (колонки 3, 4, 5, б в табл.1); a,b,c,d -стехиометрические коэффициенты (вариант и номер задания указаны в колонках 1 и 2 табл. 1):
1. Составить уравнение зависимости от температуры величины теплового эффекта = f(T) и изменения энтропии , = f(T).
2. Вычислить величины , , и 1пКр при нескольких температурах, значения которых задаются температурным интервалом и шагом температур (колонки 7 и 9 в табл.1). Полученные значения свести в таблицу и построить графики в координатах: -Т; - Т; -Т; lпКр-1/Т
3. Пользуясь графиком lпКр-1/Т, вывести приближенное уравнение вида lпКр = А/Т + В , где А, В - постоянные.
Используя правило фаз Гиббса, для рассматриваемой системы определить количества фаз, независимых компонентов и число степеней свободы.
Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при заданном давлении и температуре (колонки 14 и 15 в табл.1). При решении из задачи использовать выведенное в первой части эмпирическое уравнение lпКр = А/Т + В и данные об исходном составе газовой фазы (колонки 10,11,12,13 в табл. 1).
6. Установить направление смещения равновесия в рассматриваемой системе при:
а) увеличении давления(при постоянной температуре);
б) увеличении температуры (при постоянном давлении).
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
В первой части необходимо составить уравнение зависимости от температуры величины теплового эффекта - Т и изменения энтропии - Т, a также вычислить величины , , и 1пКр при нескольких температурах.
3ависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
 (1)
(1)
 - стандартный
тепловой эффект реакции при 298К;
- стандартный
тепловой эффект реакции при 298К;
∆ср - изменение теплоемкости системы в результате протекания реакции.
Значение определяется по закону Гесса:
 . (2)
. (2)
Изменение теплоемкости ∆ср рассчитывается по уравнению:
 , (3)
, (3)
где сpi – мольная изобарная теплоемкость i-го вещества;
ni – стехиометрический коэффициент i-го вещества в уравнении реакции.
Теплоемкость зависит от температуры по уравнению:
 , (4)
, (4)
где
 - эмпирические коэффициенты.
- эмпирические коэффициенты.
В результате реакции теплоемкость изменяется, а разность теплоемкостей определяется по уравнению:
 , (5)
, (5)
где
 ;
;

 (6)
(6)
Коэффициенты а.b,с' приводятся в справочнике. Изменение энтропии системы в результате протекания процесса определяется по уравнению:
 , (7)
, (7)
где
 - стандартное изменение энтропии для
реакции при 298К.
- стандартное изменение энтропии для
реакции при 298К.
Его
можно определить по мольным стандартным
энтропиям веществ


Значения для соответствующих веществ приведены в справочнике.
При расчете изменения стандартной энергии Гиббса для реакции необходимо воспользоваться уравнением Гиббса- Гельмгольца:
 . (9)
. (9)
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
 , (10)
, (10)
где R - универсальная газовая постоянная, равная R = 8,31 Дж/мольК;
Т - абсолютная температура.
Во второй части необходимо определить количество фаз, независимых компонентов и число степеней свободы по правилу фаз Гиббса, а также возможное направление протекания исследуемой реакции и равновесный состав газовой смеси; установить направление смещения состояния равновесия рассматриваемой системы.
Количество фаз определяют исходя из определения фазы - это однородная часть гетерогенной системы, с одинаковыми физическими и химическими свойствами, имеющая границы раздела, при переходе через которые свойства системы меняются скачком.
Например, реакция СО(Г) +С12(Г)= СОС1(2Г). Рассматриваемая система состоит из одной фазы (газообразной), которая представляет смесь газов СО(Г) , С12(Г) , СОС1(2Г) .
Или, например, реакция
FeS(TB) + 2HCl(Г) = FeCl2(TB) + H2S(Г).
Рассматриваемая система состоит из трех фаз: двух твердых фаз FeS(TB) и FeCl2(TB) , а также одной газообразной, которая представляет смесь газов 2HCl(Г) и H2S(Г).
Число независимых компонентов k равно наименьшему числу составных частей системы, необходимых для образования всех ее фаз при равновесии. Это число определяют как общее число веществ в системе т за вычетом числа связей между ними r,то есть:
к = т - r. (11)
Число степеней свободы с (вариантность системы) равно наибольшему числу термодинамических параметров (давления, температуры, концентрации компонентов), которые можно изменять в некоторых пределах так, чтобы число и природа фаз в равновесной системе оставались прежними.
Число степеней свободы определяют по правилу фаз Гиббса:
с=n+k-ф (12)
где п - число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, то есть n=2 .
Для определения возможного направления протекания реакции необходимо воспользоваться уравнением изотермы Вант-Гоффа:
∆G = RТ(lпПр-1пКр), (13)
где П - произведение фактических парциальных давлений газовых компонентов реакции;
Кр – константа равновесия реакции при данной температуре.
В соответствии со вторым законом термодинамики в изобарно-изотермических условиях возможно самопроизвольное протекание процессов, сопровождающихся уменьшением энергии Гиббса системы:
∆G<0. (14)
В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при ∆G < 0 и справа налево при ∆G > 0 . Из уравнения (14) следует, что первое условие (∆G < 0 ) выполняется при Пр < Кр а второе( ∆G > 0)-при Пр > Кр .
Равновесный состав газовой смеси рассчитывается при заданной температуре по известной константе равновесия. Рассмотрим эту задачу на пример е реакции
4НС1(Г)+О2(Г)=2Н2О+2Cl2(Г)
Дано: общее давление Р= 0,1атм., исходные количества веществ равны(слева направо) 1,0; 5,0; 2,0; 0,1 молей, Кр = 0,0495.
Пусть при переходе в состояние равновесия прореагировало х молей компонента со стехиометрическим коэффициентом 1, в данном случае кислорода. Запишем под уравнением реакции исходные и равновесные числа молей компонентов:
4НС1(Г)+О2(Г)=2Н2О+2Cl2(Г)
nисх |
1,0 |
5,0 |
2,0 |
0,1 |
nравн |
1,0 -4х |
5,0-х |
2,0 + 2х |
0,1 + 2х |
Суммарное количество молей газообразных веществ равно
nΣ = 1,0 - 4х + 5,0 – х + 2,0 + 2х + 0,1 + 2х = 8,1 - х
Мольные доли каждого вещества в момент равно веси я равны:
 ;
;
 ;
;
 ;
;

Умножим каждую мольную долю на общее давление, выраженное в относительных единицах. При этом получим парциальные давления газообразных реагентов (конденсированные вещества при этом не учитываются).
 ;
;
 ;
;
 ;
;

Равновесный состав газовой смеси определяется из выражения константы равновесия рассчитываемой реакции:

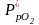 ,
,
 ,
,

 -
равновесные парциальные давления О2(Г),
Н2О,
Сl2(Г),
НСl2(Г)
соответственно, выраженные
в относительных единицах.
-
равновесные парциальные давления О2(Г),
Н2О,
Сl2(Г),
НСl2(Г)
соответственно, выраженные
в относительных единицах.
Для нахождения относительного давления следует давление, выраженное в Паскалях, разделить на стандартное давление, равное 101325 Па.
Найдем общее давление, выраженное в относительных единицах:
 (16)
(16)
Подставим , , в выражение(15).

Учитывая, что Р = 0,1 , можно записать
 (17)
(17)
Это уравнение можно решить любым численным методом, например методом половинного деления. После нахождения корня х можно рассчитать числа молей каждого компонента в состоянии равновесия и мольные доли газообразных реагентов. Это и будет результатом расчета со става равно весной си темы.
Если константа равновесия очень велика или очень мала, то уравнение типа (17) можно легко решить методом последовательных приближений.
Предположим,
что в уравнении (17) справа стоит очень
большое число,
например 1010.
Это означает, что какой-то множитель в
знаменателе очень
мал. Очевидно, мал может быть только
множитель (1
— 4х),
так как ни
одна из скобок не может быть отрицательной
и
(5-х)
> (1-4х).
Введем обозначение у
= 1 -4х,
причем y
<< 1 .Тогда
 и
выражение(17) можно записать в виде:
и
выражение(17) можно записать в виде:
 , (18)
, (18)
 , (19)
, (19)
Поскольку величина «у» очень мала, то в первом приближении отбросим «у» во всех скобках. Тогда находим

Откуда
У1 = 2,469 10-3
Это
- первое приближение. Для следующего
приближения подставим во
все скобки уравнения (19) величину у. При
этом получается второе приближение:у2
=
2,466
10-3,
которое мало отличается от первого.
Аналогично
находим третье приближение: у3
= 2,466
10-3.
На этом
вычисления
можно закончить. Теперь находим
 .
Зная х,
рассчитываем
мольные доли.
.
Зная х,
рассчитываем
мольные доли.
Следует иметь в виду, что у одного из компонентов при этом получится очень малая величина мольной доли. Ясно, что ее надо вычислять не через х, а непосредственно через у.
Аналогично решается задача, если константа Кр очень мала. Тогда надо искать тот множитель в числителе выражения (18), который очень мал, обозначить его через у и действовать, как описано выше.
Последний пункт задания выполняется исходя из принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то в системе самопроизвольно происходят процессы, ослабляющие это воздействие.
ПРИЛОЖЕНИЕ 1
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ЗАДАНИЯ
Расчетно-графическая работа должна содержать:
- титульный лист;
- формулировку задания;
само задание (исходные данные);
расчет (включая таблицы и рисунки).
Расчетно-графическое задание пишут от руки или печатают на машинке или компьютере на одной стороне листа белой бумаги формата 297 x 210 мм (А4) с полями не менее 25 мм слева и не менее 8 мм справа, которые затем помещают в файл.. Все страницы рукописи должны быть пронумерованы. Номера страниц проставляют в середине нижнего листа. Первой считается титульный лист, на ней цифра «1» не ставится. На следующей странице ставится цифра «2» и т.д.
Каждый новый раздел следует начинать с новой страницы. Разделы и подразделы должны иметь наименования. Точка в конце заголовка, раздела и подраздела не ставится. Разделы, подразделы и пункты нумеруются арабскими цифрами.
Рисунки и таблицы должны иметь порядковый номер и название, их нумерация сквозная по всему тексту расчетно-графической работы. В тексте слова «рисунок» и «таблица» пишутся сокращенно, как «рис.» и «табл.», а в заголовке слово таблица пишется полностью. Остальные сокращения в тексте не допускаются.
Формулы должны быть вписаны в текст тщательно, разборчиво и иметь сквозную нумерацию.
Приложение 2
таблица 1
3. ИСХОДНЫЕ данные для выполения расчетно-графического задания по дисциплине «физическая химия»
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
|
|||
|
|
|
|
|
|
|
|
|
1 |
|
AgI(тв) |
H2S(Г) |
Ag2S(тв) |
HI(Г) |
200-600 |
|
|
|
Pb(тв) |
HBr(Г) |
PbBr2(тв) |
H2 (Г) |
200-600 |
||
|
|
SnCl2(тв) |
H2S(Г) |
SnS2 |
HCl (Г) |
300-400 |
||
|
|
Fe3O4 (тв) |
H2 (Г) |
FeO (тв) |
H2O(Г) |
450-900 |
||
|
|
H2 (Г) |
CO2 (Г) |
H2O(Г) |
CO (Г) |
1600-2500 |
||
|
|
H2S(Г) |
CO2 (Г) |
H2O(Г) |
COS (Г) |
800-1700 |
||
|
|
CO(Г) |
PbO (тв) |
CO2 (Г) |
Pb (тв) |
300-750 |
||
|
|
H2S(Г) |
SO2 (Г) |
S2 (Г) |
H2O(Г) |
500-1400 |
||
|
|
FeO (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
300-525 |
||
|
|
CO2 (Г) |
- |
CO (Г) |
O2 (Г) |
1100-2000 |
||
|
|
SO2 (Г) |
Cl2 (Г) |
SOCl2 (Г) |
- |
300-480 |
||
|
|
SOCl2 (Г) |
- |
SO2 (Г) |
Cl2 (Г) |
500-700 |
||
|
|
PCl5 (Г) |
- |
PCl3 |
Cl2 (Г) |
400-850 |
||
|
|
NO2 (Г) |
- |
NO (Г) |
O2 (Г) |
300-1200 |
||
|
|
PbO (тв) |
H2 (Г) |
Pb (тв) |
H2O(Г) |
300-570 |
||
|
|
CuCl2 (тв) |
H2 (Г) |
Cu (тв) |
HCl (Г) |
300-660 |
||
|
|
H2O(Г) |
- |
H2 (Г) |
O2 (Г) |
1600-2500 |
||
|
|
SO2 (Г) |
O2 (Г) |
SO3 (Г) |
- |
300-1200 |
||
|
|
N2 (Г) |
O2 (Г) |
N2O (Г) |
- |
1100-2000 |
||
|
|
CdBr2 (тв) |
HCl (Г) |
CdCl2 (Г) |
HBr (Г) |
750-950 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
50 |
- |
15 |
- |
85 |
1520 |
500 |
||
|
|
50 |
- |
25 |
- |
75 |
1520 |
500 |
||
|
|
25 |
- |
35 |
- |
65 |
1520 |
350 |
||
|
|
50 |
- |
20 |
- |
80 |
1013 |
800 |
||
|
|
100 |
20 |
10 |
40 |
30 |
3039 |
2000 |
||
|
|
100 |
10 |
30 |
30 |
30 |
1013 |
1300 |
||
|
|
50 |
20 |
- |
80 |
- |
1013 |
570 |
||
|
|
100 |
40 |
10 |
25 |
25 |
2026 |
900 |
||
|
|
25 |
- |
80 |
- |
20 |
1013 |
450 |
||
|
|
50 |
30 |
- |
30 |
40 |
1013 |
1600 |
||
|
|
20 |
20 |
10 |
70 |
- |
3039 |
400 |
||
|
|
50 |
90 |
- |
5 |
5 |
2026 |
650 |
||
|
|
50 |
40 |
- |
30 |
30 |
1013 |
500 |
||
|
|
100 |
20 |
- |
40 |
40 |
1013 |
1000 |
||
|
|
20 |
- |
80 |
- |
20 |
1013 |
450 |
||
|
|
20 |
- |
10 |
- |
90 |
5065 |
580 |
||
|
|
100 |
40 |
- |
20 |
40 |
1013 |
2500 |
||
|
|
100 |
20 |
20 |
60 |
- |
1013 |
900 |
||
|
|
100 |
40 |
40 |
20 |
- |
1013 |
2000 |
||
|
|
25 |
- |
55 |
- |
45 |
1013 |
800 |
||
Вариант |
Номер задания |
Исследование 1 |
||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
|||||
Компоненты |
||||||
а |
в |
с |
d |
|||
|
|
|
|
|
|
|
|
2 |
|
FeO (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
700-1000 |
|
|
Fe2O3 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
800-1400 |
|
|
|
Fe3O4 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
600-1300 |
|
|
|
Fe2O3 (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
800-1300 |
|
|
|
Fe3O4 (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
800-1100 |
|
|
|
Mn2O3 |
CO (Г) |
Mn (тв) |
CO2 (Г) |
750-1100 |
|
|
|
MnO |
CO (Г) |
Mn (тв) |
CO2 (Г) |
650-1000 |
|
|
|
CO (Г) |
H2 (Г) |
CO2 (Г) |
H2 (Г) |
700-1200 |
|
|
|
C (тв) |
H2O(Г) |
CO2 (Г) |
H2 (Г) |
800-1100 |
|
|
|
Cr2O3 (тв) |
CO (Г) |
CO2 (Г) |
Cr (тв) |
1900-1200 |
|
|
|
Fe3C (тв) |
CO2 (Г) |
Fe (тв) |
CO (Г) |
700-950 |
|
|
|
Al2O3 (тв) |
CO (Г) |
Al (тв) |
CO2 (Г) |
350-900 |
|
|
|
MnO2 (тв) |
CO (Г) |
MnO (тв) |
CO2 (Г) |
900-1150 |
|
|
|
Ti (тв) |
CO2 (Г) |
TiO2 (тв) |
CO (Г) |
850-1350 |
|
|
|
V2O5 (тв) |
CO (Г) |
V (тв) |
CO2 (Г) |
750-1350 |
|
|
|
Fe (тв) |
CO2 (Г) |
FeO (тв) |
CO (Г) |
900-1300 |
|
|
|
HCl (Г) |
O2 (Г) |
H2O(Г) |
Cl2 (Г) |
980-1500 |
|
|
|
H2O(Г) |
Cl2 (Г) |
HCl (Г) |
O2 (Г) |
1300-1800 |
|
|
|
SO2 (Г) |
O2 (Г) |
SO3 (Г) |
- |
500-1800 |
|
|
|
H2(Г) |
Br2 (Г) |
HBr (Г) |
- |
1800-2000 |
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
50 |
- |
30 |
- |
70 |
2026 |
700 |
||
|
|
100 |
- |
60 |
- |
40 |
1013 |
800 |
||
|
|
100 |
- |
25 |
- |
75 |
1520 |
1000 |
||
|
|
50 |
- |
85 |
- |
15 |
1013 |
1100 |
||
|
|
50 |
- |
75 |
- |
25 |
2026 |
1100 |
||
|
|
50 |
- |
30 |
- |
70 |
1520 |
950 |
||
|
|
50 |
- |
40 |
- |
60 |
2026 |
850 |
||
|
|
100 |
20 |
40 |
30 |
10 |
1013 |
1100 |
||
|
|
50 |
- |
60 |
15 |
25 |
1520 |
1000 |
||
|
|
50 |
- |
30 |
70 |
- |
2026 |
1050 |
||
|
|
50 |
- |
80 |
- |
20 |
1520 |
900 |
||
|
|
50 |
- |
85 |
- |
15 |
1520 |
650 |
||
|
|
50 |
- |
80 |
10 |
10 |
2026 |
1050 |
||
|
|
100 |
- |
60 |
- |
40 |
1013 |
1250 |
||
|
|
100 |
- |
70 |
- |
30 |
1013 |
1250 |
||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1000 |
||
|
|
50 |
20 |
30 |
10 |
40 |
505 |
1000 |
||
|
|
100 |
70 |
10 |
10 |
10 |
2026 |
900 |
||
|
|
200 |
40 |
40 |
20 |
- |
1013 |
400 |
||
|
|
25 |
30 |
60 |
10 |
- |
2026 |
1200 |
||
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
||||
|
|
|
|
|
|
|
|
|
3 |
|
СО(Г) |
O2 (Г) |
CO2(Г) |
- |
500-2000 |
|
|
|
Н2(Г) |
O2 (Г) |
H2O(Г) |
- |
500-2000 |
||
|
|
СО2(Г) |
H2 (Г) |
CO2(Г) |
H2O(Г) |
500-2000 |
||
|
|
С(тв) |
O2 (Г) |
CO2(Г) |
- |
500-2000 |
||
|
|
С(тв) |
O2 (Г) |
CO2(Г) |
- |
500-2000 |
||
|
|
С(тв) |
H2O(Г) |
CO2(Г) |
H2O(Г) |
500-2000 |
||
|
|
СО(Г) |
C (тв) |
CO2(Г) |
- |
500-1800 |
||
|
|
Fe2O3 (тв) |
СО(Г) |
Fe3O4 (тв) |
CO2(Г) |
500-2000 |
||
|
|
Fe3O4 (тв) |
СО(Г) |
FeO (тв) |
CO2(Г) |
500-2000 |
||
|
|
FeO (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
500-1800 |
||
|
|
MnO2 (тв) |
СО(Г) |
Mn (тв) |
CO2(Г) |
900-1150 |
||
|
|
NiO (тв) |
СО(Г) |
Ni (тв) |
CO2(Г) |
500-2000 |
||
|
|
MnO (тв) |
СО(Г) |
Mn (тв) |
CO2(Г) |
500-2000 |
||
|
|
Fe2O3 (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
800-1300 |
||
|
|
Fe3O4 (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
800-1100 |
||
|
|
Mn2O3 |
СО(Г) |
Mn (тв) |
CO2(Г) |
750-1100 |
||
|
|
FeO (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
700-1000 |
||
|
|
Fe2O3 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
800-1400 |
||
|
|
Fe3O4 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
600-1300 |
||
|
|
FeO (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
850-1200 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
200 |
30 |
10 |
60 |
- |
1013 |
1000 |
||
|
|
200 |
20 |
20 |
60 |
- |
1013 |
1100 |
||
|
|
200 |
10 |
20 |
50 |
20 |
1013 |
1083 |
||
|
|
200 |
- |
20 |
80 |
- |
1013 |
1200 |
||
|
|
200 |
- |
30 |
- |
70 |
2026 |
1400 |
||
|
|
200 |
- |
20 |
10 |
70 |
2026 |
1600 |
||
|
|
200 |
40 |
- |
60 |
- |
1520 |
1300 |
||
|
|
200 |
- |
50 |
- |
50 |
1520 |
1100 |
||
|
|
200 |
- |
60 |
- |
40 |
2026 |
1300 |
||
|
|
200 |
- |
70 |
- |
30 |
1013 |
1500 |
||
|
|
200 |
- |
80 |
- |
20 |
2026 |
1050 |
||
|
|
200 |
- |
20 |
- |
80 |
1013 |
1000 |
||
|
|
200 |
- |
10 |
- |
90 |
1520 |
1100 |
||
|
|
50 |
- |
75 |
- |
25 |
2026 |
1100 |
||
|
|
50 |
- |
30 |
- |
70 |
1520 |
950 |
||
|
|
50 |
- |
80 |
- |
20 |
1013 |
950 |
||
|
|
50 |
- |
30 |
- |
70 |
2026 |
700 |
||
|
|
100 |
- |
60 |
- |
40 |
1013 |
800 |
||
|
|
100 |
- |
25 |
- |
75 |
1520 |
1000 |
||
|
|
50 |
- |
85 |
- |
15 |
1013 |
1100 |
||
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
||||
|
|
|
|
|
|
|
|
|
4 |
|
SiO2(тв) |
HF (Г) |
SiF4 (Г) |
H2O(Г) |
350-800 |
|
|
|
Cl(Г) |
- |
Cl2 (Г) |
- |
600-1500 |
||
|
|
COS(Г) |
- |
CO2(Г) |
CS2 (Г) |
300-1200 |
||
|
|
H2S(Г) |
O2 (Г) |
SO2(Г) |
H2O(Г) |
900-1800 |
||
|
|
H2(Г) |
Br2 (Г) |
HBr (Г) |
- |
600-1500 |
||
|
|
TeSe (Г) |
- |
Te2 (Г) |
Se (Г) |
300-3200 |
||
|
|
СО(Г) |
- |
С(тв) |
O2 (Г) |
1400-2300 |
||
|
|
ZnS (тв) |
O2 (Г) |
Zn (тв) |
SО(Г) |
350-700 |
||
|
|
CaCl2 (тв) |
H2O(Г) |
CaO (тв) |
HCl (Г) |
600-1050 |
||
|
|
MnO (тв) |
H2(Г) |
Mn (тв) |
H2O(Г) |
550-1000 |
||
|
|
CO(Г) |
SO2 (Г) |
S2 (Г) |
CO2(Г) |
900-1800 |
||
|
|
H2S(Г) |
SO2 (Г) |
S2 (Г) |
H2O(Г) |
500-1500 |
||
|
|
CO2(Г) |
- |
СО(Г) |
O2 (Г) |
1100-2000 |
||
|
|
NO2(Г) |
- |
NО(Г) |
O2 (Г) |
300-1200 |
||
|
|
CuCl2 (тв) |
H2(Г) |
Cu (тв) |
HCl (Г) |
300-700 |
||
|
|
СО(Г) |
S2(Г) |
COS (Г) |
- |
900-1800 |
||
|
|
AgCl (тв) |
H2(Г) |
Ag (тв) |
HCl (Г) |
3500-800 |
||
|
|
H2O(Г) |
- |
H2(Г) |
O2 (Г) |
1600-2500 |
||
|
|
Sb2S3 (тв) |
H2(Г) |
Sb (тв) |
H2S(Г) |
350-800 |
||
|
|
HCl (Г) |
S2(Г) |
H2O(Г) |
Cl2 (Г) |
600-1500 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
50 |
- |
20 |
20 |
40 |
1013 |
800 |
||
|
|
100 |
30 |
- |
70 |
- |
1013 |
1500 |
||
|
|
100 |
80 |
- |
10 |
10 |
5065 |
1000 |
||
|
|
100 |
20 |
20 |
20 |
40 |
1013 |
1800 |
||
|
|
100 |
10 |
40 |
50 |
- |
1013 |
1500 |
||
|
|
500 |
80 |
- |
10 |
10 |
1013 |
500 |
||
|
|
200 |
90 |
- |
- |
10 |
1013 |
2300 |
||
|
|
50 |
- |
40 |
- |
60 |
1013 |
690 |
||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1050 |
||
|
|
50 |
- |
15 |
- |
85 |
1013 |
1000 |
||
|
|
100 |
30 |
10 |
10 |
50 |
1013 |
1700 |
||
|
|
100 |
10 |
30 |
10 |
50 |
5065 |
900 |
||
|
|
100 |
30 |
- |
60 |
10 |
1013 |
2000 |
||
|
|
100 |
60 |
- |
30 |
10 |
2026 |
1000 |
||
|
|
50 |
- |
80 |
- |
20 |
3039 |
580 |
||
|
|
100 |
60 |
20 |
20 |
- |
1013 |
1500 |
||
|
|
50 |
- |
10 |
- |
90 |
1013 |
400 |
||
|
|
100 |
50 |
- |
25 |
25 |
1013 |
2500 |
||
|
|
50 |
- |
20 |
- |
80 |
1013 |
650 |
||
|
|
50 |
30 |
30 |
30 |
10 |
1013 |
700 |
||
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
||||
|
|
|
|
|
|
|
|
|
5 |
|
СО(Г) |
SO2(Г) |
S2(Г) |
CO2(Г) |
1800-2150 |
|
|
|
H2(Г) |
S2 (Г) |
- |
H2S(Г) |
1500-2000 |
||
|
|
AgCl(тв) |
H2(Г) |
Ag (тв) |
HCl (Г) |
1200-1500 |
||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
300-1200 |
||
|
|
ZnS(тв) |
O2 (Г) |
Zn (тв) |
SO2 (Г) |
700-1800 |
||
|
|
CaCl2(тв) |
H2O(Г) |
CaO (тв) |
HCl (Г) |
1000-2000 |
||
|
|
Ag2O(тв) |
S2 (Г) |
SO2 (Г) |
Ag (тв) |
1200-1800 |
||
|
|
HgO(тв) |
H2(Г) |
Hg (Г) |
H2O(Г) |
700-950 |
||
|
|
AgCl(тв) |
O2 (Г) |
Ag2O (тв) |
Cl2 (Г) |
700-1100 |
||
|
|
PCl3 (Г) |
Cl2 (Г) |
PCl5 (Г) |
- |
600-1800 |
||
|
|
PbO (Г) |
H2(Г) |
Pb (тв) |
H2O(Г) |
600-1800 |
||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
700-1100 |
||
|
|
Fe3C (тв) |
CO2(Г) |
Fe (тв) |
СО(Г) |
700-950 |
||
|
|
MnO (тв) |
H2(Г) |
Mn (тв) |
H2O(Г) |
1500-2000 |
||
|
|
NiS (тв) |
O2 (Г) |
Ni (тв) |
SO2 (Г) |
1500-2000 |
||
|
|
CO2(Г) |
С(тв) |
СО(Г) |
- |
900-1800 |
||
|
|
H2(Г) |
I2 (Г) |
HI (Г) |
- |
1000-2000 |
||
|
|
СО(Г) |
H2O(Г) |
CO2(Г) |
H2(Г) |
1200-1950 |
||
|
|
СО(Г) |
O2 (Г) |
CO2(Г) |
- |
2000-2500 |
||
|
|
NО(Г) |
- |
N2 (Г) |
O2 (Г) |
2500-3000 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
50 |
- |
20 |
20 |
40 |
1013 |
800 |
||
|
|
50 |
30 |
- |
70 |
- |
1013 |
1500 |
||
|
|
50 |
80 |
- |
10 |
10 |
5065 |
1000 |
||
|
|
100 |
20 |
20 |
20 |
40 |
1013 |
1800 |
||
|
|
100 |
10 |
40 |
50 |
- |
1013 |
1500 |
||
|
|
100 |
80 |
- |
10 |
10 |
1013 |
500 |
||
|
|
100 |
90 |
- |
- |
10 |
1013 |
2300 |
||
|
|
100 |
- |
40 |
- |
60 |
1013 |
690 |
||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1050 |
||
|
|
100 |
- |
15 |
- |
85 |
1013 |
1000 |
||
|
|
100 |
30 |
10 |
10 |
50 |
1013 |
1700 |
||
|
|
100 |
10 |
30 |
10 |
50 |
5065 |
900 |
||
|
|
50 |
30 |
- |
10 |
10 |
1013 |
2000 |
||
|
|
100 |
60 |
- |
30 |
10 |
2026 |
1000 |
||
|
|
50 |
- |
80 |
- |
20 |
3039 |
580 |
||
|
|
100 |
60 |
20 |
20 |
- |
1013 |
1500 |
||
|
|
50 |
- |
10 |
- |
90 |
1013 |
400 |
||
|
|
100 |
50 |
- |
25 |
25 |
1013 |
2500 |
||
|
|
50 |
- |
20 |
- |
80 |
1013 |
650 |
||
|
|
50 |
30 |
30 |
30 |
10 |
1013 |
700 |
||
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
||||
|
|
|
|
|
|
|
|
|
6 |
|
AgI (тв) |
H2(Г) |
Ag (тв) |
HI(Г) |
300-450 |
|
|
|
AlCl3 (тв) |
H2(Г) |
Al (тв) |
HCl (Г) |
320-600 |
||
|
|
AgBr (тв) |
H2(Г) |
Ag (тв) |
HBr(Г) |
450-700 |
||
|
|
AlBr3 (тв) |
H2(Г) |
Al (тв) |
HBr(Г) |
350-650 |
||
|
|
NbO5 (тв) |
H2(Г) |
NbO(тв) |
H2O(Г) |
1750-1950 |
||
|
|
AcO3 (тв) |
Cl2 (Г) |
AcCl3(тв) |
O2 (Г) |
1050-1500 |
||
|
|
B2O3 (тв) |
Cl2 (Г) |
BCl3 |
O2 (Г) |
650-850 |
||
|
|
BaO (тв) |
Cl2 (Г) |
BaCl3(тв) |
O2 (Г) |
550-900 |
||
|
|
BiO3 (тв) |
Cl2 (Г) |
BiCl2(тв) |
O2 (Г) |
350-850 |
||
|
|
Cr2O3 (тв) |
Cl2 (Г) |
CrCl3(тв) |
O2 (Г) |
350-750 |
||
|
|
CdO (тв) |
СО(Г) |
Cd(тв) |
CO2(Г) |
350-950 |
||
|
|
Al2O3 (тв) |
СО(Г) |
Al(тв) |
CO2(Г) |
450-900 |
||
|
|
TiC (тв) |
O2 (Г) |
TiO2 |
CO(Г) |
1650-2000 |
||
|
|
AsBr3 (тв) |
H2(Г) |
As(тв) |
HBr(Г) |
300-500 |
||
|
|
AgF (тв) |
H2(Г) |
Ag(тв) |
Hr(Г) |
450-750 |
||
|
|
BBR3 (тв) |
H2(Г) |
B(тв) |
HBr(Г) |
350-1000 |
||
|
|
BiBR3 (тв) |
H2(Г) |
Bi(тв) |
HBr(Г) |
500-1500 |
||
|
|
Ce2O3 (тв) |
Cl2 (Г) |
CeCl3(тв) |
O2 (Г) |
650-1050 |
||
|
|
La2O3 (тв) |
Cl2 (Г) |
LaCl3(тв) |
O2 (Г) |
550-1100 |
||
|
|
Re2O3 (тв) |
Cl2 (Г) |
ReCl3(тв) |
O2 (Г) |
350-450 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||
Компоненты |
|||||||
А |
В |
С |
D |
||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
|
|
50 |
- |
30 |
- |
70 |
1013 |
1500 |
|
|
100 |
- |
20 |
- |
80 |
1013 |
1300 |
|
|
50 |
- |
40 |
- |
60 |
2026 |
1800 |
|
|
100 |
- |
50 |
- |
50 |
2026 |
1400 |
|
|
100 |
- |
60 |
- |
40 |
3039 |
1500 |
|
|
50 |
- |
70 |
- |
30 |
3039 |
1750 |
|
|
50 |
- |
75 |
- |
25 |
1013 |
830 |
|
|
100 |
- |
25 |
- |
75 |
1013 |
800 |
|
|
80 |
- |
35 |
- |
65 |
4052 |
500 |
|
|
15 |
- |
45 |
- |
55 |
1013 |
375 |
|
|
15 |
- |
55 |
- |
45 |
3039 |
400 |
|
|
35 |
- |
65 |
- |
35 |
1013 |
550 |
|
|
100 |
- |
75 |
- |
25 |
1520 |
650 |
|
|
80 |
- |
15 |
- |
85 |
2026 |
480 |
|
|
15 |
- |
20 |
- |
80 |
4052 |
380 |
|
|
20 |
- |
45 |
- |
55 |
3039 |
900 |
|
|
50 |
- |
15 |
- |
85 |
1520 |
500 |
|
|
50 |
- |
25 |
- |
75 |
1520 |
500 |
|
|
15 |
- |
35 |
- |
65 |
1520 |
350 |
|
|
20 |
- |
65 |
- |
35 |
507 |
900 |
Вариант |
Номер задания |
Исследование 1 |
|||||
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk |
||||||
Компоненты |
|||||||
а |
в |
с |
d |
||||
|
|
|
|
|
|
|
|
|
7 |
|
Mn2O3 (тв) |
СО(Г) |
Mn3O4 (тв |
CO2(Г) |
950-1400 |
|
|
|
SiC (тв) |
CO2(Г) |
Si (тв) |
СО(Г) |
1350-1700 |
||
|
|
FeO (тв) |
H2(Г) |
Fe (тв) |
H2O(Г) |
300-700 |
||
|
|
Fe3O4 (тв) |
H2(Г) |
Fe (тв) |
H2O(Г) |
350-750 |
||
|
|
С(тв) |
H2O(Г) |
CO2(Г) |
H2 (Г) |
300-1200 |
||
|
|
СО(Г) |
S2(Г) |
COS (Г) |
- |
900-1800 |
||
|
|
NO2(Г) |
N2(Г) |
O2 (Г) |
- |
1100-2000 |
||
|
|
Cl2 (Г) |
H2O(Г) |
HCl (Г) |
O2 (Г) |
600-1500 |
||
|
|
H2(Г) |
S2 (Г) |
H2S(Г) |
- |
1500-2000 |
||
|
|
N2(Г) |
O2 (Г) |
NO (Г) |
- |
1600-1800 |
||
|
|
S2(Г) |
H2O(Г) |
SO2 (Г) |
H2 (Г) |
900-1800 |
||
|
|
H2(Г) |
Cl2 (Г) |
HCl (Г) |
- |
800-1500 |
||
|
|
S2(Г) |
CO2(Г) |
SO2 (Г) |
СО(Г) |
900-1800 |
||
|
|
NH2(Г) |
H2 (Г) |
NH3 (Г) |
- |
500-1400 |
||
|
|
AgCl(тв) |
H2 (Г) |
Ag (тв) |
HCl (Г) |
350-750 |
||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
300-1200 |
||
|
|
CO2(Г) |
С(тв) |
СО(Г) |
- |
300-1200 |
||
|
|
H2S(Г) |
O2 (Г) |
SO2(Г) |
H2O(Г) |
900-1800 |
||
|
|
N2O2 (Г) |
- |
NO2(Г) |
- |
900-1800 |
||
|
|
Fe2O3 (тв) |
H2) (Г) |
Fe (тв) |
H2O(Г) |
300-850 |
||
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К |
||||||
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % |
||||||||
Компоненты |
|||||||||
А |
В |
С |
D |
||||||
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
||
|
|
50 |
- |
25 |
- |
75 |
2026 |
1300 |
||
|
|
50 |
- |
15 |
- |
85 |
3039 |
1600 |
||
|
|
50 |
- |
80 |
- |
20 |
101,3 |
500 |
||
|
|
50 |
- |
60 |
- |
40 |
1013 |
700 |
||
|
|
100 |
40 |
10 |
40 |
10 |
10120 |
1000 |
||
|
|
100 |
40 |
30 |
30 |
- |
5065 |
1500 |
||
|
|
50 |
30 |
50 |
20 |
- |
10,13 |
200 |
||
|
|
100 |
50 |
30 |
10 |
10 |
2026 |
800 |
||
|
|
100 |
50 |
10 |
40 |
- |
5058 |
1400 |
||
|
|
50 |
30 |
30 |
40 |
- |
3039 |
2500 |
||
|
|
50 |
10 |
10 |
10 |
70 |
10,13 |
1700 |
||
|
|
100 |
20 |
10 |
70 |
- |
1013 |
1500 |
||
|
|
50 |
80 |
10 |
5 |
5 |
101,3 |
1800 |
||
|
|
50 |
40 |
40 |
20 |
- |
10130 |
600 |
||
|
|
100 |
- |
80 |
- |
20 |
101,30 |
400 |
||
|
|
100 |
- |
30 |
- |
70 |
1013 |
1200 |
||
|
|
100 |
80 |
- |
20 |
- |
1013 |
1000 |
||
|
|
100 |
5 |
5 |
10 |
80 |
1165 |
1800 |
||
|
|
100 |
80 |
- |
20 |
- |
10130 |
350 |
||
|
|
100 |
- |
30 |
- |
70 |
1013 |
820 |
||
ПРИЛОЖЕНИЕ З
ОБРАЗЕЦ ОФОРМЛЕНИЯ ТИТУЛЬНОГО ЛИСТА
Министерство образования и науки Российской Федерации
ФГБОУ ВПО «Магнитогорский государственный технический университет
им. Г.И.Носова»
Кафедра химической технологии неметаллических материалов и
физической химии
