
- •Тема 2 молекулярна фізика та термодинаміка
- •1. Основні означення та поняття молекулярно – кінетичної теорії.
- •2. Основні положення молекулярно – кінетичної теорії.
- •3.Тиск газу. Основне рівняння мкт газів.
- •4. Температура.
- •5. Швидкості газових молекул та їх вимірювання.
- •6. Поняття про статистичний розподіл.
- •7. Барометрична формула. Розподіл Максвела - Больцмана.
4. Температура.
Температурою називають фізичну величину, що характеризує степінь нагрітості тіла. У фізиці вона набуває більш широкого змісту.
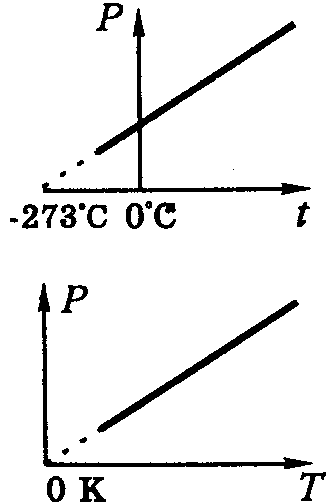 Досліди
показують, що при збільшенні температури
збільшується тиск газу, тобто
Досліди
показують, що при збільшенні температури
збільшується тиск газу, тобто
![]() (2),де
(2),де
n- концентрація молекул,
Т – температура,
k – коефіцієнт пропорційності (стала Больцмана)
Але тиск створюється газом при температурі, що дорівнює нулю. Отже для узгодження дослідних фактів та теорії введено абсолютну температуру і відповідно абсолютну температурну шкалу – шкалу Кельвіна, яка не має від’ємних температур. Початок цієї шкали називається абсолютним нулем температур і являється температурою, при якій газ не створює тиску. Порівнюючи рівняння (1) та (2), отримаємо співвідношення
![]() (3)
(3)
Отже, температура є мірою середньої кінетичної енергії молекул. Абсолютним нулем називають температуру, при якій припиняється тепловий рух молекул. Йому відповідає температура ≈ - 2730C.
З формули (3) випливає фізичний зміст сталої Больцмана: вона показує, на скільки змінюється енергія теплового поступального руху однієї молекули при зміні температури на 1 К.
![]()
5. Швидкості газових молекул та їх вимірювання.
Швидкості руху газових молекул внаслідок їх хаотичного руху відрізняються як величиною, так і напрямами. У молекулярній фізиці виділяють поняття середньої <V>, середньої квадратичної <Vкв> та найбільш ймовірної (Vн) швидкостей .
Середня (або
середня арифметична) швидкість
![]()
Середня квадратична швидкість
![]()
Середню квадратичну швидкість називають також тепловою.
Експериментальне визначення швидкостей газових молекул проведене у 1920р. німецьким фізиком О.Штерном.
Схема досдіду Штерна:
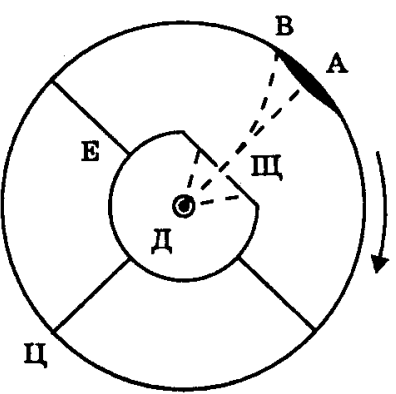 Атоми
Ag
("срібний
газ") з поверхні розжареної
дротини Д через щілину Щ летять до
внутрішньої поверхні циліндра Ц. Цей
циліндр разом з внутрішнім циліндром
Е (екран)
обертається з деякою кутовою швидкістю
ω.
За час пробігу
атомів від щілини циліндр Ц прокручується,
тому на ньому осаджується шар срібла
змінної товщини з максимумом посередині.
Швидкість молекул, потрапивших у
деяку точку В:
Атоми
Ag
("срібний
газ") з поверхні розжареної
дротини Д через щілину Щ летять до
внутрішньої поверхні циліндра Ц. Цей
циліндр разом з внутрішнім циліндром
Е (екран)
обертається з деякою кутовою швидкістю
ω.
За час пробігу
атомів від щілини циліндр Ц прокручується,
тому на ньому осаджується шар срібла
змінної товщини з максимумом посередині.
Швидкість молекул, потрапивших у
деяку точку В:
![]()
ω – кутова швидкість циліндрів,
R,r – радіуси великого та малого циліндрів відповідно,
ΔS – зміщення смуг атомів срібла.
Дослід підтвердив,
що
![]()
В досліді Штерна отримано розмитий шар з максимумом у середній частині. Це свідчить про те, що атоми срібла мали різні швидкості. Наявність максимуму говорить про те, що найбільше атомів мають швидкість, яку називають найбільш ймовірною.
6. Поняття про статистичний розподіл.
В ідеальному газі встановлюється розподіл молекул за швидкостями, який не змінюється з часом. Визначення характеру розподілу – задача статистичної фізики. Вона формулюється таким чином: скільки з усіх наявних молекул мають швидкості, значення яких лежать у певному інтервалі швидкостей в околі даної швидкості?
Ймовірність
віднайти молекули, що задовольняють
умові, є деякою функцією
![]() ,
яку називають функцією розподілу молекул
за швидкостями, або густиною ймовірного
розподілу швидкостей. Ймовірність того,
що молекула рухається є подія достовірна,
тобто
,
яку називають функцією розподілу молекул
за швидкостями, або густиною ймовірного
розподілу швидкостей. Ймовірність того,
що молекула рухається є подія достовірна,
тобто
![]()
 У
1859р. Д. Максвелл вперше встановив закон
розподілу молекул ідеального газу за
швидкостями для макроскопічної фізичної
системи, яка знаходиться в статистичній
рівновазі без врахування дії зовнішніх
потенціальних полів. Зовнішній вигляд
кривої Максвела співпадає з результатами
Штерна:
У
1859р. Д. Максвелл вперше встановив закон
розподілу молекул ідеального газу за
швидкостями для макроскопічної фізичної
системи, яка знаходиться в статистичній
рівновазі без врахування дії зовнішніх
потенціальних полів. Зовнішній вигляд
кривої Максвела співпадає з результатами
Штерна:
Розподіл Максвела виражений співвідношеннями:
![]()
![]()
N- загальна кількість молекул,
m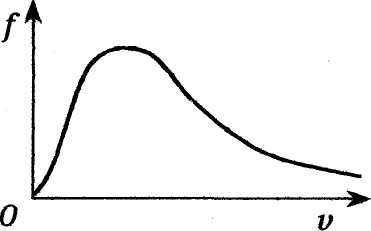 – маса молекули,
– маса молекули,
![]() - відносна швидкість,
- відносна швидкість,
що дорівнює відношенню швидкості
до найбільш ймовірної швидкості.
Розподіл молекул за імпульсами:
![]()
Розподіл молекул за енергіями:
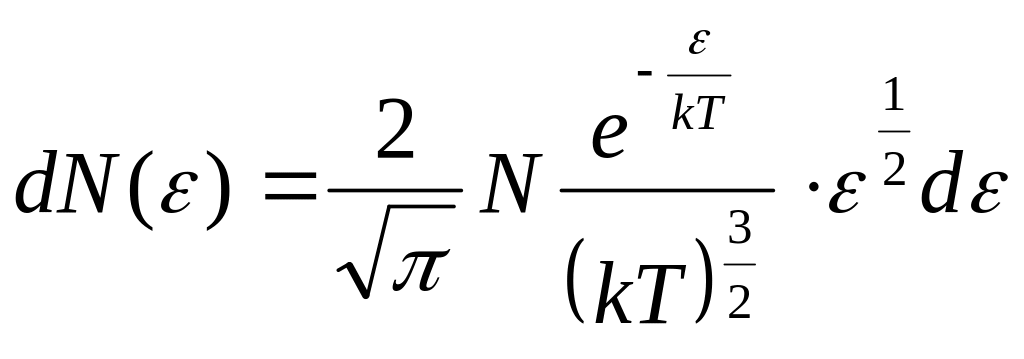
Аналіз результатів показує, що в газі немає нерухомих молекул. Дослідження на максимум дає значення найбільш ймовірної швидкості:
![]()
Розподіл вказує,
що в газі найбільша частина молекул
рухається зі швидкостями, близькими до
Vн
. Відносне
число молекул
![]() ,
швидкості яких лежать у вказаному
інтервалі, виражається площею криволінійної
трапеції. Отже, їх кількість залежить
від обраного інтервалу.
,
швидкості яких лежать у вказаному
інтервалі, виражається площею криволінійної
трапеції. Отже, їх кількість залежить
від обраного інтервалу.
