
- •Лабораторная работа определение хлористого натрия в колбасных изделиях
- •Лабораторная работа
- •Рефрактометрические измерения. Правила работы с рефрактометром.
- •Лабораторная работа определение концентрации глюкозы в водных растворах.
- •Лабораторная работа определение массовой процентной доли ионов железа в железо-аммонийных квасцах методом фотоколориметрии
- •Лабораторная работа определение содержания соли (CuSo4, NiSo4, kCl, NaCl) в растворе с применением катионита
Лабораторная работа определение содержания соли (CuSo4, NiSo4, kCl, NaCl) в растворе с применением катионита
Определение основано на том, что при пропускании раствора соли через колонку с катионитом в Н-форме катионы соли обмениваются на ионы водорода, при этом выделяется кислота в количестве, эквивалентном содержанию соли в растворе. Количество выделившейся кислоты определяют титрованием щелочи.
Процесс катионного обмена можно представить следующим уравнением:
2R-H + CuSO4 → R2-Cu + H2SO4
В большинстве случаев ионный обмен проводят в водной среде, при этом можно определить содержание в растворе любой соли, если соль и соответствующая кислота хорошо растворимы в воде.
Для определения гидролизующихся солей применяют ионный обмен в неводных средах. В качестве сильнокислотных катионитов в этом случае можно использовать катиониты марки СДВ-3, КУ-2 и др. в Н-форме.
Методика определения. Отбирают пипеткой 10 мл анализируемого (~0,1н) раствора соли из мерной колбы и помещают в колонку (диаметр 20 мм, высота 300 мм), содержащую 15 г сильнокислотного катионита в Н-форме. Раствор пропускают через катионит со скоростью 10 мл/мин (примерно 2 капли в 1 с). Вытекающий из колонки раствор собирают в коническую колбу емкостью 300 мл. Затем через катионит пропускают 60 – 100 мл дистиллированной воды, наливая, её из промывалки отдельными порциями по 10 – 15 мл. Новую порцию воды наливают тогда, когда уровень жидкости в колонке достигнет поверхности катионита.
Полноту вымывания выделившейся кислоты проверяют по метиловому оранжевому; для этого отбирают на часовое стекло каплю вытекающего из колонки раствора и прибавляют индикатор. Если при этом окраска раствора станет желтой, то считают, что кислота полностью вымыта из катионита. Промывные воды тщательно собирают в ту же коническую колбу. Всё содержимое конической колбы оттитровывают стандартным 0,1 н раствором NaOH в присутствии метилового оранжевого. Определение проводят 2 – 3 раза, пропуская раствор соли через ту же колонку.
Расчет. Содержание соли (m) вычисляют (в мг) по формуле:
m = MЭсолиVNaOH CNaOH(VK/VA)
где VK – общий объем исследуемого раствора,мл;
VA – объем анализируемого раствора,мл
После окончания определения катионит регенерируют, т.е. снова переводят в Н-форму. Для этого через колонку с катионитом пропускают 200 мл 2 н раствора HCl для извлечения поглощенных катионитов, затем отмывают катионит от кислоты дистиллированной водой и до следующего определения катионит сохраняют в колонке, заполненной водой.
ЛАБОРАТОРНАЯ РАБОТА
ОПРЕДЕЛЕНИЕ ХЛОРОВОДОРОДНОЙ И УКСУСНОЙ КИСЛОТ
МЕТОДОМ КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
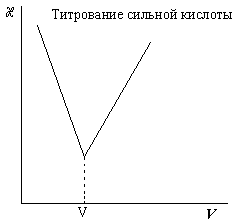
Краткое теоретическое вступление: Определение основано на последовательном взаимодействии с раствором сильного основания NaOH кислот, отличающихся друг от друга степенью ионизации. В первую очередь взаимодействует сильная кислота, что вызывает резкое понижение электролитической проводимости раствора вследствие связывания высокоподвижных ионов водорода: Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
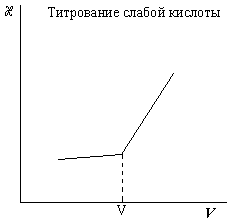
При титровании слабой кислоты проводимость обычно возрастает, так как вместо слабого электролита образуется хорошо диссоциирующая соль: Na+ + OH- + СН3СООН = Na+ СН3СОО- + H2O.
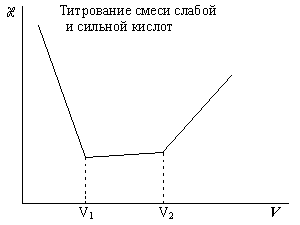
И, наконец, после точки эквивалентности проводимость резко возрастает благодаря появлению в растворе гидроксильных ионов, обладающих высокой подвижностью. V1 – объем щелочи, пошедший на титрование соляной кислоты; V2 – объем щелочи, пошедший на титрование суммы соляной и уксусной кислот.
Цель работы: ознакомление с принципом работы кондуктометра;
определение содержания в исследуемом растворе уксусной и хлороводородной кислот
Ход выполнения:
1. Стандартизация раствора NaOH по HCl. В стакан помещают 10 мл стандартного раствора соляной кислоты, добавляют дистиллированную воду до полного погружения ячейки (электродное отверстие должно быть полностью погружено в раствор); включают магнитную мешалку. При титровании приливают раствор NaOH порциями по 0,5 мл и каждый раз записывают значение удельной электропроводности и объем титранта, пока не обнаружат точку эквивалентности (излом на кривой титрования), соответствующую данной реакции. После этого снимают показания еще в 4 – 5 точках. По полученным данным строят кривую титрования в координатах удельной электропроводности – объем титранта, мл. Находят объем титранта в точке эквивалентности, Vэкв, и рассчитывают концентрацию раствора NaOH.
2. Анализ исследуемого раствора. Исследуемый раствор, содержащий смесь HCl и СН3СООН, доводят до метки, отбирают 10 мл, полученного раствора и переносят в стакан, добавляют воду до полного погружения ячейки и включают мешалку. Титруют раствором NaOH, приливая его порциями по 0,5 мл и в каждой точке записывая сопротивление раствора. Титрование прекращают после того, как будут обнаружены два излома на кривой титрования. Строят кривую титрования, по которым находят V1 и V2.
Обработка результатов:
Таблица 1. Значения удельной электропроводности при стандартизации гидроксида натрия
Объем NaOH, V, мл |
Показание прибора, χ |
0 |
|
0,5 |
|
... |
|
![]()
Таблица 2. Значения удельной электропроводности при титровании смеси кислот
Объем NaOH, V, мл |
Показание прибора, χ |
0 |
|
0.5 |
|
… |
|
![]()
![]()
Выводы:
