
Диаграмма состояния системы жидкость – твёрдое вещество
Диаграмма состояния системы жидкость – твёрдое вещество.
В зависимости от взаимной растворимости в жидкой и твердой фазе и способности образовывать друг с другом соединение с различной степенью устойчивости для пары веществ (назовем их условно А и В) возможно существование большого числа фазовых диаграмм.
Фазовые диаграммы, как правило, строят в координатах: температура системы - ее общий состав, выражаемый обычно в мольных долях или мольных процентах. Поля на диаграммах, ограниченные линиями, характеризующими условия равновесного сосуществования двух фаз (зависимость температуры от состава или, наоборот, состава от температуры, при которой в системе имеется две фазы).
Любая точка на фазовой диаграмме должна соответствовать правилу фаз Гиббса:
![]() (1)
(1)
где f - число степеней свободы, т. е. число независимо изменяемых величин (внешних параметров, концентраций), при котором в равновесии находится число фаз, равное Ф;
К - число компонентов в системе;
r - число варьируемых внешних параметров (температура, давление).
При построении обычной плоской диаграммы в координатах (температура, состав) давление постоянно, следовательно r = 1.
В этих условиях для бинарной системы, т.е. системы, содержащей два компонента (К = 2), максимальное число равновесных фаз равно 3 при числе степеней свободы 0.
Система, у которой число степеней свободы равно 0, называется нонвариантной, и характеризуется на плоской диаграмме точкой, в которой сходятся три линии, определяющие условия равновесия одной пары фаз.
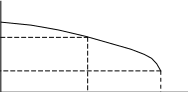
Рассмотрим принципы построения плоской диаграммы бинарной системы, в которой вещества А и В практически не образуют твердые растворы, но неограниченно растворимы друг в друге в жидком состоянии. При охлаждении такой системы, взятой в жидком состоянии, в твердом состоянии обычно выделяется одно из веществ в чистом виде (его принято называть растворителем). Условия выделения кристаллов твердого вещества рассматриваются в описании работы "Криометрия". Отметим, что температура начала кристаллизации снижается с уменьшением концентрации растворителя и увеличением концентрации растворенного вещества. На рис.1 показано влияние концентрации на температуру начала кристаллизации.
Подобный характер имеет зависимость температуры кристаллизации от концентрации, если в качестве растворителя рассматривается вещество В, т.е. в области, начинающейся от ХA = 1 (ХB 0).
В точке "а" (рис.1) система представляет собой раствор вещества В в А и, согласно правилу фаз Гиббса, имеет две степени свободы.
 a
a
T ↓
b
T1
T2 l d k c
..
X1 X2
 1
X(A)
1
X(A)
0 X(B)
Рис.1. Зависимость температуры начала кристаллизации от концентрации для бинарной системы.
ХA и ХB - массовые доли растворителя и растворенного вещества.
Действительно, К = 2 (бинарная система), Ф = 1 (гомогенная система), r = 1 ( см. выше).
Следовательно, вблизи точки "а" можно одновременно изменять
два параметра (температуру и состав системы), оставаясь в однофазной области.
Отметим, что система, имеющая две степени свободы, называется бивариантной.
Если систему, взятую в точке "а", охладить, то при температуре Т1 (ей соответствует точка "b" на кривой) появляется первый мелкий кристалл вещества А. При дальнейшем понижении температуры масса выделяющейся твердой фазы (вещество А) увеличивается, что приводит к повышению концентрации растворенного вещества. Меньшей температуре Т2 соответствует большая равновесная концентрация вещества В (точка "с").
Обратим внимание на то, что в точках "а" и "d" общий (валовый) состав системы одинаков. Однако в точке "а" содержится лишь одна фаза, у которой концентрация растворителя равна Х1, а в точке "d" существует две фазы: твердая - вещество А и жидкая с концентрацией вещества А, равной Х2. Если массы твердой и жидкой фаз соответственно равны mтв и mж, то масса вещества А в системе в точке "d" равна (с учетом того, что концентрация твердого вещества равна 1)
![]()
Для точки "а" имеем:
![]()
т.к. mтв + mж соответствует массе единственного раствора в точке "а".
Отсюда:
![]()
 (2)
(2)
Отношение (2) иллюстрирует так называемое "правило рычага", согласно которому отношение масс твердой и жидкой фаз обратно пропорционально отношению длин отрезков k и l, соединяющих выделенную точку "d" с линиями, характеризующими состав жидкой и твердой фаз.
В точке "d" система имеет одну степень свободы, так как r=1, К=2 и Ф=2 (раствор и твердая фаза). Это означает, что состав жидкой фазы является функцией температуры. Любое смещение от точки "d" влево или вправо не влияет на состав фаз.
Выше отмечалось, что зависимости равновесных концентраций кристаллизующихся растворов от температуры для обоих веществ, рассматриваемых как растворители, принципиально не отличаются. Таким образом, можно получить подобную правую часть диаграммы. Это дает возможность построить полную диаграмму рассматриваемой бинарной системы (рис.2). Диаграмма имеет 4 основных поля. Поле 1 отвечает однофазной области жидких растворов. Поле 2 - гетерогенной системе: кристаллы А + раствор В в А.
T

T1 1
T’1
2 Э 3
4
 1
XA
0
1
XA
0
0 XB 1
Рис.2. Плоская диаграмма бинарной системы для веществ, неограниченно растворимых в жидком состоянии и нерастворимых в твердом.
Поле 3 - гетерогенной системе: твердое В + раствор А в В, поле 4 - гетерогенной системе: твердое А + твердое В.
В точке пересечения двух линий, отражающих условия равновесия раствора с твердым веществом, выделяются одновременно кристаллы обоих веществ. В точке "Э" существуют одновременно три фазы: кристаллы А, кристаллы В и последняя порция раствора. Следовательно, в точке "Э" система нонвариантна. Точка "Э" называется точкой эвтектики, а отвечающий ей состав системы - эвтектической смесью.
Ниже точки эвтектики в системе не может быть жидкой фазы. Поэтому через эвтектическую точку проводят горизонтальную линию, ниже которой находятся только твердые фазы. Эта линия называется линией солидуса.
Рассмотрим теперь систему, в которой вещества А и В могут образовывать химическое соединение, плавящееся без разложения, неограниченно растворимое в обоих веществах в жидком состоянии и нерастворимое в твердом состоянии.
В этом случае можно построить две диаграммы по типу рис. 1. Одна диаграмма должна описывать систему, содержащую вещество А и химическое соединение, а другая - вещество В и химическое соединение. Обычно отдельные диаграммы не строят, а приводят общую.
На рис.3 приведена диаграмма для веществ, образующих термически устойчивое химическое соединение.
 T
T
1 2
3 4
5 6
7
8

 1
XA
0
1
XA
0
Рис.3. Диаграмма бинарной системы для случая образования
устойчивого химического соединения.
На такой диаграмме различают 8 полей:
1 - растворы А и соединения;
2 - растворы В и соединения;
3 - твердое А + раствор А и соединения;
4 - твердое соединение + его раствор с А;
5 - твердое соединение + его раствор с В;
6 - твердое В + его раствор с соединением;
7 - твердые А и соединение;
8 - твердые В и соединение.
Необходимо уметь использовать информацию, содержащуюся в диаграмме. Для этого по каждой точке диаграммы, характеризующей общий состав системы, надо ответить на следующие вопросы:
1. Сколько компонентов? Какие? Сколько фаз? Какие? Общий
состав? Состав каждой фазы?
2. Количественные (массовые) соотношения каждой фазы (правило рычага)?
3. Какова растворимость компонентов в твердом и жидком состоянии для данной температуры?
4. Какие физико-химические изменения претерпевает система, если "двигаться" на диаграмме по определенному маршруту?
5. Сколько степеней свободы в данной фигуративной точке?
Например (рис.4): для точки "b" - компонентов - 1, чистый компонент В, фаза - 1, жидкая; для точки "d" - компонентов 2: А и В, фаза - 1, жидкая, общий состав равен составу фазы, равен х0 % - В и (100– х0)% - А. Для точки "с" - компонентов 2: А и В, фаз – 2: жидкая состава х1 и твердая 100% А, общий состав – х0. Отношение количества твёрдой фазы к количеству жидкой определяется по формуле:

Растворимость В в А при температуре t "k" - х1 %. Число степеней свободы - 1.

d
tA
te a e L
tk k c n tB
m
A + L
B + L
tЭ g e tЭ
A + B
A x0 x1 x2 x3 B
