
- •Органика
- •Теория химического строения органических соединений Бутлерова. Ее современная трактовка. Виды и природа химических связей. Взаимное влияние атомов в молекуле и его приода.
- •Алканы. Строение, изомерия, номенклатура, физ. Свойства. Способы и источники получения алканов. Химические свойства алканов.
- •Полимеризация алкенов. Виды и механизмы цепной полимеризации. Полиэтилен. Полипропилен. Стереорегулярные полимеры.
- •Алкины. Строения, изомерия, номенклатура, способы получения, физические свойства. Промышленное получение ацетилена. Химический свойства алкинов. Реакции присоединения, их промышленное значение.
- •Алкадиены. Изомерия, номенклатура, получение, физические свойства. Сопряженные диены. Свойства сопряженных π-связей.
- •Химические свойства сопряженных диенов. Реакции присоединения. Полимеризация и сополимеризация. Натуральный и синтетический каучук.
- •Арены для бензола. Изомерия, номенклатура, природные источники и методы получения. Физические свойства и строение. Химические свойства аренов. Правила замещения в бензольном ядре.
- •Галогенпроизводные углеводородов. Химические свойства галогеналканов. Реакции замещения и отщепления. Правило Зайцева.
- •Полигалогеналканы. Получение, номенклатура. Физические и химические свойства. Области применения.
- •Галогеналкены. Получение, номенклатура. Физические и химические свойства. Поливинилхлорид, фторопласт.
- •Галогенарены. Получение, номенклатура. Физические и химические свойства.
- •Многоатомные спирты. Гликоли. Классификация, номенклатура, свойства. Получение и применение этиленгликоля и глицерина.
- •Фенолы. Изомерия, номенклатура, методы получения. Физические и химические свойства. Полифенолформальдегидные пластмассы.
- •Альдегиды и кетоны. Классификация, изомерия, номенклатура, способы получения. Химические свойства карбонильных соеднинений.
- •Монокарбоновые кислоты. Классификация и номенклатура. Промышленные и лабораторные методы получения. Физический свойства и строение. Водородная связь.
- •Непредельные кислоты. Способы получения, свойства. Акриловая и метакриловая кислоты, полимеры на их основе.
Органика
Теория химического строения органических соединений Бутлерова. Ее современная трактовка. Виды и природа химических связей. Взаимное влияние атомов в молекуле и его приода.
Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле
… химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением
Алканы. Строение, изомерия, номенклатура, физ. Свойства. Способы и источники получения алканов. Химические свойства алканов.
Алка́ны (парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2. Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура
Рациональная
Выбирается
один из атомов углеродной цепи, он
считается замещённым метаном и
относительно него строится название
алкил1алкил2алкил3алкил4метан, например:
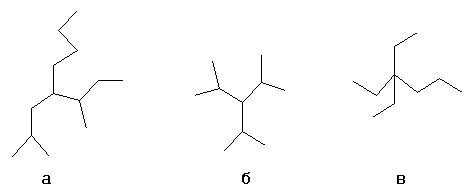
а- н-бутил-втор-бутил-изобутилметан
б- триизопропилметан
в- триэтил-изопропилметан
Систематическая ИЮПАК
По
номенклатуре ИЮПАК названия алканов
образуются при помощи суффикса -ан путём
добавления к соответствующему корню
от названия углеводорода. Выбирается
наиболее длинная неразветвлённая
углеводородная цепь так, чтобы у
наибольшего числа заместителей был
минимальный номер в цепи. В названии
соединения цифрой указывают номер
углеродного атома, при котором находится
замещающий радикал, затем название
радикала и название главной цепи. Если
радикалы повторяются, то перечисляют
цифры, указывающие их положение, а число
одинаковых радикалов указывают
приставками ди-, три-, тетра-. Если радикалы
не одинаковые, то их названия перечисляются
в алфавитном порядке. Например:
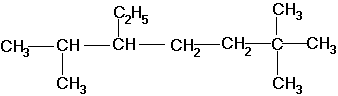
2,2,6-триметил-5-этилгептан
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физические свойства
Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан - газ.
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление карбонильных соединений
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты - RCOO- перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируеться. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO- - 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идет в ТГФ при температуре -80°С.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода, имеющего состав CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем.
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500°С алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930-1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название „термический крекинг“. С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах - 400-450°С и низком давлении - 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Алкены. Изомерия, номенклатура, методы получения, физический свойства. Строения
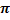 -связи.
Реакции присоединения по двойной связи.
Правило Морковникова. Переоксидный
эффект. Реакция окисления алкенов.
-связи.
Реакции присоединения по двойной связи.
Правило Морковникова. Переоксидный
эффект. Реакция окисления алкенов.
Алкены (иначе олефины или этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Простейшим алкеном является этен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Для алкенов, начиная с С4Н8, наряду с изомерией углеродного скелета и разл. положения двойной связи, возможна геом. (цис-, транс-)изомерия, обусловленная большим барьером вращения вокруг двойной связи.
Методы получения
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти: t
С8Н18 → С4Н10 + С4Н8
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов - дегидрирование алканов: t, Cr2O3
СН3-СН2-СН3 → СН3-СН=СН2 + Н2
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С: H2SO4
СН3-СН2-ОН → СН2=СН2 + Н2О
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды: С2Н6ОН
СН3-СН2-СНВr-СН3 + КОН → СН3-СН=СН-СН3 + КВr + Н2О
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
CH2Br-CHBr-CH3 + Mg → СН2=СН-СН3 + MgВr2.
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Строение π-связи
По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей.
В молекуле пропилена СН2=СН–СН3 в одной плоскости лежат 6 атомов: два sp2-атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т.к. этот атом углерода sp3-гибридизован.
Алкены
- высокореакционноспособные соединения.
Наиб. характерны для них р-ции электроф.
присоединения по двойной связи,
протекающие, как правило, по бимолекулярному
механизму через стадию образования
карбкатиона или мос-тикового иона:

МАРКОВНИКОВА
ПРАВИЛО: при присоединении протонных
к-т или воды к несимметричным алкенам
или алкинам атом водорода присоединяется
к наиб. гидрогенизир. атому углерода,
напр.:
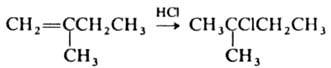
В
случае алкенов с неконцевой двойной
связью ориентация присоединения менее
выражена (см. Зайцева-Вагнера правило).
М. п., первоначально сформулированное
для предсказания региоселективности
присоединения протонных к-т и воды, было
затем распространено и на р-ции
присоединения любых полярных молекул.
При гетеролитич. присоединении таких
молекул более электроотрицат. атом или
часть молекулы реагента присоединяется
к атому углерода с наименьшим числом
атомов водорода, напр.:
![]()
Электронная интерпретация М. п. предполагает, что более электроположит. часть полярной молекулы присоединяется к кратной связи таким образом, чтобы образовался более устойчивый карбениевый ион (независимо от того, образуется или нет в действительности такой ион как промежут. продукт р-ции присоединения). Анализ распределения электронной плотности в молекуле алкена (рассмотрение индуктивного и мезомерного эффекта) не всегда позволяет однозначно предсказать ориентацию присоединения. Привлекаемые иногда для этого представления о сверхсопряжении также не дают приемлемого объяснения. Ориентация по М.п. обусловлена меньшей энергией активации процесса по сравнению с присоединением против М.п. В газовой фазе для нек-рых р-ций такое различие достигает 25-30 кДж/моль. Оценку этой величины можно провести путем анализа модели переходного состояния (см. Активированного комплекса теория). При наличии заместителей, проявляющих значит. электроноакцепторный эффект, напр. при присоединении галогеноводородов или воды к соед. типа СН2=СНХ (X-CN, СООН, CF3), р-ция идет против М.п. Присоединение против М.п. наблюдается также при свободнорадикальном присоединении. Правило сформулировано В. В. Марковниковым в 1869.
1.
Мягкое окисление алкенов водным раствором
перманганата калия приводит к образованию
двухатомных спиртов (реакция Вагнера):
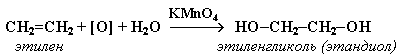
Полное
уравнение реакции:
![]()
(см. схему электронного баланса этой реакции).
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
2.
При жестком окислении алкенов кипящим
раствором KMnO4 в кислой среде происходит
полный разрыв двойной связи:

3.
Промышленное значение имеет частичное
окисление алкенов с образованием
циклических оксидов, которые широко
используются в органическом синтезе:

4.Полное окисление (горение):
![]()
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
