
Лекция 5
Растворы электролитов
Для реакций, не сопровождающихся переносом электронов, нет общепринятого термина. К наиболее широкой группе таких реакций относятся реакции ионного обмена в водных растворах. В подавляющей своей части эти реакции обратимы и протекают при посредничестве воды. Электролит (вещество, распадающееся в растворах или расплавах на ионы) при растворении в воде нередко реагирует с ней, приводя к изменению ее кислотности.
Согласно
протонной
теории
кислот и оснований, выдвинутой
Й.Н.Бренстедом и Т.М.Лоури, кислотой
является соединение, отщепляющее в
реакции протоны, а основанием
– соединение, способное принимать
протоны.
Любая реакция отщепления протона
выражается уравнением: кислота
![]() основание
+ Н+.
основание
+ Н+.
![]() Пользуясь данными определениями, по
внешнему виду формулы молекулы ее можно
отнести либо к кислотам, либо к основаниям.
Недостаток такого подхода состоит в
том, что имеются вещества, в которых нет
гидроксильных групп, но в растворах они
дают основную среду (NH3).
Не всегда по формуле соединения удается
определить – кислота это или основание.
Например, формулу борной кислоты
записывают двумя способами: Н3BO3
и B(OH)3.
Пользуясь данными определениями, по
внешнему виду формулы молекулы ее можно
отнести либо к кислотам, либо к основаниям.
Недостаток такого подхода состоит в
том, что имеются вещества, в которых нет
гидроксильных групп, но в растворах они
дают основную среду (NH3).
Не всегда по формуле соединения удается
определить – кислота это или основание.
Например, формулу борной кислоты
записывают двумя способами: Н3BO3
и B(OH)3.
C точки зрения химического строения нет принципиального различия между кислородсодержащими кислотами и основаниями – все эти соединения вполне обоснованно можно назвать гидроксидами. И в тех, и в других существует один и тот же порядок связей: водород–кислород–элемент. Отличие состоит в том, что одни в водных растворах отщепляют протон Н+, а другие – гидроксид-ион НО–. Ответ на вопрос, почему возникают такие различия, дает анализ электроотрицательностей атомов, образующих соединения.
На самом деле свободные протоны не могут существовать в растворе несвязанными и переходят от кислоты к основанию, образуя сопряженное основание и сопряженную кислоту. Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.

Например:

![]()
Уксусная кислота, отдав протон, превращается в основание (получившее название «сопряженное»). Аммиак, приняв протон, из основания превращается в сопряженную кислоту. Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Наиболее общей считается теория кислот и оснований Г.Н.Льюиса, который допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно Льюису, кислотой является соединение, принимающее электронную пару, а основанием – предоставляющее электронную пару. Так в реакции AlF3 + :NH3 = F3Al:NH3 атом алюминия принимает неподеленную электронную пару атома азота на свою вакантную электронную орбиталь. При взаимодействии донора электронной пары :NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи. Ни кислота, ни основание протонов не содержат.
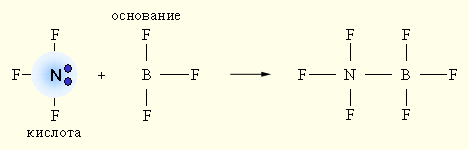
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
Вода, являясь слабым электролитом и обычным растворителем, участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
![]()
ее константа при 298 K равна

При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
![]()
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
![]()
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство
[H+]
и [OH–]
соответствует нейтральной среде
[H+] = [OH–] = 1 ∙ 10–7,
при [H+] > 1 ∙ 10–7
– кислой, при [H+] < 1 ∙ 10–7
– щелочной.
![]() Для
определения кислотно-основных свойств
раствора пользуются водородным
показателем pH.
По определению, это
отрицательный десятичный логарифм
концентрации водородных ионов: pH = –lg
[H+].
Очевидно, –lg [H+][OH–]
= –lg 1 ∙ 10–14
дает pH + pOH = 14. Тогда pH < 7 указывает
на кислую среду, pH > 7 соответствует
щелочной среде, pH = 7 – нейтральной
среде.
Для
определения кислотно-основных свойств
раствора пользуются водородным
показателем pH.
По определению, это
отрицательный десятичный логарифм
концентрации водородных ионов: pH = –lg
[H+].
Очевидно, –lg [H+][OH–]
= –lg 1 ∙ 10–14
дает pH + pOH = 14. Тогда pH < 7 указывает
на кислую среду, pH > 7 соответствует
щелочной среде, pH = 7 – нейтральной
среде.
Например, если точно известно, какое количество гидроксида натрия (в граммах или моль) израсходовано в реакции с соляной кислотой, то по уравнению реакции NaOH + HCl = NaCl + H2O легко рассчитать, сколько граммов (или моль) хлороводорода было в анализируемом растворе. Подобные расчеты можно проводить только для стехиометрических реакций (stoicheion – основание, элемент и metreo – измеряю), что означает измерение соотношений, в которых химические элементы реагируют друг с другом. А проделываются подобные измерения методом титрования (от франц. titre – качество, характеристика) – одим из методов количественного анализа, основанным на измерении количества реагента, который полностью реагирует с анализируемым веществом (см. лаб. работу).
Растворы сильных электролитов
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено в сторону прямой реакции:
![]()
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
При движении катиона в электростатическом поле его ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначиным и должно заменяться активностью. Для бинарного одно-однозарядного электролита KatAn → Kat+ + An+ активности катиона (a+) и аниона (a–) соответственно равны
![]()
где C+ и C– – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:
![]()
![]()
Коэффициент активности по Дебаю–Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе. Для данного электролита ионная сила выражается уравнением Дебая–Хюккеля:
![]()
Ионная сила в свою очередь равна
![]()
Здесь C – аналитическая концентрация, z – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
Растворы слабых электролитов
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя. Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией. Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
![]()
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит. Важной характеристикой электролитов служит степень диссоциации α:
![]()
По величине степени
диссоциации электролиты делятся на
слабые и сильные. Для сильных электролитов,
к которым относятся некоторые минеральные
кислоты и щелочи, большинство солей,
α > 30 %. Для слабых электролитов
устанавливается равновесие
между недиссоциированными молекулами
и ионами. К слабым электролитам относятся
плохо растворимые соли (см. таблицу
растворимости), вода, большинство
органических кислот (например, уксусная
CH3COOH,
муравьиная HCOOH),
а также неорганические соединения
(H2CO3Угольная
кислота.,
H2SСероводородная
кислота.,
HCNЦиановодородная
(синильная) кислота.,
H2SiO3Метакремниевая
кислота.,
H2SO3Сернистая
кислота.,
HNO2Азотистая
кислота.,
HClOХлорноватистая
кислота.,
HCNOЦиановая
кислота.,
NH4OHГидроксид
аммония.,
большинство оснований). Важнейшей
характеристикой слабого электролита
служит константа
диссоциации.
Рассмотрим равновесную реакцию
диссоциации слабого электролита HAn:
![]() Константа равновесия Kр
этой реакции и есть Kд:
Константа равновесия Kр
этой реакции и есть Kд:
![]()
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим

Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
![]() Тогда
Тогда
![]()
