
Задача №1. Взаимодействие углерода с кислородосодержащей газовой фазой.
Рассчитайте значения равновесного давления кислорода и кислородных потенциалов в равновесной газовой смеси, образующейся при взаимодействии обогащённого кислородом воздуха (N2 – O2) с твердым углеродом для шести заданных температур.
Исходные данные для расчёта:
состав обогащенного воздуха, % |
Температура, 0С |
Давление, Па·10-5 |
||||||
N2 |
O2 |
1 |
2 |
3 |
4 |
5 |
6 |
|
58 |
42 |
732 |
782 |
832 |
882 |
932 |
982 |
0,9 |
Решение:
Для определения равновесного состава газовой смеси, находим соотношение между азотом и кислородом в обогащенном воздухе:
γ=![]() 1,381
1,381
2С + О2 = 2СО (1)
С + О2 = СО2 (2)
С+СО2=2СО (3)
Константа
равновесия для реакции (1) равна:
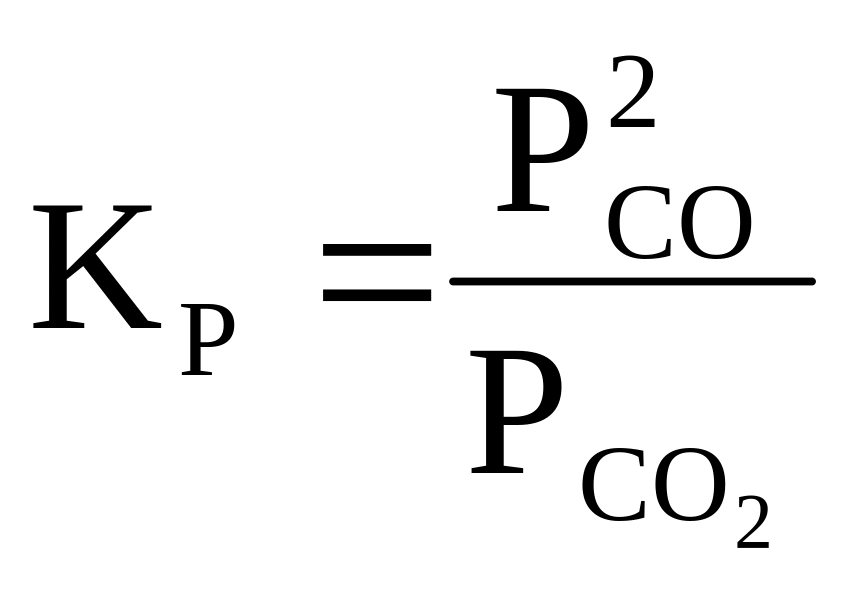
Пользуясь
уравнением
![]() находим значение
находим значение
![]() для шести заданных температур:
для шести заданных температур:
T,К |
1005 |
1055 |
1105 |
1155 |
1205 |
1255 |
|
2,108 |
5,601 |
13,624 |
30,685 |
64,609 |
128,2001 |
Находим равновесный состав газовой смеси:
СО,%= (4)
(4)
где
![]() - количество молей N2
вносимых в смесь одним молем О2;
- количество молей N2
вносимых в смесь одним молем О2;
![]() -
константа равновесия реакции (1);
-
константа равновесия реакции (1);
Р – общее давление в газовой смеси
СО2,%
=![]() (5)
(5)
N2,%=100-(СО,%+СО2,%) (6)
![]() (7)
(7)
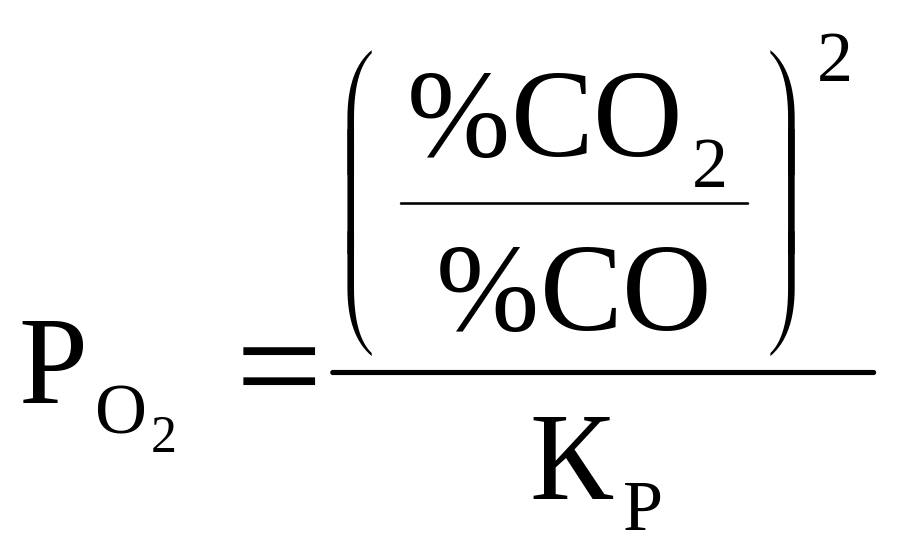 (8)
(8)
![]() (9)
(9)
Результаты расчётов сведены в таблицу 1.
Таблица 1
№№ п.п. |
t,0С |
Т, К |
состав равновесной газовой смеси, % |
относительное содержание, % |
|
lg |
Дж |
|||
СО |
СО2 |
N2 |
СО |
СО2 |
||||||
1 |
732 |
1005 |
46,275 |
9,145 |
44,580 |
83,500 |
16,500 |
2,15·10-22 |
-21,67 |
-417112 |
2 |
782 |
1055 |
52,837 |
4,486 |
42,677 |
92,174
|
7,826
|
9,85·10-22 |
-21,01 |
-424516 |
3 |
832 |
1105 |
56,215 |
2,088 |
41,697 |
96,419
|
3,5801
|
3,49·10-21 |
-20,46 |
-432998 |
4 |
882 |
1155 |
57,776 |
0,979 |
41,245 |
98,334
|
1,666
|
1,05·10-20 |
-19,98 |
-442041 |
5 |
932 |
1205 |
58,484 |
0,476 |
41,040 |
99,192
|
0,808
|
2,79·10-20 |
-19,55 |
-451344 |
6 |
982 |
1255 |
58,813 |
0,243 |
40,944 |
99,589
|
0,411 |
6,81·10-20 |
-19,17 |
-460763 |
По данным таблицы 1 строим график зависимости состава равновесной газовой смеси для реакции газификации углерода от температуры.
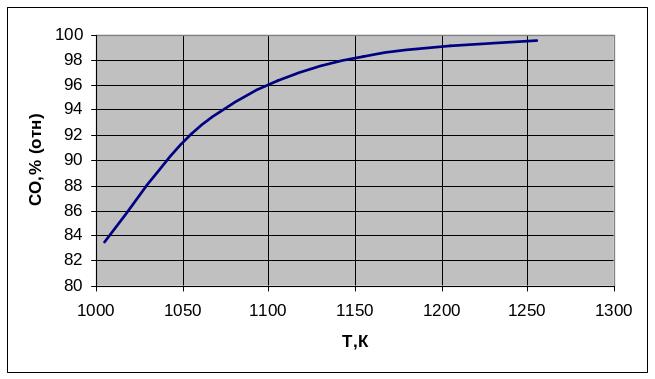
Рисунок 1 – график зависимости состава равновесной
газовой смеси углерода от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры концентрация СО увеличивается.
Строим график зависимости равновесного давления кислорода в газовой смеси для реакции газификации углерода от температуры.

Рисунок 2 – график зависимости равновесного давления от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры давление над кислородом в газовой реакции газификации углерода увеличивается.
Строим график зависимости кислородного потенциала для равновесной газовой смеси СО-СО2 от температуры.
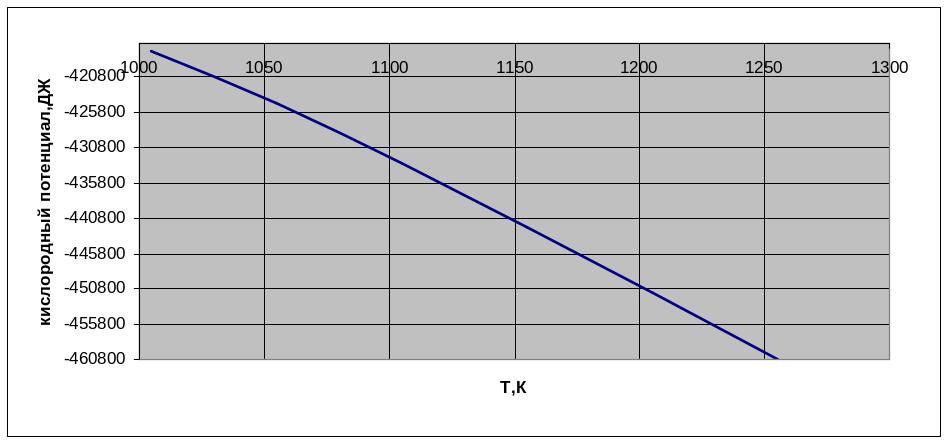
Рисунок 3 – график зависимости кислородного потенциала от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры кислородный потенциал для равновесной газовой смеси СО-СО2 уменьшается.
Задача №2 Восстановление оксида железа оксидом углерода и водородом.
Определить равновесный состав газовых реакций восстановления оксидов железа водородом при заданной температуре (Т=1420К).
Решение:
1.
![]() ;
;![]()
2.
![]() ;
;![]()
3.
![]() ;
;![]()
4.
![]() ,
при Т<843 К;
,
при Т<843 К;
![]()
Т.к. Т=1420 К то реакция под номером 4 происходить не будет
Определим константы равновесия для каждой реакции по формуле
![]() (1)
(1)
![]() 28936,64
28936,64
![]() 15,8215
15,8215
![]() 0,95993
0,95993
где
![]() ,
,![]() ,
,![]() - константы равновесия для первой, второй
и третьей реакции соответственно.
- константы равновесия для первой, второй
и третьей реакции соответственно.
Но
константа равновесия реакции находится
еще и по следующей формуле:
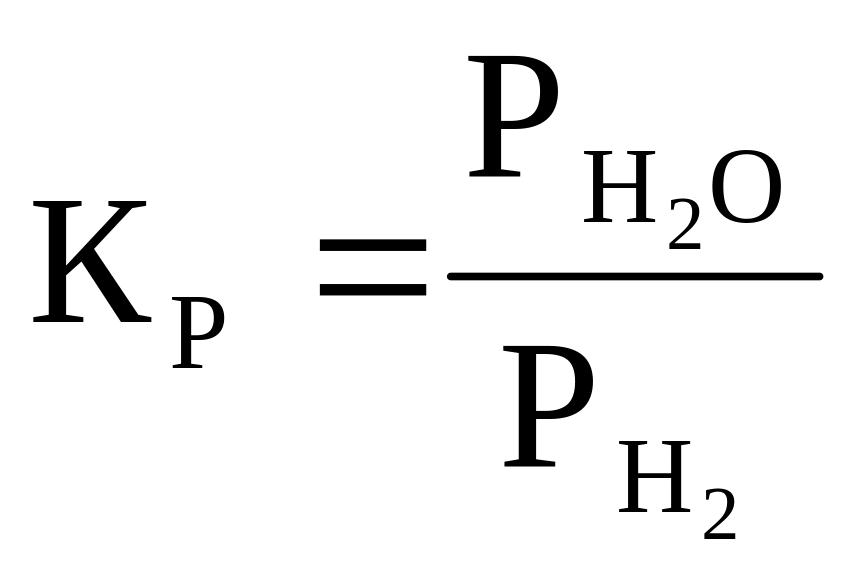 (2)
(2)
где
![]() - давления паров воды и водорода
- давления паров воды и водорода
Общее
давление равно
![]() (3)
(3)
Общее давление примем равным 1.
Подставим (3) в (2) и получим:
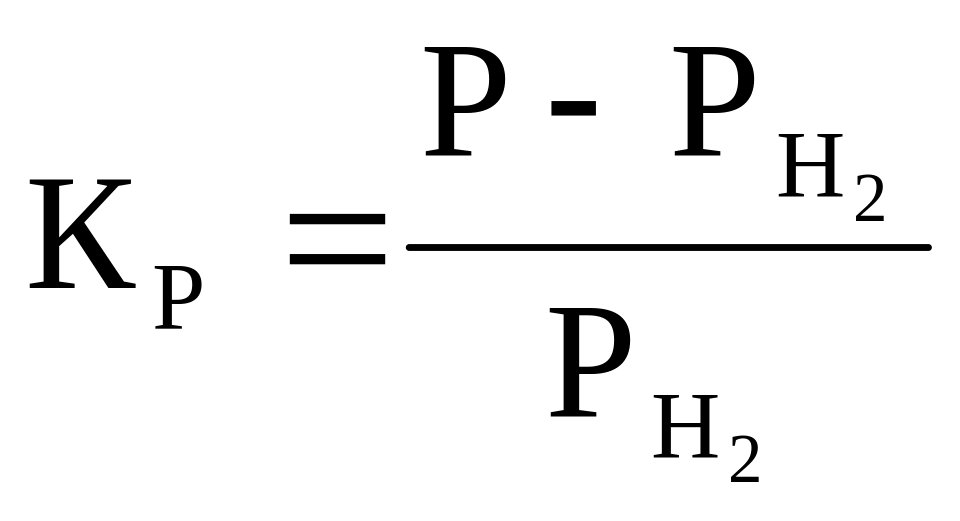 (4)
(4)
![]() (5)
(5)
где РН2 будет определять долю Н2 в реакции восстановления в процентах
Подставим вместо КР значения, полученные по формуле (1).
Равновесный состав газовых реакций восстановления оксидов железа водорода предоставлен в таблице 2
Таблица 2
Реакции |
%H2 |
%H2O |
|
0,00346 |
99,99654 |
|
5,94477 |
94,05523 |
|
51,02223 |
48,97777 |
