
Атомно-молекулярное учение. Основные законы: закон сохранения массы, кратных отношений, постоянства состава, эквивалентов.
В 1903 году Томсон предложил модель атомов из электронов, а в 1911 году Резерфорд предложил планетарное (ядерное), атом состоит из положительного ядра, а по окружности вращаются электроны; Заряд атома = нулю.
Согласно представлениям М. В. Ломоносова все вещества состоят из мельчайших частичек (дискретность веществ), различающиеся на 2 вида: атомы и молекулы ( молекула наименьшая частица вещества, обладающая его свойствами),. Частицы находятся в постоянном движении.
Закон сохранения массы.
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции. (Установил М. В. Ломоносов в 1748, французкий учёный подтвердил в 1788).
Закон постоянства состава
Соотношения между массами элементов, входящих в состав данного соединения постоянны и не зависят от способа получения соединения.
Закон эквивалентов
Вещества, взаимодействующие друг с другом в количестве вещества пропорциональны их эквивалентам.
Эквивалент элемента – такое его количество, которое соединится с 1-м молем атомов водорода или заместит тоже самое количество атомов водорода в химических реакциях.
Строение атома. Электрон и его характеристики (гл. квантовое число, орбитальное, магнитное).
В 1911 году Резерфорд предложил планетарное (ядерное), атом состоит из положительного ядра, а по окружности вращаются электроны; Заряд атома = нулю
Вращающийся электрон обладает энергией, которая меняется скачками (т. е. дискретна). Уровни энергии электрона определяется набором квантовых чисел.
Главное квантовое число (n)
Определяет энергию электрона и размеры электронных облаков (N число от 1 до ∞ и совпадает с номером периода)
Орбитальное квантовое число (l)
Определяет форму орбитальных облаков
Магнитное квантовое число (ml)
Определяет пространственное ориентацию электронных облаков (Z число от –l до +l)
Спиновое квантовое число (ms)
Электрон вращается вокруг собственной оси – это свойство спина ( +0.5 или -0.5)
Размещение электронов в атомах. Принцип Паули, правило Хунда.
Принцип Паули
В атоме не может быть 2-х электронов, у которых были бы одинаковы все квантовые числа.
Правило Хунда
В данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальный.
Периодический закон и периодическая система элементов Д.И.Менделеева. (s-, р- и d-элементы; периоды и группы; электронное строение атомов).
В 1869 году Д. И. Менделеев открыл закон периодичности химических свойств элементов (в зависимости от величины их атомных масс). Нильс Бор в 1922 году установил физическую основу закона (число электронов в атоме).
Период – горизонтальный ряд элементов, имеющих одинаковое число электронных слоёв (всего 7).
Группа – вертикальный ряд (всего 8):
Главные подгруппы (s и p элементы). Элементы содержат на внешнем электроном уровне одинаковое число электронов (= номеру группы = максимальная валентность).
Побочные подгруппы (d- элементы)
Строение атома
Атом состоит из положительного ядра, а по окружности вращаются электроны; Заряд атома = нулю.
Основные свойства атомов (энергия ионизации, электроотрицательность, сродство к электрону, валентность, степень окисления)
Свойства атома:
Размер - Атомы не имеют строго определённых границ, что обусловлено волновой природой электрона.
Энергия ионизации (J )- энергии необходимая для отрыва наиболее слабо связанного электрона от атома (эл/Вольт).
Сродство к электрону (E) – энергия выделяющаяся при присоединении дополнительного электрона.
Электроотрицательность (X) – способность атома в молекуле притягивать к себе электроны.
Валентность –
Степень окисления –
Химическая связь. Типы химической связи (ковалентная – полярная и неполярная, ионная, металлическая, водородная, межмолекулярная).
Химическая связь – силы удерживающие атомы в равновесии в образованиях.
Типы химической связи:
Ковалентная – наиболее общий вид химической связи, возникающей за счёт обобщения электронной пары (обменный и донорноакцепторный принципы)
Не полярная – электроотрицательность взаимодействующих атом одинакова (у гомоядерных молекул)
Полярная – электронная плотность смещена к более электроорицательному атому (у гетероядерных молекул)
Ионная – частный случай ковалентной связи, образовавшаяся электронная пара полностью принадлежит более электроотриуательному атому.
Металлическая – частичная делаколизация валентных электронов; валентные электроны свободно движутся в решётке металла, электростатически взаимодействуя с положительными ионами (на узлах решётки)
Водородная – смещение электронной пары показывает, что атом водорода в этом случае обладает эффективно-положительным зарядом и может взаимодействовать с другим отрицательным атомом (в органических веществах и водных растворах)
Межмолекулярная – обусловлен дисперсными силами и индукционным взаимодействием (диполь-дипольой взаимодействие)
Три основных свойства ковалентной связи (поляризуемость, насыщаемость, направленность).
Поляризация. Смещение электронной пары к более электроотрицательному атому
Направленность. Связь направлена в сторону максимального перекрывания атомных орбиталей
Насыщаемость. Способность атома образовывать столько ковалентных связей сколько у него имеется энергетически доступных орбиталей
Образование σ - и π- связей (показать графически).
σ- связь перекрывание электронных облаков в
π-связь перекрывание электронных облаков в
Метод молекулярных орбиталей (ММО). Основные положения. Понятия связывающей и разрыхляющей молекулярных орбиталей ( на примере образования молекулы или иона).
Все электроны в молекуле или иона распределены по соотсветсвующим орбиталям.Каждую молекулярную орбиталь представляют в виде алгебраической суммы (множеством комбинаций атомных орбиталей).
Основные положения:
Распределение электронов происходит в соответсвии с принципом минимума энергии, принципом Паули и правилом Хунда
Понятия связывающей и разрыхляющей молекулярных орбиталей
Когда электронная плотность концентрируется за атомными ядрами, то образуется сигма разрыхляющая (когда внутри, то сигма связывающая).
При сумме – связывающая, при разности – разрыхляющая.
Молекулярные параметры (энергия связи, межъядерное расстояние, кратность связи).
Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:
![]()
где
![]() —
энергия связи компонентов в системе из
i компонент (частиц),
—
энергия связи компонентов в системе из
i компонент (частиц),
![]() —
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и
—
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и
![]() —
полная энергия связанной системы.
—
полная энергия связанной системы.
Применение ММО к двухатомным гомоядерным молекулам. Энергетические диаграммы В2, С2, О2 .
Применение ММО к двухатомным гетероядерным молекулам. Примеры.
Метод валентных связей (МВС). Основные положения теории МВС. Понятия гибридизации орбиталей (sp, sp2, sp3). Неподеленые электронные пары (искажение правильных геометрических фигур). Примеры NH3 и H2O.
Внутренняя энергия системы. Тепловой эффект реакции. 1 закон термодинамики.
Внутренняя энергия системы – полная энергия системы, которая складывается из энергии движения молекул, ядер и электронов в атомах и молекулах, а также из энергии межмолекулярного взаимодействия.
Тепловой эффект реакции – выделение или поглощение энергии во время реакции.
1-ый закон термодинамики – подводимое к системе тепло расходуется на изменение внутренней энергии и совершение работы (Q=⌂U+A).
Виды термодинамических процессов. Определение теплового эффекта при р=соnst и v=const. Понятия экзо- и эндо- эффектов.
Виды термодинамических процессов:
Изобарный процесс – процесс при постоянно давлении A=p⌂V
Изохорный процесс – процесс при постоянном объёме Q=⌂U, A=0
Изотермический процесс – процесс при постоянной температуре
Адиабатный процесс – процесс в изолированной системе т.е без обмена энергией с внешней средой (быстропротекающий процесс)
Энтальпия (H) – теплосодержание системы (кДЖ/моль).
Экзотермическа реакция – реакция сопровождающаяся выделением тепла (+Q, -⌂H)
Эндотермическая реакция – реакция сопровождающаяся поглощением тепла (-Q, +⌂H)
Закон Гесса. Примеры.
(Следствие из 1-го закона термодинамики)
Тепловой эффект реакции не зависит от пути её протекания, а зависит только от начального и конечного состояния системы.
Образование углекислого газа из графита и кислорода (в 1-у стадию, в 2-е стадии).
Стандартная теплота образования, сгорания.
Теплота образования – тепловой эффект реакции образования 1-го моля химического соединения из соответствующих ему простых веществ, устойчивых при данных условиях. Теплоты образования простых веществ = 0.
Теплота сгорания – тепловой эффект реакции окисления 1-го моля вещества (с образованием для органических веществ СО2 и жидкая воды, для неорганических оксида веществ, участвующих в реакии).
Энтропия – мера хаотичности системы.
Энтропия (S) – мера разупорядочности (хаотичности) системы: натуральный логарифм, выражающий вероятности существования веществ или их состояний (S= RlnΩ R – газовая постоянная; Ω - вероятность существования системы). В реакциях всегда ⌂S>0.
Изобарно-изотермический потенциал. Стандартное значение.
(Свободная энергия Гибса)
Изобарно-изотермический потенциал. (Свободная энергия Гибса)
Суммарная движущая сила при постоянной температуре и давлении (G=H-T*S или ⌂G=⌂H-T*⌂S). ⌂G<0 – реакция протекает самопроизвольно; ⌂G>0 - реакция не протекает самопроизвольно; ⌂G=0 – система находится в состоянии химического равновесия.
Кинетика химических реакций. Скорость химических реакций для гомогенных процессов.
Кинетика химических реакций – скорость и механизм химических процессов. Кинетика описывает ход химического процесса во времени при постоянной температуре в зависимости от концентрации веществ и их фазового состава.
Скорость химической реакции для гомогенных процессов определяется по изменению концентрации любого из реагирующих веществ в единицу времени.
aA+bB→cC+dD
v=±(dC/dt) т.е. v=±C´
Закон действующих масс для определения скорости химических реакций (для гомогенных и гетерогенных процессов).
Взаимодействие молекул А и В происходит в случае столкновении в какой-то точке. Вероятность нахождения веществ А и В в какой-то точке определяется их молярной концентрацией в этой точке.ωА=α[A] ωB=β[B] α,β – доля вещества; [A], [B] – концентрация вещества
Вероятность одновременного присутствия этих веществ в данной точке равна
ωА*ωB=α*β*[A]*[B]
vAB=γ*α*β*[A]*[B]
γ – коофициент учитывающий долю сталкивающихся молекул
γ*β*α=k – коофициент пропорциональности/константа скорости процесса
Скорость гомологической реакции прямопропорционален произведению концентраций действующих веществ в степенях их коофициентов. При гетерогенном процессе в уравнение закона входят только жидкие или только газообразные вещества, твёрдые вещества исключаются. Закон действует для реакций в одну стадию.
Молекулярность и порядок химических реакций.
Молеклярность химических реакций – минимальное число молекул участвующих в элементарном химическом процессе.
Мономолекулярные
Бимолекулярные число молекул в левой части
Тримолекулярные
Порядок химических реакций – молекулярность при протекании реакции последовательно через несколько гомогенных или гетерогенных стадий.
Влияние температуры и энергии активации на скорость химических реакций. Эмпирическое уравнение Вант-Гоффа.
При фиксированной температуре возможна если взаимодействующие молекулы обладают определённым запасом энергии (Арениус назвал её энергией активации).
Чем больше энергия активации тем медленнее протекает реакция; при Ea=0 реакция протекает мгновенно.
При изменении температуры реакции на 10 градусов скорость её изменяется в в 2-4 раза.
Эмпирическое уравнение Вант-Гоффа
Уравнение Аррениуса. Предэкспоненциальный множитель. Стерический фактор.
Уравнение Арениуса:
k=P*Z*℮-E/(RT)
Z – число всех соударений
P – доля соударений благоприятных в пространственном положении
℮-E/(R*T) – доля активных (благоприятных в энергетическом отношении соударений)
Предэкcпоненциальный множитель:
А= P*Z
Z – число всех соударений
P – доля соударений благоприятных в пространственном положении
Стерический фактор:
В сложных молекулах общее число соударений не равно числу благоприятных соударений, вводится стерический фактор, учитывающий необходимость определённой взаимной ориентации в пространстве для взаимодействия сложных молекул.(P)
Химическое равновесие. Влияние различных факторов на сдвиг химического равновесия. Принцип Ле Шателье.
Химическое равновесие – (динамическое) скорость реакции в прямом направлении равна скорости реакции в обратном направлении. Концентрации исходных веществ и продуктов рекции неизменно во времени – равновесные концентрации.
Принцип Ле Шателье
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Влияние на сдвиг химического равновесия
Влияние концентраций компонентов
Влияние общего давления в системе
Влияние температуры
Катализ. Влияние катализатора на скорость химической реакции.
Катализ – изменение величины энергии активации с помощью катализатора (вещества принимающее участие, но не расходующиеся в процессе реакции).
Добавление катализатора приводит к образованию 2-х стадий процесса со своими величинами энергии активации, обе величины энергий активаций значительно меньше чем в отсутствие его, проведение реакции в присутствии катализатора энергетически выгодно, что приводит к повышению скорости реакции процесса.
v´/v=k´/k=℮(E-E´)/RT
Растворы. Классификация растворов. Движущие силы образования растворов (Δ S и Δ G).
Растворы – это гомогенные системы с переменным составом, состоящие из 2-х или более веществ. Одного вещества значительно больше (растворитель) чем других.
Классификация растворов
По агрегатному состоянию
Газообразные
Жидкие
Твёрдые
В зависимости от размеров частиц
Истинные (растворённое вещество находится на атомном или молекулярном уровне т.е. не видимы и под микроскопом)
Коллоидные (размер частиц 1-100ммк)
Движущие силы образования растворов
Энтропийный (S) и энтольпийный (H) факторы.
При растворении газов в жидкости энтропия понижается, при растворении кристаллов энтропия растёт. Чем сильнее взаимодействие растворяемого вещества и растворителя тем больше роль энтольпийного фактора.
При растворении ∆G>0. Для жидких растворов процесс растворения идёт самопроизвольно до установления динамического равновесия между раствором и твёрдой фазой.
Выражение концентрации растворов. Размерные и безразмерные величины концентраций.
Концентрация — величина, характеризующая количественный состав раствора, относительное количество растворенного вещества в растворе.
Массовая доля растворенного вещества – это отношение массы растворенного вещества m1 к общей массе раствора m, выраженное в процентах.
![]()
Молярная концентрация С (мольно-долевая концентрация - величина безразмерна.
– это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
![]()
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
![]() ,
,
Растворимость вещества (насыщенные и пересыщенные растворы).
Растворимость - способность вещества растворяться в том или ином растворителе.
Раствор называют насыщенным, если он находится в равновесии с растворяемым веществом ( G = 0), т.е. насыщенный раствор содержит предельное (при данных условиях) количество растворенного вещества.
Раствор, содержащий вещества больше, чем это определяется его растворимостью, - пересыщенный; раствор, содержащий вещества меньше, чем это определяется его растворимостью - ненасыщенный.
Растворы неэлектролитов. Закон Рауля, закон Дальтона, закон Генри.
Неэлектролиты - это вещества, растворы или расплавы которых не проводят электрический ток. В молекулах этих веществ существуют ковалентные не полярные или малополярные связи. Значит эти вещества мало взаимодействуют с растворителем их растворы можно принять за идеальные.
Закон Рауля
Закон Рауля справедлив только для разбавленных растворов неэлектролитов. Относительное понижение давление пара над раствором равно мольной доле растворённого вещества ( (P0A-PA)/P0A=Xb , PA – давление пара над раствором; P0A – давление пара над растворителем; XB – мольная доля растворённого вещества. PA = PA0-XA*XB)
Закон Дальтона
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений (P=P1+P2=PB0*XB+PA0*XA).
Закон Генри
При постоянной температуре давление газообразного компонента прямопропорционально его мольной доле (PB=KH*XB KH – константа Генри).
Температуры кипения и замерзания разбавленных растворов.
Жидкость будь она чиста или раствор закипает при той температуре, при которой давление насыщенного пара над ней становится равным давлению внешнему (P=Pвнеш.) – следствие из закона Рауля. Температура кипения раствора всегда выше чем температура кипения чистого растворителя. ∆T=TР-Р-T0=E*C E – коофициент пропорциональности (E=(R*(T0)2)/∆h*100 ∆h – удельная теплота испарения чистого растворителя) C – концентрация (моляльность).
Любая жидкость замерзает при той температуре, при которой давление насыщенного пара над ней становится равным давлению насыщенного пара над кристаллами.∆T= T0-T= K*C (K-криостепическая постоянная K=(R*(T0з)2)/∆ℓ*1000 ∆ℓ- удельная теплота плавления чистого раствора).
Осмос. Осмотическое давление.
Осмос – явление связанное со способностью проходить через мембрану, разделяющую вещества (растворы), только молекул растворителя.
Осмотическое давление – давление вызываемое осмосом, это внутреннее давление растворённого вещества числено равное тому внешнему давлению, которое нужно приложить чтобы прекратить осмос. ΠV=RT Π – осмотическое давление. Осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество будучи переведено в газовое состояние в том же объёме и той же температуре. Π=CRT C – концентрация раствора.
Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает молекулы растворителя.
Растворы электролитов. Растворы слабых электролитов и сильных электролитов. Степень диссоциации.
Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда.
Диссоциация – явление сопровождающееся распадом веществ на ионы при растворении их.
Степень диссоциации - отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е. α= Nраспавш./Nобщ.
Сильные электролиты α>30%
Сильные минеральные кислоты, щёлочи, большинство солей.
Слабые электролиты α<30%
Некоторые минеральные кислоты, большинство оснований.
Слабые электролиты. Константа диссоциации. Закон разбавления Оствальда.
Слабые электролиты α<30%
Некоторые минеральные кислоты, большинство оснований.
Kp=([A+]*[B-])/[AB]) [AB] –не распавшееся (закон разбавления Оствальда).
Kd – константа диссоциации Kd=C*α2 для слабых электролитов.
Ионное произведение воды. Водородный показатель кислотно-основных свойств растворов.
Kd(воды)=1,8*10-16 => концентрация воды остаётся практически неизменной 55,6 моль/л
Численная величина произведения ионов, на которое диссациирует вода
Kв=[H+]*[OH-]=Kd*[H2O]=1*10-14
Водородный показатель кислотно-основных свойств раствора (pH)
Это отрицательный десятичный логарифм концентрации водородных ионов
pH = -ℓg([OH-]*[H+])
pH+pOH=14 – шкала кислотности (<7 – среда кислая, >7 – среда щелочная)
Растворы сильных электролитов. Теория Дебая-Хюккеля. Уравнение Дебая-Хюккеля.
Растворы сильных электролитов α>30%
Диссоциация сильных электролитов полностью смещена вправо. Для сильных электролитов константа диссоциации/равновесия величина неопределённая. При повышении концентрации наблюдается снижение электропроводности.
Теория Дебая-Хюккеля
Электролиты полностью диссациируют, но в сравнительно разбавленных растворах C=0,01моль/л
Каждый ион окружён оболочкой из ионом противоположного знака, в свою очередь каждый из этих ионов сольватирован – это окружение называется атмосферой
Уравнение Дебая-Хюккеля
ℓgγ= -0,51*z2√J γ – коофициент активности (γ± =√(γ-)*(γ+)) , z – заряд иона J – ионная сила
Электропроводность растворов электролитов. Удельная и молярная.
Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
![]() ,
Ом-1см-1
,
Ом-1см-1
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
![]() ,
Ом-1см2моль-1
,
Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении.
Основные классы неорганических веществ – оксиды, кислоты, соли, основания. Дать примеры каждого класса и химические реакции каждого класса. Примеры. Реакция нейтрализации (пример).
Оксиды бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Основные (МеО)
Кислотные (неМеО)
Кислоты (H+ +кислотный остаток)
Основания (гидроксиды) - сложные вещества, которые состоят из атомов металла и гидроксогруппы (-OH).
Соли класс химических соединений, к которому относятся вещества, состоящие из катионов металла и анионов кислотного остатка.
Окислительно-восстановительные реакции. Основные типы реакций (пример).
Окислительно-восстановительные реакции - это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окисление- процесс отдачи электронов, с увеличением степени окисления
Восстановление - процесс присоединения электронов атомом вещества, при этом его степень окисления понижается Основные типы реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O→ HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Комплексные соединения. Классификация комплексных соединений. Дать определение центрального атома, координационного числа, лигандов. Дать название (пример).
Комплексные соединения (координационные соединения)
частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем(центральный атом), нейтральных молекул или других ионов, называемых лигандами. Комплексные соединения мало диссоциируют в растворе.
Классификация комплексных соединений
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительног иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl3 — хлорид гексоамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а так же при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II)
По числу мест занимаемых лигандами в координационной сфере
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своем составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Электрохимия. Химические источники тока. Гальваническая ячейка Даниэля-Якоби.
Если процессы окисления и восстановления пространственно разделить то любую окислительно-востановительную реакцию можно использовать для получения электрического тока. Устройсва для его получения с помощью химических реакций – химические источники тока (хит).
Гальваническая ячейка (простейший химический источник тока) представляет из себя сосуды, в которых 2 электрода, помещённые в растворы соответствующих электролитов, соединены соляным мостиком (стеклянная трубочка, заполненная раствором электролита, катионы и анионы которого характеризуются одинаковой подвижностью). Впервые была рассмотрен этот процесс Даниэлем-Якоби.
CuSO4+Zn→Cu+ZnSO4
(-)Zn ¦ Zn2+|| Cu2+ ¦ Cu(+)
Проводники первого и второго рода.
По характеру и природе электропроводности все проводники электрического тока подразделяются на проводники первого и второго рода.
Характерной особенностью проводников первого рода, к которым относятся металлы, сплавы, уголь и некоторые другие вещества, является наличие в них свободных электронов, представляющих собой отрицательно заряженные частицы с массой, равной 1/1840 массы атома водорода. Электрический ток в проводнике первого рода рассматривается как поток электронов, перемещающихся в электрической цепи от отрицательного полюса положительному.
К проводникам второго рода относятся соли и щелочи в кристаллическом, растворенном или расплавленном состоянии, также растворы кислот и оснований в воде и в некоторых других растворителях.
Согласно теории электролитической диссоциации, молекулы солей, кислот и щелочей при переходе в водные растворы диссоциируют, т. е. распадаются на электрически заряженные частицы — ионы. Благодаря наличию в растворе положительно заряженных частиц — катионов и отрицательно заряженных частиц — анионов раствор приобретает свойство проводимости электричества. Такие электропроводные растворы носят название электролитов.
Электродные потенциалы. Уравнение Нернста для электродного процесса.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. Значение электродных потенциалов определяется относительно некоторого электрода, потенциал которого принят за 0, таким эталоном выбран водородный электрод при стандартных условиях.
Уравнение Нернста для электродного процесса.
![]() ,
,
где
— электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
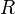 —
универсальная газовая постоянная,
равная 8.31 Дж/(моль·K);
—
универсальная газовая постоянная,
равная 8.31 Дж/(моль·K);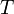 —
абсолютная температура;
—
абсолютная температура;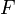 —
число Фарадея, равное 96485,35 Кл/моль;
—
число Фарадея, равное 96485,35 Кл/моль; —
число моль электронов, участвующих в
процессе;
—
число моль электронов, участвующих в
процессе;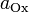 и
и
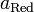 —
активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
—
активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
Ряд напряжений металлов. (Стандартные значения электродных потенциалов металлов)
Электрохимический ряд напряжений металлов
Li |
Cs |
K |
Ba |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Co |
Ni |
Sn |
Pb |
H2 |
Cu |
Ag |
Hg |
Pt |
Au |
-3,04 |
-3,01 |
-2,92 |
-2,90 |
-2,87 |
-2,71 |
-2,36 |
-1,66 |
-0,76 |
-0,44 |
-0,28 |
-0,25 |
-0,14 |
-0,13 |
0 |
+0,34 |
+0,80 |
+0,85 |
+1,28 |
+1,5 |
Li+ |
Cs + |
K+ |
Ba2+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe2+ |
Co2+ |
Ni2+ |
Sn2+ |
Pb2+ |
2 H |
Cu2+ |
Ag+ |
Hg2+ |
Pt2+ |
Au3+ |
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо. |
|||||||||||||||||||
Электрохимическая коррозия. Процессы, происходящие на аноде и катоде.
Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода.
