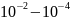Первый постулат Бора: атомная система является устойчивой лишь в определённых, стационарных состояниях, соответствующих некоторой дискретной/непрерывной последовательности значений энергии E системы. Любое изменение этой энергии связано со скачкообразным переходом системы из одного стационарного состояния в другое.
Второй постулат Бора (основной): ЭМИ, связанное с переходом атомной системы из стационарного состояния с энергией El в стационарное состояние с энергией Ekявляется монохроматическим и его частота vопределяется соотношением:
 – основной (второй) постулат Бора, где
h–
постоянная Планка.
– основной (второй) постулат Бора, где
h–
постоянная Планка.  – комбинационный
принцип Ритца.
– комбинационный
принцип Ритца. -
формула
Бора для атома водорода,
где n
= 1,2, .. – главное квантовое число
-
формула
Бора для атома водорода,
где n
= 1,2, .. – главное квантовое число -
постоянная
Ридберга,
где m–
масса электрона, e–
элементарный заряд электрона, ħ –
постоянная Планка. Физический
смысл R:
R
(взятая
в единицах энергии эВ) равна энергии
ионизации атома водорода, выраженной
в см-1.
Если R
= 108867 см-1,
то W
= R
= 13,6 эВ.
-
постоянная
Ридберга,
где m–
масса электрона, e–
элементарный заряд электрона, ħ –
постоянная Планка. Физический
смысл R:
R
(взятая
в единицах энергии эВ) равна энергии
ионизации атома водорода, выраженной
в см-1.
Если R
= 108867 см-1,
то W
= R
= 13,6 эВ.Формула частоты спектральной линии:
Совокупность переходов с нижних уровней на верхние даёт спектр поглощения, а с верхних на нижние – спектр испускания.
Если атом возвращается в основное состояние, испуская фотон hv той же частоты v, что и поглощённый фотон, то имеем резонансное испускание, а соответствующее излучение называется резонансным. Линии, для которых наблюдается резонансное испускание, называется резонансными.
Правило Стокса: для испускания, наблюдаемого при оптическом возбуждении атомных систем с основного уровня, характерно то, что частота линий испускания
 частоте
линий поглощения:
частоте
линий поглощения:
Рассеивание без изменения частоты является когерентным, фаза рассеянного излучения определяется фазой падающего излучения. Рассеивание с изменением частоты является не когерентным – фаза рассеянного излучения не зависима от фазы падающего излучения.
 -
частота
рассеянного комбинационного излучения
-
частота
рассеянного комбинационного излучения – стоксовые
линии рассеивания
– стоксовые
линии рассеивания – антистоксовые
линии рассеивания
– антистоксовые
линии рассеиванияДеление спектроскопии по свойствам электромагнитного излучения
Шкала электромагнитных волн:
Радиочастотная область |
Оптическая область |
Рентгеновская |
Область γ-излучения |
||||
Длинно-волновая |
Коротко-волновая |
Микро-волновая |
ИК-обл. |
Видимая |
УФ-обл. |
||
|
|
|
|
|
|
|
|
В соответствии со шкалой электромагнитных волн различают:
γ-спектроскопию
Рентгеновскую спектроскопию
Оптическую спектроскопию
Ультрафиолетовая спектроскопия
Спектроскопия видимого излучения
ИК-спектроскопия
Радиоспектроскопию
Микроволновая спектроскопия
Собственно-радиочастотная спектроскопия
Деление спектроскопии по свойствам атомных систем
Ядерная спектроскопия
Атомная спектроскопия
Молекулярная спектроскопия
Спектроскопия конденсированных систем
Типы уровней атомов и молекул:
Электронные уровни энергии
Колебательные уровни молекул.
Вращательные уровни молекул.
Уровни тонкой структуры
Уровни сверхтонкой структуры.
Уровни магнитной структуры.
Уровни электрической структуры
 – условие
для потенциала возбуждения
– условие
для потенциала возбужденияСпектральный анализ – физический метод анализа химического состава вещества, основанный на исследовании спектров испускания и поглощения атомов и молекул.
Типы спектрального анализа по решаемым задачам:
Элементный - когда устанавливается состав пробы по элементам
Изотопный – когда устанавливается состав пробы по изотопам.
Молекулярный – когда устанавливается молекулярный состав пробы
Структурный - когда устанавливаются все или основные структурные составляющие молекулярного соединения
Типы спектрального анализа по применяемым методам:
Эмиссионный
Абсорбционный
Комбинационный
Люминесцентный
Рентгеновский
Радиоспектроскопический
Типы спектрального анализа по характеру получаемых результатов:
Качественный
Полуколичественный
Количественный
Типы спектрального анализа по способу регистрации спектров:
Визуальное
Фотографические
Фотоэлектрические
Термоэлектрические
Группы атомов в молекуле, расположенных около кратной связи, определяющие характерную полосу поглощения, называются хромофорами.
Энергия рассеянного кванта:

Масс-спектрометрический метод использует различие отклонений положительно заряженных ионов изотопов различных масс в электрическом и магнитном поле. Он наиболее универсален. С его помощью были получены все основные данные по изотопному составу естественных элементов. Все остальные методы менее универсальны и обладают меньшей точностью. Однако важным преимуществом некоторых из них перед масс-спектрометрическим является значительно большая доступность аппаратуры и простота самих методов.
2.4.б – схема абсорбционного спектрального анализа
1 – источник света, 2 – осветительная линза, 3 – кювета для анализируемой пробы, 4 – спектральный аппарат, 5 – регистрация спектра, 6 – определение λ спектральных линий или полос, 7 – качественный анализ пробы с помощью атласов и таблиц, 8 – определение интенсивностей линий или полос, 9 – количесвенный анализ пробы по градировочному графику.

 1-
я главная четверка квантовых чисел
1-
я главная четверка квантовых чисел
n, l, j, mj 2-я четверка квантовых чисел
Водородоподобные ионы - нейтральный атом водорода и ионизированные атомы с одним электроном.
Степень вырождение по l:

Степень вырождения по n:

Правил отбора по n не существует.

Правило отбора для орбитального квантового числа
 :
:
 .
.Правило отбора для орбитального магнитного квантового числа


Полный момент:

Степень вырождения для уровня с заданными n, и j: gj=2j+ 1
Формула Бора для радиуса круговой орбиты:

Главное квантовое число n принимает целые значения n=1, 2, 3... и определяет энергию стационарного состояния по формуле Бора. Еn = -R/n2.
Число различных независимых состояний атомной системы с одним и тем же значением энергии Е
 называют
степенью
или кратностью вырождения.
называют
степенью
или кратностью вырождения.Спиновое магнитное квантовое число
 определяет проекцию спина на фиксированную
ось. Принимает два полуцелых значения
определяет проекцию спина на фиксированную
ось. Принимает два полуцелых значения
 .
.Если имеется одно стационарное состояние с заданным значением энергии, то уровень энергии называется невырожденным. Если же имеется ряд таких состояний, которым соответствует одно значение энергии, то уровень энергии называют вырожденным и говорят, что эти состояния вырождены.
Число возможных ориентаций спина (мультиплетность) в общем случае: ǽ
 ,
где
S
- значение спина для атома в целом.
,
где
S
- значение спина для атома в целом.
Принцип Паули: в атоме не может быть двух электронов в одинаковых состояниях, т.е. не может быть двух электронов, характеризуемых одинаковыми наборами квантовых чисел
 ,
,
,
.
,
,
,
.Электроны с одинаковыми n и называются эквивалентными электронами.
Совокупность значений n и для всех N электронов в атоме

 ,
,

 ,
…,
,
…,
 характеризует электронную
конфигурацию.
характеризует электронную
конфигурацию.
Первое отличие заполненных и незаполненных оболочек (Утверждение 1): Для заполненной оболочки (или совокупности таких оболочек) значения орбитального, спинового и полного моментов количества движения = нулю, и ей соответствует один невырожденный уровень энергии; т.е. L=0, S=0, J=0
Первое отличие заполненных и незаполненных оболочек (утверждение 2): Для неполностью заполненной оболочки (или совокупности таких оболочек) получается ряд возможных значений, характеризующих её моментов количества движения, и ей соответствует ряд уровней энергии.
Если конфигурация содержит чётное число электронов с нечётным
 ,
то она является чётной; конфигурации,
содержащие только электроны с
чётным
всегда чётные.[нечётные
:
p, f…; чётные
:
s, d…]Все
конфигурации, состоящие только из
заполненных оболочек, являются
чётными, т.к. содержат всегда
чётное число электронов любого рода.
Конфигурации с незаполненными
оболочками могут быть как чётными, так
и нечётными, причём их чётность
определяется только электронами в
незаполненных оболочках.
,
то она является чётной; конфигурации,
содержащие только электроны с
чётным
всегда чётные.[нечётные
:
p, f…; чётные
:
s, d…]Все
конфигурации, состоящие только из
заполненных оболочек, являются
чётными, т.к. содержат всегда
чётное число электронов любого рода.
Конфигурации с незаполненными
оболочками могут быть как чётными, так
и нечётными, причём их чётность
определяется только электронами в
незаполненных оболочках.
если конфигурация содержит нечётное число электронов с нечётным , то она является нечётной;
Случай нормальной связи или связи Расселя-Саундерса: При нормальной связи орбитальные моменты электронов
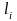 складываются в полный орбитальный
момент атома L, спиновые моменты
электронов
складываются в полный орбитальный
момент атома L, спиновые моменты
электронов
 -
в полный спиновый момент атома S, а затем
L и S складываются в полный момент атома
J. т.е.
-
в полный спиновый момент атома S, а затем
L и S складываются в полный момент атома
J. т.е.

 ;
L+S=J
;
L+S=J
Противоположный тип связи - (j, j): Сначала для любого электрона складываются его орбитальный и спиновый моменты и в полный момент данного электрона
 ,
а затем полные моменты отдельных
электронов складываются в полный момент
атома J,
т.е.
,
а затем полные моменты отдельных
электронов складываются в полный момент
атома J,
т.е.
 ,
,

Совокупность уровней с заданными L и S называется мультиплетным термом. ("терм" - это также название для обозначения абсолютной величины энергии в
 ,
отсчитываемой от границы ионизации).
,
отсчитываемой от границы ионизации).
Рентгеновский спектр поглощения соответствует переходу электрона из внутренней оболочки на непрерывные уровни, примыкающие к границе ионизации.
Дискретные рентгеновские спектры испускания (т.н. характеристические спектры) возникают при переходе электрона из более внешней оболочки на свободное место в более внутренней оболочке.
Переходы без излучения, при которых энергия возбуждения этого атома расходуется на вырывание еще одного электрона, можно трактовать как “поглощение” фотона внутри самого атома. Этот процесс называется внутренней конверсией (т.е. внутренним преобразованием) излучения или эффектом Оже.
Автоионизация — переходы с дискретных уровней на непрерывные, сопровождающиеся ионизацией атома.
Условием внутренней конверсии для рентгеновского излучения является выполнение общего соотношения:
 ,
где
,
где

 - изменение энергии ионизированного
атома при переходе с уровня
- изменение энергии ионизированного
атома при переходе с уровня
 на уровень
на уровень
 ,
,
 -
энергия вырывания электрона из одной
из оболочек данного атома, т.е. энергия
его дальнейшей ионизации.
-
энергия вырывания электрона из одной
из оболочек данного атома, т.е. энергия
его дальнейшей ионизации.Явление расщепления спектральных линий и уровней энергии в магнитном поле называется явлением Зеемана.
Вынужденные переходы между зеемановскими подуровнями данного уровня энергии происходят под действием излучения частоты, равной частоте возможных переходов, т.е. при наличии резонанса, и это явление называют магнитным резонансом.
Электронный парамагнитный резонанс - это поглощение микроволнового излучения веществом за счет переходов между подуровнями зеемановского расщепления, связанного с электронными магнитными моментами частиц вещества (определяющими парамагнитные свойства, откуда и название “парамагнитный” резонанс).
Явление Штарка - это расщепление уровней энергии и спектральных линий в электрическом поле.
Причина зеемановского расщепления - то, что магнитные моменты могут ориентироваться различными способами по отношению к магнитному полю.
Недиаграммные линии (сателлиты основных рентгеновских серий) - не укладывающиеся в диаграмму переходов однократно ионизированного атома.
Дипольный момент определяется как произведение расстояния между центрами распределения положительного и отрицательного зарядов на величину заряда.
В молекуле существуют 3 вида движений: электронное, колебательное, вращательное.
При колебаниях третьего типа изменяться валентные углы и атомы смещаются в направлениях, перпендикулярных валентным связям, длина которых остается почти постоянной. Такие колебания называются деформационными.
Современный 2-х лучевой ИК-спектрофотометр состоит из 5 основных элементов: 1)источник излучения 2)кюветное отделенье 3)фотометр 4)монохроматор 5)приемник
lg
 =
εСl
– закон
поглощения Бугера-Ламберта-Бера
=
εСl
– закон
поглощения Бугера-Ламберта-БераСкелетные колебания характерны только для данной молекулы и соответствующие им полосы не совпадают даже веществ с близким строением (Колебания в СО2 затрагивают сразу все атомы).
Получить чисто колебательные спектры не удается т.к. при вращении колебаний уравнений одновременно изменяется и скорость вращения молекулы. Так практически имеют дело с колебательно-вращательными спектрами.