
- •1.Предмет химии. Явления физические и химические. Основные понятия химии.
- •2.Основные законы химии. Закон сохранения массы. Закон постоянства состава.
- •3) Периодический закон и Периодическая система элементов д.И.Менделеева. Структура Периодической системы элементов.
- •4) Строение атома. Квантовые числа. Порядок заполнения электронных подуровней в атоме.
- •5) Общие представления о химической связи. Химическая связь и валентность.
- •6) Химическая связь. Типы химической связи. Ионная связь.
- •12) Растворимость. Способы выражения состава раствора.
- •13) Общие свойства растворов не электролитов.
- •2) Температура кипения и кристаллизации разбавленных растворов.
- •16) Устойчивость дисперсных систем. Факторы, влияющие на различные типы устойчивости.
- •17) Адгезия, когезия. Механизм возникновение. Работа адгезии и когезии.
- •Энтропия системы. II начало термодинамики
- •Энергия Гиббса как критерий самопроизвольного протекания химических процессов
- •22) Диаграммы плавкости двухкомпонентных систем.
- •23) Окислительно-восстановительные процессы. Процессы окисления и восстановления овр. Метод электронного баланса.
- •Классификация окислительно-восстановительных реакций.
- •Уравнение Нернста.
- •26) Химические источники тока «Сухие» элементы, аккумуляторы, топливные элементы.
- •29) Законы Фарадея. Выход по току.
- •31) Получение чистых и сверх чистых металлов. Электролитическое рафинирование. Зонная плавка. Другие методы очистки.
- •Зонная плавка органического самогона
- •44) Коррозия. Коррозия в растворах неэлектролитов. Ингибиторы коррозии.
- •45) Газовая коррозия. Электрохимическая коррозия.
12) Растворимость. Способы выражения состава раствора.
Растворимость – это способность вещества растворяться в том или ином растворителе.
Мерой
растворимости
вещества при данных условиях является
его содержание в насыщенном растворе,
т.е. там, где установилось равновесие
между раствором и веществом, которое
осталось нерастворённым. Способы
выражения состава раствора:
Массовая
доля растворенного
вещества
- это
есть отношение массы растворенного
вещества (![]() )
к массе раствора (
)
к массе раствора (![]() ).
).
![]() ,
следует учесть, что
,
следует учесть, что
![]() ,
,![]() .
Молярная
концентрация растворенного
вещества–
это
отношение количества моль растворенного
вещества (n)
к объему раствора (V)
или число моль растворенного вещества
в 1 литре раствора.
.
Молярная
концентрация растворенного
вещества–
это
отношение количества моль растворенного
вещества (n)
к объему раствора (V)
или число моль растворенного вещества
в 1 литре раствора.
![]() .Молярная
концентрация эквивалента растворенного
вещества – это
есть отношение количества эквивалентов
растворенного вещества (nэкв)
к объему раствора (V).
.Молярная
концентрация эквивалента растворенного
вещества – это
есть отношение количества эквивалентов
растворенного вещества (nэкв)
к объему раствора (V).
![]() .
Моляльная
концентрация–
это
есть количество моль растворенного
вещества (n)
в 1 кг растворителя (или в 1000 г растворителя).
.
Моляльная
концентрация–
это
есть количество моль растворенного
вещества (n)
в 1 кг растворителя (или в 1000 г растворителя).
![]() .
Молярная
доля растворенного
вещества –
это отношение количества моль растворенного
вещества к сумме количеств (к сумме
моль) всех веществ, составляющих раствор.
.
Молярная
доля растворенного
вещества –
это отношение количества моль растворенного
вещества к сумме количеств (к сумме
моль) всех веществ, составляющих раствор.
![]()
13) Общие свойства растворов не электролитов.
Растворы имеют ряд свойств, которые при данной температуре зависят только от числа частиц растворенного вещества. Эти свойства называют коллигативными: чем больше частиц в растворе, тем сильнее выражены коллигативные свойства.
К
коллигативным свойствам относятся: 1)
давление
пара растворов:
Над
любой жидкостью устанавливается
определённое давление пара, насыщающее
пространство.
Это
давление характеризует состояние
равновесия между жидкой фазой и
находящимися над нею паром.
Если
в жидкость внесено практически нелетучее
вещество, то число молекул растворителя,
испаряющихся с поверхности жидкости,
сокращается, что вызывает уменьшение
давления пара над раствором, и равновесие
устанавливается при более низком
давлении, чем для чистого раствора.
Согласно
закону
Рауля: Относительное
понижение парциального давления
насыщенного пара растворителя над
разбавленным раствором неэлектролита
равно мольной доле растворённого
вещества:
![]()
2) Температура кипения и кристаллизации разбавленных растворов.
Фазовые
превращения при образовании растворов
могут быть описаны температурами кипения
и кристаллизации, которые вследствие
понижения давления пара над раствором,
отличаются от соответствующих значений
для чистых растворителей и зависят от
концентрации растворённых веществ.
Температура, при которой давление
насыщенного пара жидкости равно
нормальному давлению, называется
нормальной
температурой кипения.
Для
сильно разбавленных растворов
в различных растворителях Раулем было
установлено: понижение температуры
кристаллизации или повышение температуры
кипения разбавленных растворов
неэлектролитов прямо пропорционально
молярной концентрации растворённого
вещества:
![]() ,
,
![]()
осмотическое давление. При соприкосновении раствора и чистого растворителя, которые разделены полупроницаемой (т.е. проницаемой только для молекул растворителя) мембраной, растворитель проникает в раствор, преодолевая избыточное давление до достижения его равновесного значения – осмотического давления. Осмотическое давление не зависит от природы растворителя и растворенного вещества. Осмотическое давление может быть определено по закону Вант-Гоффа: Осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора:

14) Общие свойства растворов электролитов. Сильные электролиты. Изотонический коэффициент.
Вещества, водные растворы или расплавы, которые проводят электрический ток, называются электролитами.
Распад электролитов на ионы под действием молекул растворителя называются электролитической диссоциацией.
Количественными характеристиками электролитической диссоциации являются:
степень электролитической диссоциации
 – это отношение числа молекул, распавшихся
на ионы (
– это отношение числа молекул, распавшихся
на ионы (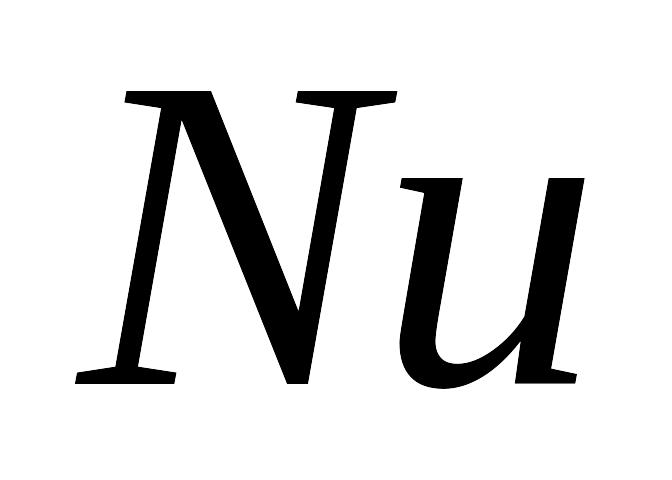 ),
к общему числу молекул растворенного
вещества в растворе
(
),
к общему числу молекул растворенного
вещества в растворе
(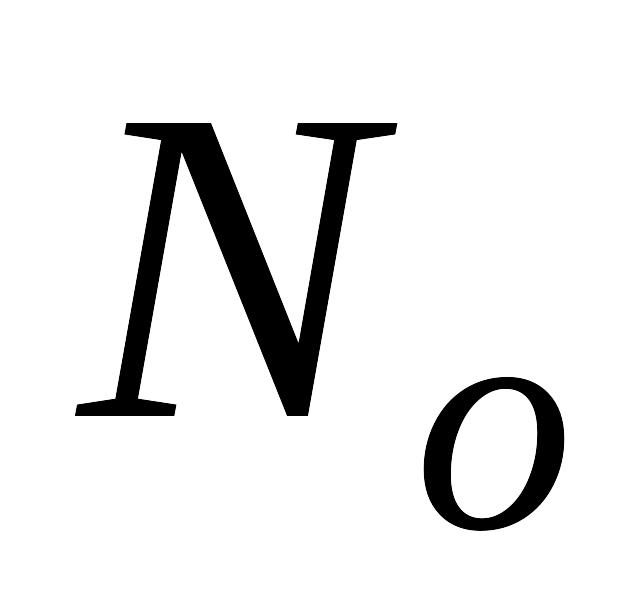 ):
):
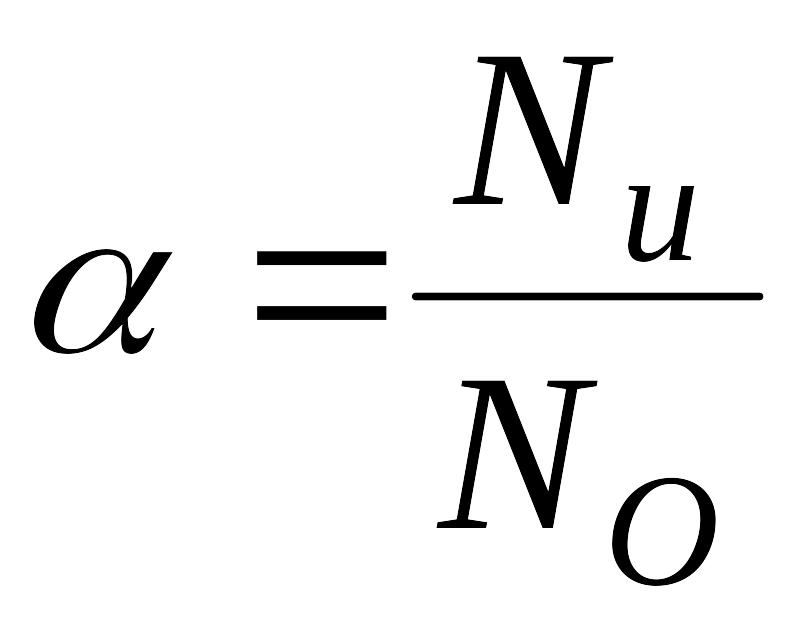
2)
константа
электролитической диссоциации
![]() – это константа химического равновесия
для процесса диссоциации электролита:
– это константа химического равновесия
для процесса диссоциации электролита:
![]() ;
;
![]()
Изотонический коэффициент (i) – это отношение суммы числа ионов и непродиссоциированных молекул электролитов к начальному числу молекул.
Изотонический
коэффициент показывает, во сколько раз
в растворе электролита возрастает общее
число частиц по сравнению с числом
молекул, введенных в раствор.Изотонический
коэффициент может быть выражен через
степень электролитической диссоциации
:![]()
15) Дисперсные системы. Классификация дисперсных систем. Особые свойства дисперсных систем.
Коллоидным называется такое состояние вещества, при котором хотя бы один из геометрических параметров не превышает 10‑6 м.
Если из трех параметров только один менее 10‑6 м, то такие системы называют пленками. Если два параметра менее 10‑6 м, то такие системы называют волокнами или нитями. Если все три параметра менее 10‑6 м, то такие системы называют просто дисперсными или коллоидными.
Коллоидное состояние достаточно широко распространено в природе. Дым, туман, пленка масла на воде, молоко, чай – все это примеры существования коллоидных систем.
Рассмотрим классификации коллоидных систем:
1.
В качестве меры измельчённости применяют
такой параметр как дисперсность d,
равный обратному радиусу
![]() .
По степени измельчённости выделяют
следующие системы.
.
По степени измельчённости выделяют
следующие системы.
2. По агрегатному состоянию дисперсионной среды коллоидные системы классифицируют следующим образом.
деление куба на 1000 частей приводит к десятикратному увеличению общей площади поверхности. При делении каждой из граней исходного куба в 10000 раз (L = 1 мкм) общая площадь поверхности увеличится в 10000 раз. Общую энергию тела можно выразить через суммарную энергию внутренних частиц и суммарную энергию поверхностных частиц
![]()
Для крупных частиц Uвнутр >> Uпов. При измельчении увеличивается общее число поверхностных частиц. Uвнутр почти не изменяется, а Uпов значительно возрастает. При определенной степени измельчения Uпов начинает вносить основной вклад в Uобщ. Размер частиц, с которых начинается резкое увеличение Uобщ и служит верхней границей существования коллоидных систем. Поскольку особые свойства коллоидных систем обусловлены высокой удельной площадью поверхности, то часто можно встретить термин «поверхностные явления» применительно к особым свойствам коллоидных систем.
