
- •8) Робочі газоподібні тіла поділяються на ідеальні та реальні. Одне й те ж робоче тіло відноситься до ідеального газу чи реального в залежності від термодинамічного ста-ну, в якому воно знаходиться.
- •1000 Молей. Введемо для кіломоля позначення , . Тоді добуток є об’ємом кіломолю газу , .
- •16) Розрізняють також істинні та середні теплоємкості.
- •20) Ізобарний, ізотермічний, ізохорний, адіабатний.
- •25) Поняття колового процесу чи циклу виникло в тд у зв’язку з вивченням процесів,
- •2 Розглянемо довільний прямий оборотний цикл , зображений на рисунку 5.
- •27) Ентропія є шостим параметром стану робочого тіла. Ентропія характеризує напря-
- •3 Введення поняття ентропії дозволяє застосувати для дослідження термодинаміч-них процесів нову (замість введеної раніше - діаграмі) прямокутну систему коор-
- •2 8) Ізохорним називають процес, який протікає при постійному об’ємі, його
- •29) Процес, який протікає при постійному тиску, називають ізобарним. Рівняння
- •30) Процес, який протікає при постійній температурі ( або , нази-
- •31) Адіабатним називається процес, який здійснюється без теплообміну між газом і зовнішнім середовищем. В такому процесі теплота не підводиться і не відводиться,
- •32) Розділення речовини на газ і пару умовне, бо між ними не існує будь - якої межі.
- •33) ) Розглянемо процес перетворення води в пару в Рv- координатах при деякому постійному тиску р. Нехай при даному тиску р 1 кг води з температурою 0 займає об’єм (точка а на рисунку 5).
- •34) Процес пароутворення в Тs – діаграмі
- •Питання 2 Зображення термодинамічних процесів водяної пари в Рv -, Тs - та і,s – діаграмах
- •3 Процеси змішування двох потоків.
- •41) Згідно закону Фур’є вектор щільності теплового потоку пропорційний вектору градієнту температури, але направле-ний в протилежний бік
- •42) Коефіцієнт теплопровідності, його залежність від різних факторів
- •43) Теплопровідність плоскої одношарової стінки
- •44) Теплопровідність багатошарової плоскої стінки
- •46) Теплопровідність циліндричної багатошарової стінки
- •51) Теплопередача крізь плоску стінку
- •52) Температури на зовнішніх поверхнях стінки і на межі двух будь - яких шарів у багатошаро-
- •53) 2 Теплопередача через циліндричну стінку
- •54) Для багатошарової циліндричної стінки відповідні формули мають вигляд
- •55) Особливістю променистого теплообміну є відсутність безпосереднього стикання тіл. Теплообмін може відбуватися при великій відстані від одного тіла до іншого.
- •Випромінювання.
- •57) Закон Планка встановлює зв’язок енергії власного випромі- нювання абсолютно чорного тіла з довжиною хвилі і температурою
Наука, яка займається дослідженням методів використання хімічної енергії палива, вивченням законів перетворення цієї енергії в теплову і механічну, вивчен-ням речовин, що беруть участь в цих перетвореннях (паливо, вода, продукти згорян-ня палива – димові гази, водяна пара, повітря тощо), називається теплотехнікою (ТТ). Теплотехніка
Термодинаміка (ТД) Теорія теплопередачі
(або теорія тепломасообміну)
Теоретичний розділ теплотехніки, в якому вивчаються закони перетворення і властивості теплової енергії, називається термодинамікою.
Теоретичний розділ теплотехніки, в якому займаються вивченням процесів безпосереднього використання теплоти, називається теорією теплопередачі.
Теплова енергія = теплота
Механічна енергія = робота
2) ТД умовно поділяється на хімічну і технічну. Хімічна ТД вивчає процеси, в котрих обмін енергією супроводжується зміною хімічного складу тіл.
Технічна термодинаміка (ТТД) – наука про властивості теплоти і закони взаємного перетворення теплоти і механічної роботи.
ТД вивчає закономірності процесів перетворення енергії в різних фізичних і хімічних процесах, це і є предметом ТТД. Дана дисципліна є основою вивчення і вдосконалення всіх теплових двигунів, компресорних, сушильних, холодильних установок тощо. Оскільки головним елементом з точки зору перетворення енергії в цих машинах є робоче тіло (наприклад, пара в паровій турбіні), то становлять інтерес і властивості робочих тіл.
Основою ТД як науки є 2 закони, отримані дослідним шляхом – перший і дру-гий закони ТД. Перший закон ТД встановлює кількісну міру при переході одного виду енергії в інший і є приватним випадком загального закону фізики збереження і перетворення енергії. Другий закон ТД має більш обмежений характер і відносить
ся до тіл, які мають кінцеві розміри, але складаються з великої кількості атомів і молекул. Закон встановлює напрямок теплових процесів, які протікають в природі, та умови перетворення теплоти в роботу.
Використовуючи основні закони, ТТД досліджує процеси, які протікають в теплових двигунах, і встановлює найбільш економічні умови їх роботи.
2 Робочим тілом є допоміжна речовина, яка використовується для роботи тієї чи іншої теплової машини (теплового двигуна, холодильної установки, теплового насо-су). Робоче тіло – частіше за все газ, котрий при взаємодії з зовнішнім середовищем змінює свій стан.
Фізичні
макроскопічні величини, які характеризують
стан робочого тіла, нази-ваються
термодинамічними
параметрами стану (або
просто параметрами
стану). Основними
параметрами стану є: абсолютний
тиск
 ,
питомий об’єм
v, абсо-лютна
температура Т.
Ці параметри визначають
стан газу в стані
рівноваги, тобто коли
в будь – який момент часу
,
v і
Т по всій масі газу будуть мати одні й
ті ж значення.
,
питомий об’єм
v, абсо-лютна
температура Т.
Ці параметри визначають
стан газу в стані
рівноваги, тобто коли
в будь – який момент часу
,
v і
Т по всій масі газу будуть мати одні й
ті ж значення.
3)
Тиск
газу
є середнім результатом ударів великої
кількості часток (молекул або атомів)
об стінки посудини, де знаходиться
робоче тіло. Тиск вимірюється силою,
що приходиться на одиницю поверхні
тіла і направлена до неї перпендикулярно.
Позначається Р, в системі СІ виміряється
паскалем (Па) – силою в один ньютон на
площі в один квадратний метр, тобто
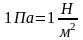 .
.
Ця одиниця тиску дуже мала, і тому на практиці застосовуються інші одиниці:
 (кілопаскаль);
(кілопаскаль);
 (мегапаскаль).
(мегапаскаль).
В техніці також застосовуються позасистемні одиниці вимірювання:
1) мм рт.
ст. (мм ртутного стовпчика).
 ;
;
2) мм вод.
ст. (мм водяного стовпчика)
 ;
;
3) бар.
 ;
;
4) технічна
атмосфера (ат), яка є дією кілограм –
сили (кгс)
на площу в

 Па;
Па;
5) фізична атмосфера (атм), яка дорівнює середньому тиску атмосферного повітря на рівні моря. Ця величина складає
 .
.
Фізична атмосфера приймається як деякий стандартний тиск і називається нормальним тиском. В системі СІ нормальний тиск дорівнює:

Тиск
атмосферного повітря виміряється
барометром і називається баромет-ричним
або
атмосферним
 .
Величина тиску газу, яка перевищує
атмосферний і вимірюється манометром,
називається манометричним
або надлишковим
.
Величина тиску газу, яка перевищує
атмосферний і вимірюється манометром,
називається манометричним
або надлишковим
 .
Величина тиску газу, яка менше атмосферного
і вимірюється вакуумметром, нази-вається
вакуумметричним
або розрідженням
.
Величина тиску газу, яка менше атмосферного
і вимірюється вакуумметром, нази-вається
вакуумметричним
або розрідженням
 .
.
Надлишковий і вакуумметричний тиски не є параметрами стану, бо при одно-му і тому ж тиску газу в посудині (абсолютному) показання манометру і вакууммет-ру будуть різними в залежності від атмосферного тиску повітря в момент вимірю-вання.
Параметром
стану є абсолютний
тиск газу
,
який може бути знайдений по одній з
двох формул. Розглянемо прилад, який
складається з посудини А, що на- повнена
газом із абсолютним тиском
,
і U – подібної
трубки, частково заповне-ної рідиною
(рисунок 1). З лівого боку на рідину діє
абсолютний тиск газу, а з пра-вого боку
– атмосферний тиск повітря. Якщо
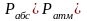 ,
то рідина буде переміщатися в трубці
зліва направо до тих пір, поки стовпчик
рідини, який утворився, висотою
,
то рідина буде переміщатися в трубці
зліва направо до тих пір, поки стовпчик
рідини, який утворився, висотою
 врівноважить різниця тисків
врівноважить різниця тисків
 В цьому випадку прилад показує, наскільки
тиск газу в посудині А більше атмосферного,
тобто надлишковий тиск. Тому
В цьому випадку прилад показує, наскільки
тиск газу в посудині А більше атмосферного,
тобто надлишковий тиск. Тому
 -
абсолютний тиск газу в посудині дорівнює
сумі показань (1)
-
абсолютний тиск газу в посудині дорівнює
сумі показань (1)
барометру і манометру.
Якщо
 ,
тоді рідина в правому коліні трубки
опуститься, а в лівому під-німеться і
займе положення, показане на рисунку
2. В цьому випадку прилад пока-зує,
наскільки тиск газу в посудині А менше
атмосферного, і висота стовпчика
ви-значає вакуумметричний тиск
.
Значить,
,
тоді рідина в правому коліні трубки
опуститься, а в лівому під-німеться і
займе положення, показане на рисунку
2. В цьому випадку прилад пока-зує,
наскільки тиск газу в посудині А менше
атмосферного, і висота стовпчика
ви-значає вакуумметричний тиск
.
Значить,
 - абсолютний тиск газу в
посудині дорівнює різниці показань
(2)
- абсолютний тиск газу в
посудині дорівнює різниці показань
(2)
барометру і вакуумметру.

Рисунок 1 – Вимірювання надлишкового Рисунок 2 – Вимірювання розрідження
тиску рідинним манометром (вакууму) рідинним
( ) вакуумметром ( )
Показання
ртутних приладів тиску змінюються в
залежності від температури ртуті
внаслідок її розширення із підвищенням
температури. Тому показання баро-метру
(манометру, вакуумметру), визначені
висотою ртутного стовпчика, приво-дяться
до
 ,
для чого використовується рівняння
,
для чого використовується рівняння
 ,
(3)
,
(3)
де
 - показання барометру, приведене до
,
мм рт. ст;
- показання барометру, приведене до
,
мм рт. ст;
 - дійсна висота
- дійсна висота
ртутного
стовпчика барометру при температурі

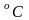 ,
мм рт. ст;
,
мм рт. ст;
0,000172 – коефіцієнт об’ємного розширення ртуті.
4) Температура є мірою теплового стану або ступеня нагрітості тіла, наприклад газу. З фізики відомо, що температура газу змінюється пропорційно середній кінетичній енергії поступального руху молекул. Чим вища температура, тим більша швидкість руху молекул.
Температура тіла збільшується або зменшується в залежності від того, одер-жує чи віддає це тіло теплоту. Тіла, які мають однакову температуру, знаходяться в тепловій рівновазі, тобто не передають теплоту одне іншому.
При нагріванні тіла розширюються, тобто збільшуються в об’ємі. Цю обста-вину враховують при конструюванні котлів і будові обмурівки, а при проектуванні трубопроводів різного призначення, які можуть опинитися під дією температур-них подовжень, передбачають установку спеціальних компенсаторів.
Одиницею вимірювання температури є градус. В техніці температура вимірю-ється по Міжнародній стоградусній шкалі (шкалі Цельсію) і позначається , . В цій шкалі при нормальному тиску (760 мм рт. ст.) стану льоду, котрий розтає, відпо-відає температура , а точці кипіння чистої води – 100 .
Для
вимірювання температури використовується
також термодинамічна шкала температур
(шкала абсолютних температур, або шкала
Кельвіна). Нуль абсолютної шкали
температур відповідає значенню
 . Градус абсолютної шкали тем-ператур
носить назву кельвіна і позначається
через
. Градус абсолютної шкали тем-ператур
носить назву кельвіна і позначається
через
 .
Між двома температурами існують наступні
співвідношення
.
Між двома температурами існують наступні
співвідношення
 ,
К (4)
,
К (4)
 ,
(5)
,
(5)
Параметром стану
є абсолютний температура
 .
Температура вимірюється термометрами,
термопарами, пірометрами та іншими
приладами
.
Температура вимірюється термометрами,
термопарами, пірометрами та іншими
приладами
5) Питомим об’ємом називається об’єм 1 кг газу, він позначається v, тобто
 ,
,
 (6)
(6)
де
 - повний об’єм газу,
- повний об’єм газу,
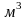 ;
;
 - маса газу,
- маса газу,
 .
.
6)
Щільністю
 називається маса газу, яка міститься в
одиниці об’єму, тобто
називається маса газу, яка міститься в
одиниці об’єму, тобто
 ,
,
 (7)
(7)
З формул (6) і (7) виходить, що питомий об’єм і щільність газу – величини взаємозворотні і їх добуток дорівнює одиниці:

 (8)
(8)
 або
або
 (9,10)
(9,10)
Слід
пам’ятати наступні
співвідношення:
 і
і
 .
.
7) Термодинамічна система – це сукупність матеріальних тіл і полів, які взаємоді-ють між собою і зовнішнім середовищем, тобто обмінюються енергією і речовиною.
Термодинамічна система, яка не обмінюється з зовнішнім середовищем ні енергією, ні речовиною, називається ізольованою або замкненою.
Якщо з плином часу параметри стану термодинамічної системи при постійних зовнішніх умовах не змінюються, то вона знаходиться в рівноважному стані.
Всяка зміна параметрів стану робочого тіла називається термодинамічним процесом, або просто процесом. Кожен процес здійснюється при тепловій і меха-нічній взаємодії робочого тіла з зовнішнім навколишнім середовищем, при цьому стан останнього також змінюється. При нескінченно повільній зміні стану зовніш-нього середовища процес буде здійснюватися з нескінченно малою швидкістю, внаслідок чого температура і тиск зовнішнього середовища і робочого тіла в кожен момент будуть розрізнятися на нескінченно малу величину. При здійсненні такого процесу можна вважати, що температура і тиск по всій масі робочого тіла (яким частіше за все є газ) будуть мати одне й те ж значення і, отже, газ знаходиться в рів-новажному стані.
Термодинамічний процес, який складається з безперервного ряду рівноважних станів, називається рівноважним.
При
вивченні термодинамічних процесів
використовується їх графічне зобра-ження
в різних координатних системах, зокрема,
в системі координат
 і
і
 ,
яка на-зивається
,
яка на-зивається
 діаграмою. По осі ординат відкладаються
абсолютні тиски, а по осі абсцис – питомі
об’єми газу. При заданих
і
рівноважний стан зображується точ-кою,
а рівноважний процес – в загальному
випадку кривою лінією.
діаграмою. По осі ординат відкладаються
абсолютні тиски, а по осі абсцис – питомі
об’єми газу. При заданих
і
рівноважний стан зображується точ-кою,
а рівноважний процес – в загальному
випадку кривою лінією.
З образимо
в
діаграмі довільний рівноважний процес
лінією 1-2 (рису-
образимо
в
діаграмі довільний рівноважний процес
лінією 1-2 (рису-
нок 3). З графіку видно, що при переході газу з
початкового стану 1 в кінцевий 2 відбувається
зниження тиску і збільшення питомого об’єму.
Це є процес розширення газу, який вважається
прямим процесом. Зворотним процесом вва-
жається процес стиснення газу, коли він із 2
переходить в початковий стан 1; при цьому від-
бувається зменшення питомого об’єму і підви-
вищення тиску.
Рисунок 3 – Зображення оборотного
процесу
Характерною властивістю рівноважних процесів є їх оборотність. Це озна-чає, що якщо при розширенні з стану 1 газ проходить через проміжні рівноважні стани а, в, с, f, m (рисунок 3), то при зворотному процесі стиснення з стану 2 газ пройде через ті ж стани, але в зворотній послідовності m, f, c, в, а і повернеться в початковий стан 1.
У зв’язку з цим рівноважні процеси називаються оборотними процесами.
Вищезазначене дозволяє зробити висновок, що в результаті протікання спо-чатку прямого, а потім зворотного рівноважних процесів в термодинамічній системі „робоче тіло – довкілля” ніяких змін не відбудеться.
Рівноважні оборотні процеси є ідеальними процесами, які в першу чергу роз-глядаються термодинамікою (ТД).
Усі реальні процеси протікають з великою швидкістю і при наявності кінцевої різниці температур і тисків між газом і зовнішнім середовищем. Тому ці процеси бу-дуть нерівноважними і, отже, необоротними. Вивчати реальні необоротні процеси важко, і тому ТД вивчає тільки теоретичні оборотні процеси. Це виправдовується та-кож і тим, що частіше за все на практиці відхилення реальних процесів від ідеальних незначне і не приймається до уваги. У випадку великих відхилень перехід від ідеаль-них процесів до реальних здійснюється шляхом введення поправочних коефіцієнтів, отриманих на підставі досліду.
8) Робочі газоподібні тіла поділяються на ідеальні та реальні. Одне й те ж робоче тіло відноситься до ідеального газу чи реального в залежності від термодинамічного ста-ну, в якому воно знаходиться.
Реально існуючі гази складаються з атомів і молекул, які знаходяться в безпе-рервному хаотичному русі; між молекулами діють сили притягання і відштовху-вання, об’єм часток має кінцеву величину. Одначе дуже часто гази знаходяться в такому стані, коли сили взаємодії незначні, як й об’єм молекул, тому і тим, і іншим можна знехтувати.
Газ, у котрого відсутні сили взаємодії між молекулами, а їх об’єм у порівнянні з повним об’ємом, який займає газ, дорівнює нулю, називається ідеальним.
Введення поняття „ідеальний газ” має велике значення, бо дозволяє достатньо просто одержати аналітичні залежності, котрі описують його поведінку. Виявилося, що ці залежності в ряді випадків можуть бути застосовані до опису поведінки реаль-них газів. Такі гази, як кисень, водень, азот, повітря при відносно низьких тисках і високих температурах за своїми властивостями стають схожими до властивостей ідеального газу. Тому при термодинамічних дослідженнях процесів, які протікають в цих газах, використовують закони і рівняння стану ідеального газу. Введення по-няття ідеального газу полегшило завдання термодинамічних досліджень, дозволило отримати прості математичні рівняння для підрахунку різних фізичних величин, які характеризують зміну стану робочого тіла.
Закон
Бойля – Маріота. Якщо
постійна кількість газу (наприклад, 1
кг) при постійній температурі ( )
буде переходити з одного стану з
параметрами
)
буде переходити з одного стану з
параметрами
 ,
,
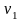 в інший - з параметрами
в інший - з параметрами
 ,
,
 ,
то його абсолютний тиск буде змінюватися
зворотно пропорційно питомому об’єму,
тобто
,
то його абсолютний тиск буде змінюватися
зворотно пропорційно питомому об’єму,
тобто
 або
або
 (11,12)
(11,12)
Отже, при постійній температурі добуток абсолютного тиску на питомий об’єм даної маси газу є величина постійна.
Закон
Гей – Люсака. Якщо
нагрівати або охолоджувати постійну
кількість газу (наприклад, 1 кг) при
постійному тиску ( )
, то питомий об’єм газу змінюється прямо
пропорційно його абсолютній температурі,
тобто
)
, то питомий об’єм газу змінюється прямо
пропорційно його абсолютній температурі,
тобто
 (13)
(13)
Закон Авогадро. В рівних об’ємах різних газів міститься однакова кількість молекул, якщо ці гази будуть мати однакові абсолютні тиски і температури.
З закону
Авогадро витікає, що при однакових
абсолютних температурах і тис-ках
щільність газів пропорційна їх
молекулярним масам
 ,
тобто
,
тобто
 (14)
(14)
Через те що,
,
 , звідки
, звідки
 (15)
(15)
Кількість газів в грамах, яка дорівнює числу одиниць молекулярної маси, на-зивається молем.
Моль визначається як кількість речовини, яка містить стільки ж молекул, скільки міститься атомів в вуглецю – 12 масою 0,012 кг. Один кіломоль містить
