
- •1.Предмет физики. Методы физ. Исследования . Механика .Три раздела механики.
- •Закон изменения момента импульса.
- •20.Консервативные и неконсервативные силы.
- •26.Закон сохранения импульса. Абсолютно неупругий удар.
- •27.Абсолютно упругий удар
- •28.Закон сохранения момента импульса. Законы сохранения в механике
- •36.Вязкость . Ламинарное и турбулентное движение жидкости.
- •37.Формула Пуазейля.
- •38.Молекулярная физика. Статические и термодинамические методы методы исследования .Термодинамические параметры.
- •39.Уравнение состояния идеального газа. Закон Дальтона.
- •40.Молекулярно-кинетическая теория газов (мкт) .Уравнение мкт идеального газа.
- •41.Закон равномерного распределения энергии по степеням свободы.
- •42.Внутренняя энергия системы.
- •43.Первое начало термодинамики.
- •44. Работа газа при изменение его объема.
- •45. Классическая теория теплоемкости газа.
- •52.Круговой процесс. Цикл Карно. Прямой и обратный цикл Карно.
42.Внутренняя энергия системы.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
Так
как в одном киломоле содержится ![]() молекул,
то внутренняя энергия одного киломоля
газа будет
молекул,
то внутренняя энергия одного киломоля
газа будет![]() Учитывая, что
Учитывая, что ![]() ,
получим
,
получим
![]() Для любой массы m газа, т.е. для любого
числа киломолей
Для любой массы m газа, т.е. для любого
числа киломолей ![]() внутренняя
энергия
внутренняя
энергия
|
(10.12) |
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю. Математически это записывается в виде тождества
43.Первое начало термодинамики.
Это
закон сохранения и превращения энергии
применительно к термодинамическим
процессам. Теплота ,сообщаемая системе,
расходуется на изменение ее внутренней
энергии и на совершение ею работы против
внешних сил. Q= где Q-
кол-во теплоты сообщенное системе или
отданное ею.
где Q-
кол-во теплоты сообщенное системе или
отданное ею.
 - изменение внутрен энергии. A
– работа системы против внешних сил.
- изменение внутрен энергии. A
– работа системы против внешних сил.
В
диффер форме.

Вечный двигатель первого рода – периодически действующий двигатель, который совершал бы работу большую , чем сообщенная ему извне энергии.
Еще одна формулировка первого начала термодинамики –вечный двигатель первого рода невозможен.
44. Работа газа при изменение его объема.
Будем
искать выражение в общем виде для внешней
работы, которую совершает газ при
изменении его объема. Рассмотрим,
например, газ, который находится под
поршнем в цилиндрическом сосуде (рис.
1). Если газ, расширяясь, передвигает
поршень на бесконечно малое расстояние
dl,
то он осуществляет над
ним работу
![]() где
S — площадь поршня, Sdl=dV—
изменение объема газа. Таким образом,
где
S — площадь поршня, Sdl=dV—
изменение объема газа. Таким образом,
![]() (1)
Полную
работу А, которую совершает газ при
изменении его объема от V1 до
V2,
найдем интегрированием формулы (1):
(1)
Полную
работу А, которую совершает газ при
изменении его объема от V1 до
V2,
найдем интегрированием формулы (1):
![]() (2)
Результат
интегрирования зависит от вида зависимости
между давлением и объемом газа. Найденное
для работы выражение (2) справедливо при
любых изменениях объема твердых, жидких
и газообразных тел.
Осуществленную
в том или ином процессе работу можно
изобразить графически с помощью кривой
в координатах р, V. Пусть, например,
изменение давления газа при его расширении
изображается кривой на рис. 2. При
увеличении объема на dV совершаемая
газом работа равна pdV, т. е. определяется
площадью полоски с основанием dV, которая
заштрихована на рисунке. Значит полная
работа, которая совершается газом при
расширении от объема V1 до
объема V2,
определяется площадью, ограниченной
осью абсцисс, кривой p=f(V) и прямыми V1 и
V2.
(2)
Результат
интегрирования зависит от вида зависимости
между давлением и объемом газа. Найденное
для работы выражение (2) справедливо при
любых изменениях объема твердых, жидких
и газообразных тел.
Осуществленную
в том или ином процессе работу можно
изобразить графически с помощью кривой
в координатах р, V. Пусть, например,
изменение давления газа при его расширении
изображается кривой на рис. 2. При
увеличении объема на dV совершаемая
газом работа равна pdV, т. е. определяется
площадью полоски с основанием dV, которая
заштрихована на рисунке. Значит полная
работа, которая совершается газом при
расширении от объема V1 до
объема V2,
определяется площадью, ограниченной
осью абсцисс, кривой p=f(V) и прямыми V1 и
V2.
45. Классическая теория теплоемкости газа.
В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости. Теплоемкость - количество теплоты необходимое для нагревания тела на один Кельвин
![]()
Удельной
теплоемкостью называется величина,
числено равная теплоте, которую надо
сообщить единице массы тела для повышения
его температуры на один Кельвин:
![]()
Отсюда
можно определить количество теплоты,
необходимое для нагревания вещества,
массы m![]()
Молярная
теплоемкость - количество тепла
необходимое для нагревания одного моля
вещества на один Кельвин
Воспользовавшись
I законом термодинамики выражение (9.11)
можно переписать в виде![]()
откуда следует, что теплоемкость есть функция процесса, т.е. теплоемкость системы зависит от того каким образом система переходит из одного состояния в другое. Вообще говоря, таких процессов может быть сколько угодно, фактически же используются чаще всего теплоемкость при р=const(Cp) и при V=const(CV).
46.Изохорный процесс.
Первое
начало термодинамики![]() Так
как при изохорическом процессе работа
не совершается
Так
как при изохорическом процессе работа
не совершается

![]() первое
начало термодинамики приобретает
следующий вид:
первое
начало термодинамики приобретает
следующий вид:![]() т.е.
при изохорическом процессе вся подводимая
к газу теплота затрачивается на увеличение
внутренней энергии системы. Теплоемкость
т.е.
при изохорическом процессе вся подводимая
к газу теплота затрачивается на увеличение
внутренней энергии системы. Теплоемкость
![]()
47.Изобарный .
При
изобарическом процессе элементарная
работа.![]() Работа
системы при изменении объема от V1 до
V2 определяеться
следующим выражением (рис.9.5)
Работа
системы при изменении объема от V1 до
V2 определяеться
следующим выражением (рис.9.5)
Уравнение
первого начала термодинамики имеет
вид![]() Следовательно,
теплота, переданная газу при изобарическом
процессе, затрачивается на увеличение
его внутренней энергии и совершение
работы. Из (9.16) следует, что для одного
моля газа:
Следовательно,
теплота, переданная газу при изобарическом
процессе, затрачивается на увеличение
его внутренней энергии и совершение
работы. Из (9.16) следует, что для одного
моля газа:
![]()

В
свою очередь ![]() .
Подставляя эти уравнения в первое начало
термодинамики получим
.
Подставляя эти уравнения в первое начало
термодинамики получим
![]() По
определению изобарическая молярная
теплоемкость
По
определению изобарическая молярная
теплоемкость![]() откуда
откуда![]()
Подставляя последнее в уравнение первого начала термодинамики, получим
|
(9.17) |
Определим
давление Р из уравнения состояния
идеального газа для одного моля газа
получаем:![]() Продифференцируем
по всем параметрам:
Продифференцируем
по всем параметрам:![]() т.к.
pv= const, то dP = 0 и уравнение состояния газа
имеет вид:
т.к.
pv= const, то dP = 0 и уравнение состояния газа
имеет вид:![]() Подставим
последнее в (9.17)
Подставим
последнее в (9.17)![]() или
или
|
(9.18) |
Последнее соотношение называется уравнением Майера.
48.Изотермический
При
изотермическом процессе (Т=const) dT=0 и
изменение внутренней энергии dU=0. Согласно
первому началу термодинамики теплота
δQ, передаваемая газу, полностью
затрачивается на внешнюю работу ![]() .
.
 Работа
системы численно равны (как известно)
площади под графиком процесса в
координатах P:V (рис. 9.6) Аналитическое
выражение для работы следующие:
Работа
системы численно равны (как известно)
площади под графиком процесса в
координатах P:V (рис. 9.6) Аналитическое
выражение для работы следующие: Определим
из уравнения Менделеева - Клапейрона
Р:
Определим
из уравнения Менделеева - Клапейрона
Р:![]() и
подставим в уравнение работы
и
подставим в уравнение работы
|
49. Адиабатический.
Адиабатический
процесс - это такое изменение состояний
газа, при котором он не отдает и не
поглощает извне теплоты. Следовательно,
адиабатический процесс характеризуется
отсутствием теплообмена газа с окружающей
средой. Адиабатическими можно считать
быстро протекающие процессы. Так как
передачи теплоты при адиабатическом
процессе не происходит, то ![]() и
уравнение I начала термодинамики
принимает вид
и
уравнение I начала термодинамики
принимает вид![]()
![]() а
величину
а
величину ![]() найдем
из уравнения Менделеева - Клапейрона
найдем
из уравнения Менделеева - Клапейрона![]() Таким
образом,
Таким
образом,
![]() или,
учитывая, что для идеального
газа
или,
учитывая, что для идеального
газа ![]()
![]() Разделим
обе части этого уравнения
на
Разделим
обе части этого уравнения
на ![]()
![]() где
где ![]() безразмерная
величина, называемая постоянной адиабаты.
Пренебрегая зависимостью
безразмерная
величина, называемая постоянной адиабаты.
Пренебрегая зависимостью ![]() от
температуры, можно считать, что для
данного газа
от
температуры, можно считать, что для
данного газа ![]() .
Интегрируя последнее уравнение
.
Интегрируя последнее уравнение
![]() получим
получим![]() т.е.
т.е.
|
(9.21) |
Это
выражение называют уравнением Пуассона.
Соотношение между давлением и температурой,
а также между объемом и температурой
идеального газа в адиабатическом
процессе имеют вид![]() Эти
соотношения легко получить из (9.21),
пользуясь уравнением Менделеева -
Клапейрона. Линию, изображающую
адиабатический процесс в диаграмме
состояния, называют адиабатой. На рис.
9.7 сплошной линией показан вид адиабаты
в (P-V) диаграмме. Для сравнения в том же
рисунке пунктирной линией изображена
изотерма, соответствующая температуре
газа в начальном состоянии 1. Так как
для любого идеального газа показатель
адиабаты
Эти
соотношения легко получить из (9.21),
пользуясь уравнением Менделеева -
Клапейрона. Линию, изображающую
адиабатический процесс в диаграмме
состояния, называют адиабатой. На рис.
9.7 сплошной линией показан вид адиабаты
в (P-V) диаграмме. Для сравнения в том же
рисунке пунктирной линией изображена
изотерма, соответствующая температуре
газа в начальном состоянии 1. Так как
для любого идеального газа показатель
адиабаты ![]() ,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
 Работу,
совершаемую газом в адиабатическом
процессе, найдем интегрируя выражение
Работу,
совершаемую газом в адиабатическом
процессе, найдем интегрируя выражение![]() Полная
работа
Полная
работа![]() Из
уравнения Майера (9.18) и выражения
Из
уравнения Майера (9.18) и выражения ![]() для
показателя адиабаты γ следует, что
для
показателя адиабаты γ следует, что![]()
50.Политропный . Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где величина ![]() называется
показателем политропы.
называется
показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
4.
Изохорный процесс: ![]() ,
так как
,
так как ![]() ,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1обратились
в 1, n должна быть бесконечность.
,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1обратились
в 1, n должна быть бесконечность.
51. Обратимые и необратимы термодинам процессы
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
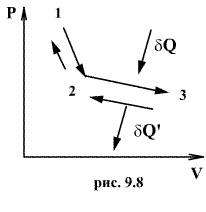
Обратимый
процесс обладает следующими свойствами:
если при прямом ходе на каком-то
элементарном участке (рис. 9.8.) система
получает тепло ![]() и
совершает работу
и
совершает работу ![]() ,
то при обратном ходе на том же участке
система отдает тепло
,
то при обратном ходе на том же участке
система отдает тепло ![]() и
над ней совершается работа
и
над ней совершается работа ![]() .
По этой причине после протекания
обратимого процесса в одном, а затем в
обратном направлении и возвращение
системы в первоначальное состояние в
окружающих телах не должно оставаться
никаких изменений. Например шарик на
пружине в вакууме колеблется бесконечно
долго. В
том случае, когда после завершения
прямого и обратного процессов система
вернулась в первоначальное состояние
и в окружающей среде остались изменения,
процесс является необратимым. Очевидно,
что все процессы в природе необратимые.
.
По этой причине после протекания
обратимого процесса в одном, а затем в
обратном направлении и возвращение
системы в первоначальное состояние в
окружающих телах не должно оставаться
никаких изменений. Например шарик на
пружине в вакууме колеблется бесконечно
долго. В
том случае, когда после завершения
прямого и обратного процессов система
вернулась в первоначальное состояние
и в окружающей среде остались изменения,
процесс является необратимым. Очевидно,
что все процессы в природе необратимые.


