
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Машиностроительный факультет
Кафедра “Интеллектуальные системы”
Курсовая работа
по дисциплине: «Технологии микро-наносистемной техники»
Тема: «Использование переходных металлов и их соединений в технологии сенсорных микро-наносистем»
Выполнил: студент группы 103718
Филатов А.В.
Руководитель: Гулай В.А.
Минск 2011
Содержание
Введение……………………………………………………………………….. .3
1. Принцип работы тиристоров ……………………………………………..…4
1.1. Тиристор в цепи постоянного тока ………………………………….……6
1.2. Тиристор в цепи переменного тока ………………………………….……7
1.3. Устройство и основные виды тиристоров …………………………..……9
1.4. Вольтамперная характеристика тиристора ………………………………10
1.5. Режим прямого запирания ……………………………………………...…11
1.6. Двухтранзисторная модель ………………………………………….….…11
1.7. Защита тиристоров ……………………………………………………..…..13
2. Характеристики и параметры тиристоров ………………………….…...…14
Список используемых источников…………………………………….…….... 22
Введение
Настоятельная необходимость отслеживать все аспекты состояния окружающей среды в реальном времени постоянно растет, и это вызвано возрастающими связями загрязнения окружающей среды с нашим здоровьем и безопасностью. Необходимо также иметь возможность определять содержание основных компонентов и примесей в различных средах. Именно поэтому можно сказать, что целью всей современной аналитической химии является снижение пределов обнаружения и повышение точности и надежности анализа. Современные приборы в аналитической химии становятся настолько сложными, что позволяют нам определять химические вещества в количествах меньших, чем это можно было бы даже представить всего несколько лет назад. Результаты контроля состояния окружающей среды показывают, что необходимо определять как основные, так и побочные продукты химической промышленности во всех областях окружающей нас среды.
Следствием столь насущной потребности в мониторинге всего, что нас окружает, является вовлечение огромной энергии и ресурсов в разработку сенсоров широкого спектра действия. Конечным результатом этой работы будет обеспечение нас однажды портативными, миниатюрными и интеллектуальными воспринимающими устройствами для мониторинга практически всего, что бы мы ни пожелали. Например, если речь идет о нашем здоровье, то в будущем можно представить себе, что у каждого из нас будет такое самодиагностирующее устройство размером с кредитную карточку со встроенными в него разнообразными химическими и биосенсорами, которое позволит нам в любой момент узнать все о состоянии нашего здоровья. Например, человеку нездоровится. Чтобы узнать причину, ему достаточно будет просто лизнуть чувствительную поверхность своего диагностического устройства - и немедленно на жидкокристаллическом дисплее загорится сообщение: “У Вас обнаружен вирус гриппа, примите аспирин и отдохните”.
Что касается мониторинга окружающей среды, то легко представить себе простые устройства, которые можно было бы использовать, скажем, для проверки загрязненности природных вод тяжелыми металлами или для обнаружения бактерий в питьевой воде, в бассейнах или на пляжах. Такими устройствами можно было бы снабдить ванны для проверки качества воды перед купанием. Конечно, это преувеличение - на самом деле наши возможности определяются химией, физикой и электроникой таких устройств, а также техническими возможностями конкретного времени. Не следует упускать из виду тот факт, что возможности всех этих воспринимающих устройств определяются в первую очередь уровнем развития фундаментальной науки. Разработка сенсоров является результатом совместных усилий химиков, биологов, физиков и инженеров-электронщиков и представляет собой поистине междисциплинарную область.
Все сенсоры можно разделить на две большие группы. Это физические сенсоры, реагирующие на такие параметры, как температура, давление, магнитное поле и силы, не являющиеся предметом исследования химии.
Датчик, сенсор (от англ. sensor) — термин систем управления, первичный преобразователь, элемент измерительного, сигнального, регулирующего или управляющего устройства системы, преобразующий контролируемую величину в удобный для использования сигнал. [1]
В настоящее время различные датчики широко используются при построении систем автоматизированного управления.Содержание [убрать]
Общие сведения
Датчики являются элементом технических систем, предназначенных для измерения, сигнализации, регулирования, управления устройствами или процессами. Датчики преобразуют контролируемую величину (давление, температура, расход, концентрация, частота, скорость, перемещение, напряжение, электрический ток и т. п.) в сигнал (электрический, оптический, пневматический), удобный для измерения, передачи, преобразования, хранения и регистрации информации о состоянии объекта измерений.
Исторически и логически датчики связаны с техникой измерений и измерительными приборами, например термометры, расходомеры, барометры, прибор «авиагоризонт» и т. д. Обобщающий термин датчик укрепился в связи с развитием автоматических систем управления, как элемент обобщенной логической концепции датчик — устройство управления — исполнительное устройство — объект управления. Специальный случай представляет использование датчиков в автоматических системах регистрации параметров, например, в системах научных исследований.
[править]
Определения понятия датчик
Широко встречаются следующие определения:
чувствительный элемент, преобразующий параметры среды в пригодный для технического использования сигнал, обычно электрический, хотя возможно и иной по природе, например — пневматический сигнал;
законченное изделие на основе указанного выше элемента, включающее, в зависимости от потребности, устройства усиления сигнала, линеаризации, калибровки, аналого-цифрового преобразования и интерфейса для интеграции в системы управления. В этом случае чувствительный элемент датчика сам по себе может называться сенсором.
датчиком называется часть измерительной или управляющей системы, представляющая собой конструктивную совокупность измерительных преобразователей, включающую преобразователь вида энергии сигнала, размещенную в зоне действия влияющих факторов объекта и воспринимающий естественно закодированную информацию от этого объекта.
датчик – конструктивно обособленная часть измерительной системы, содержащая один или несколько первичных преобразователей, а также один или несколько промежуточных преобразователей.
Эти определения соответствуют практике использования термина производителями датчиков. В первом случае датчик это небольшое, обычно монолитное устройство электронной техники, например, терморезистор, фотодиод и т. п., которое используется для создания более сложных электронных приборов. Во втором случае — это законченный по своей функциональности прибор, подключаемый по одному из известных интерфейсов к системе автоматического управления или регистрации. Например, фотодиоды в матрицах (фото) и др. В третьем и четвертом определении акцент делается на том, что датчик является конструктивно обособленной частью измерительной системы, воспринимающей информацию, а следовательно обладающий самодостаточностью для выполнения этой задачи и определенными метрологическими характеристиками.
Применение датчиков
В последнее время в связи с удешевлением электронных систем всё чаще применяются датчики со сложной обработкой сигналов, возможностями настройки и регулирования параметров и стандартным интерфейсом системы управления. Имеется определённая тенденция расширительной трактовки и перенесения этого термина на измерительные приборы, появившиеся значительно ранее массированного использования датчиков, а также по аналогии — на объекты иной природы, например, биологические. Понятие датчика по практической направленности и деталям технической реализации близко к понятиям измерительный инструмент и измерительный прибор, но показания этих приборов в основном читаются человеком, а датчики, как правило, используются в автоматическом режиме.
Перехо́дные
мета́ллы
(перехо́дные
элеме́нты) —
элементы
побочных подгрупп Периодической
системы химических элементов
Д. И. Менделеева,
в атомах
которых появляются электроны
на d- и f-орбиталях. [1]
В общем виде электронное строение
переходных элементов
можно представить следующим образом:
![]() .
На ns-орбитали содержится один или два
электрона,
остальные валентные
электроны
находятся на
.
На ns-орбитали содержится один или два
электрона,
остальные валентные
электроны
находятся на
![]() -орбитали.
Поскольку число валентных
электронов
заметно меньше числа орбиталей, то
простые
вещества,
образованные переходными элементами,
являются металлами.
-орбитали.
Поскольку число валентных
электронов
заметно меньше числа орбиталей, то
простые
вещества,
образованные переходными элементами,
являются металлами.
Таблица переходных металлов |
||||||||||||||||||||||||||||||||||||||||||||||||
Группа → Период ↓ |
III |
IV |
V |
VI |
VII |
VIII |
I |
II |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
4 |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
||||||||||||||||||||||||||||||||||||||
5 |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
||||||||||||||||||||||||||||||||||||||
6 |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
||||||||||||||||||||||||||||||||||||||
7 |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
Лантаноиды * |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||||||||||||||||||||||||||||||||
Актиноиды ** |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|||||||||||||||||||||||||||||||||
|
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства: [2]
Небольшие значения электроотрицательности.
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
Формула соединения |
Характер соединения |
Mn(OH)2 |
Основание средней силы |
Mn(OH)3 |
Слабое основание |
Mn(OH)4 |
Амфотерный гидроксид |
H2MnO4 |
Сильная кислота |
HMnO4 |
Очень сильная кислота |
Для всех переходных элементов характерно образование комплексных соединений.
[Править] Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди [3]
Атомный номер |
Название, символ |
Электронная конфигурация |
Степени окисления |
p, г/см³ |
tпл, °C |
tкип, °C |
29 |
Медь Cu |
[Ar] 3d104s1 |
0, +1, +2 |
8,96 [4][5] |
1083 [4][5] |
2543 [4][5] |
47 |
Серебро Ag |
[Kr] 4d105s1 |
0, +1, +3 |
10,5 [6] |
960,8 [6] |
2167 [6] |
79 |
Золото Au |
[Xe] 4f145d106s1 |
0, +1, +3 |
19,3 [7] |
1063,4 [7] |
2880 [7] |
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
[Править] Медь
Основная статья: Медь

![]()
Металлическая медь в стеклянной пробирке
Медь представляет собой довольно мягкий металл красно-жёлтого цвета [10]. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
![]()
![]()
![]()
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II).
Для меди наиболее характерна степень окисления +2 [11], однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
[править] Оксид меди(II)
Основная статья: Оксид меди(II)

Оксид меди(II) в порошкообразной форме
Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
![]()
![]()
Растворы
всех солей
двухвалентной меди
окрашены в голубой цвет, который им
придают гидратированные ионы
![]() .
.
При действии на растворимые соли меди раствором питьевой соды образуется малорастворимый основной карбонат меди (II) — малахит:
![]()
[править] Гидроксид меди(II)
Основная статья: Гидроксид меди(II)

Свежеосаждённый гидроксид меди(II)
Гидроксид меди(II) Cu(OH)2 образуется при действии щелочей на соли меди(II) [12]:
![]()
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
![]()
При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
![]()
[править] Соединения одновалентной меди
Соединения
одновалентной меди
крайне неустойчивы, поскольку медь
стремится перейти либо в Cu2+,
либо в Cu0.
Стабильными являются нерастворимые
соединения CuCl, CuCN, Cu2S
и комплексы типа
![]() .
[13]
.
[13]
[править] Серебро
Основная статья: Серебро

Металлическое серебро в стеклянной пробирке
Серебро более инертно, чем медь[14] , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
![]()
Серебро растворяется в кислотах-окислителях:
![]()
![]()
![]()
Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl−, Br−, I−:
![]()
При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
![]()
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
![]()
![]()
![]()
[править] Золото
Основная статья: Золото

Золотой самородок
Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. [15] В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
![]()
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот ("царской водке"):
![]()
[править] Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
ОКСИ́ДНЫЕ ПОЛУПРОВОДНИКИ́, бинарные химические соединения, один из компонентов которых металл, а другой — кислород. К этому классу полупроводниковых материалов относятся такие вещества, как Cu2O, ZnO, CdO, NiO, Fe2O3, MnO, Mn3O4 и др.
Это соединения полярного типа с металлической и металлоидной компонентами, которые могут рассматриваться как ионные соединения. Полупроводниковыми свойствами обладают не все оксиды переходных металлов, а только те, в которых ион металла относится к элементам переходного ряда Периодической таблицы (Zn, Cu, Ni, Co, Fe, Mn, Cr, V, Ti).
Кроме оксидных полупроводников применяют и более сложные оксидные соединения (ZnFeO4, MnCr2O4), электропроводность которых можно подбирать, изменяя процентное соотношение компонентов.
Электропроводность оксидных полупроводников обусловлена наличием у ионов одного и того же металла не менее двух разновалентных состояний и связана с обменом электронами между этими ионами. Величина удельного сопротивления оксидных полупроводников лежит в пределах от 105 до 109 Ом.м. Присутствие примесей существенно влияет на электрические свойства.
Оксидные полупроводниковые материалы находят достаточно широкое применение. Основными материалами, используемыми при изготовлении сенсоров, являются полупроводниковые оксиды металлов (SnO2, WO3, ZnO, TiO2 и т. п). Поликристаллические полупроводники, такие как SnO2, ZnO, In2O3, широко используются в качестве активных элементов газовых сенсоров. Улучшение сенсорных свойств оксидных полупроводников: чувствительности, селективности и стабильности достигается путем их легирования различными металлами или оксидами металлов, или нанесением на их поверхность частиц благородных металлов. По аналогии с полевым транзистором металлические наночастицы играют роль затвора, управление которым происходит за счет адсорбции на нем анализируемых газов. Например, методом магнетронного распыления металла с последующим окислением изготавливают тонкие поликристаллические пленки SnO2, поверхностно легированные платиной. Поверхностное легирование платиной методом лазерной абляции существенно улучшает чувствительность по отношению к водороду и перспективно для создания высокочувствительных газовых сенсоров резистивного типа.
Технология получения оксидных полупроводниковых материалов относительно проста. Обычно эти материалы используют в виде поликристаллов, или изготавливают в виде спеченных материалов по керамической технологии.
Практическое применение получили смеси оксидов, на основе которых изготавливают терморезисторы, варисторы, выпрямители и другие приборы. Например, закись меди Cu2O используется для изготовления купроксных выпрямителей. Закись меди — типичный полупроводниковый материал с удельным сопротивлением от 10 до 107 Ом.м, величина которого зависит от термообработки. Имеет дырочный тип проводимости за счет избытка кислорода относительно стехиометрического состава. Для получения электронного типа проводимости используют диффузию меди.
Оксид цинка ZnO применяется в радиоэлектронике для изготовления самоактивированного люминофора ZnO:Zn, имеющего сине-зеленый цвет свечения. На основе порошкообразного оксида цинка получают комплексные соединения, используемые для изготовления варисторов и т. д.
Оксиды переходных металлов, таких как хром, кобальт, молибден, железо и никель, легко наносятся на носители всеми ранее описанными методами. [1]
Оксиды переходных металлов - CuO Cu2O, V2O5, в то время как другие оксиды неактивны или способствуют главным образом полному окислению. [3]
Оксиды переходных металлов - МпО, Ре, СоО, № О и др., а также N3 катализируют распад X. [4]
Основность оксидов переходных металлов в степени кислотными, так и окисления 2 увеличивается при движении слева основными и их направо по ряду. Для любого из металлов основностями оксидов уменьшается с увеличением степени окисления металла. На рис. 24.2 прямая линия ab приблизительно разделяет основные и кислотные оксиды. [5]
-

Температуры Пееля ( штпфгрромагнтног превращение и Кюри ( ферромагнитное превращение лантаноидов.
Для оксидов переходных металлов четвертого периода периодической системы характерны весьма заметные систематические изменения свойств с изменением порядкового номера и числа d - электронов. [6]
-

Состояния адсорбированного кислорода на металлах.
На оксидах переходных металлов, как и на самих металлах, активный кислород, обладая высокой окисляющей способностью, как правило, вызывает преимущественно глубокое окисление органических соединений. Если же активный кислород диффундирует в решетку оксидного катализатора, то такой кислород участвует в образовании продуктов селективного ( парциального) окисления. [7]
Некоторые соли и оксиды переходных металлов высших степенях окисления являются эффективными реагент ами сын-гидроксилирования двойной связи. [8]
Полупроводниковые материалы на базе оксидов переходных металлов должны иметь вполне определенную концентрацию вакансий, что достигается одним из способов управления дефекто-образованием. [9]
Полупроводниковые материалы на базе оксидов переходных металлов должны иметь вполне определенную концентрацию вакансий, что достигается одним из способов управления дефекто-образованием. [10]
-

Вольт-амперные характеристики термистора с сопротивлением R ( 293 К 830 кОм.
Термисторы изготовляют из смеси поликристаллических оксидов переходных металлов, например, MnO, CoO, NiO, CuO; легированных Ge и Si; SiC; полупроводниковых материалов типа А В; стеклообразных полупроводников и других материалов. [11]
Число тройных стеклообразующих систем с оксидами переходных металлов, в которых последние могут находиться в разновалентном состоянии, значительно больше ста. В последней группе систем области стеклообразования закономерно увеличиваются с ростом атомного номера элемента II группы от бериллия - к барию. В то же время область стеклообразования в последней группе систем с ZnO больше, чем с CdO, т.е. СС этих систем с оксидами элементов побочной подгруппы увеличивается в обратном направлении. Гречаник, Петровых, Карпе-ченко, изучившие эту большую группу систем, установили, что наибольшие области стеклообразования характерны для Я-элементов I, II и V групп. Если в качестве модификатора вводить элементы основных подгрупп I и II групп, то области стеклообразования расширяются с увеличением порядкового номера элемента. [12]
Диоксид титана способен образовать с оксидами переходных металлов твердые растворы. При этом искажается кристаллическая решетка и пигмент приобретает цветовой оттенок. Например, присутствие в диоксиде титана примеси Fe2O3 в количестве 0 3 % придает пигменту желтоватый оттенок, а присутствие Сг2О3 даже в количестве 0 015 % - коричнево-желтый оттенок. Другие оксиды придают пигменту серый, серо-голубой, синеватый оттенок. [1]
ТКС изготовляют из смеси лоли-кристаллич - оксидов переходных металлов ( напр. [2]
Окрашенные стекла получают добавлением незначительных количеств оксидов переходных металлов. Например, окись кобальта придает стеклу синюю окраску, окись хрома - зеленую, окись марганца - фиолетовую. [3]
Для получения цветных стекол в исходную шихту добавляют оксиды переходных металлов. Добавка какого оксида определяет: а) синий; б) фиолетовый; в) изумрудно-зеленый цвет стекла. Повышенной термической и химической стойкостью обладает силикатное стекло с добавкой буры. Такое стекло называется пирексом. [4]
Эффективными катализаторами полимеризации а-олефинов, диеновых и других мономеров служат оксиды переходных металлов, в частности активированные оксиды хрома и молибдена. Активность оксидно-хромовых и оксидно-молибденовых катализаторов обусловлена частичным восстановлением металлов при предварительно. [5]
Среди них наиболее широко применяются кондуктометриче-ские полупроводниковые сенсоры на основе оксидов переходных металлов. Принцип действия полупроводниковых сенсоров оксидного типа основан на изменении состояния поверхностной структуры полупроводника вследствие адсорбции газа на его поверхности. Электроны адсорбированных молекул газа взаимодействуют с электронами и дырками в кристаллической решетке, что приводит к изменению поверхностного заряда. При этом общее число поверхностных состояний, которые вносят вклад в формирование поверхностного заряда, зависит от состава и парциального давления компонентов газовой среды, окружающей полупроводник. Изменение поверхностного заряда вызывает изменение сопротивления полупроводника, которое легко измерить. [6]
Реакцию обычно проводят в газовой фазе с гетерогенными катализаторами из оксидов переходных металлов, чаще всего ванадия, молибдена, титана, при 500 - 550 С. Процессу способствуют пары воды, галогены, органические гало-генпроизводные и серусодержащие соединения. [7]
-

Кристаллическая структура WNb Oss.
Существование структур такого типа очень удобно для выяснения характера связи в оксидах переходных металлов. [8]
Среди стеклообразных полупроводниковых сплавов большую группу составляют оксидные полупроводники, в которые обязательно входят оксиды переходных металлов, способные находиться в сплаве в разновалентном состоянии. [9]
Применяемые для производства водорода и синтез-газа катализаторы в своем товарном виде в основном состоят из оксидов переходных металлов, которые в промышленных условиях должны подвергаться активации и перед началом эксплуатации требуют разогрева, восстановления или сульфидирования с последующим переводом на рабочий режим. [10]
Для исследования методом ЭПР, в силу присущих ему особенностей, наиболее пригодны катализаторы на основе парамагнитных оксидов переходных металлов. Для ряда катализаторов установлена корреляция каталитической активности с числом парамагнитных ионов определенного типа. [11]
Активными компонентами катализаторов окисления углеводородов являются металлы VIII и I побочной групп периодической системы, а также многие оксиды переходных металлов. На благородных металлах эта реакция очень легко ведет к полному окислению. В промышленной практике по экономическим соображениям предпочитают, где это возможно, использовать оксидные катализаторы. [12]
Показано, что аммониевые соли ванадиевой, молибденовой, вольфрамовой и хромовой кислот и образующиеся при их термораспаде оксиды переходных металлов являются катализаторами карбонизации гидратцвдлюяозы ( ГЦ), действуя как дегидратирующие агенты со смещением процессов термолиза ГЦ в область более низких температур и подавлением отщепления углеродсодержащих летучих соединений. [13]
Таким образом, в реакциях окисления на поверхности основных катализаторов образуется анион-радикал О, т.е. имеется аналогия с реакцией на оксидах переходных металлов, когда процесс окисления протекает с участием О2 и О [392], однако механизм образования этих анион-радикалов на сравниваемых катализаторах различен. [14]
Таким образом, в реакциях окисления на поверхности основных катализаторов образуется анион-радикал О, т.е. имеется аналогия с реакцией на оксидах переходных металлов, когда процесс окисления протекает с участием О и О [392], однако механизм образования этих анион-радикалов на сравниваемых катализаторах различен. [1]
-

Изменение каталитич. активности оксидов переходных металлов в р-цин обмена Н2 - В2.
Методами ИК-спектроскопии подтверждено, что в ряде р-ций с участием олефинов ( селективное окисление, полимеризация, диспропорционирование) на пов-сти оксидов переходных металлов с электронной конфигурацией катиона Л1 ( Мо5, V, Т13) образуются я-комплексы и я-аллильные комплексы типа I, где М - атом металла. [2]
В этих реакциях цеолиты с переходными элементами могут проявлять большую или меньшую активность и селективность, по сравнению, например, с оксидами переходных металлов. Однако какой-либо существенной специфики цеолитов при этом не наблюдается. [3]
В этих реакциях цеолиты с переходными элементами могут проявлять большую или меньшую активность и селективность, по сравнению, например, с оксидами переходных металлов. Однако какой-либо существенной специфики цеолитов при этом не наблюдается. [4]
Рассмотрены закономерности дисперсионного упрочнения ниобия, ванадия, тантала, хрома, молибдена, вольфрама и сплавов на их основе тугоплавкими карбидами, нитридами, оксидами переходных металлов четвертой группы. [5]
К магнитомягким относят металлические материалы: ферромагнитное чистое железо, низкоуглеродистые электротехнические стали ( нелегированные и кремнистые), магнитомягкие сплавы на железной и железоникелевой основе, в том числе аморфные металлические сплавы; магнитомягкие ферриты - комплексные оксиды переходных металлов, содержащие группу Ре2Оз; магнитодиэлектрики - композиты на основе порошка магнитомягкого ферро - или ферри-магнетика в диэлектрической матрице. [6]
Оксиды металлов, являющиеся полупроводниками ( MgO, ZnO, CuO, Fe2O3, Сг2О3, WOs, MoO3, V2O5 и др.), или смеси оксидов, в том числе системы, содержащие фазы оксидов и их соединений, например хромиты ( СиО - Сг2Оз, ZnO - Cr2O3), мо-либдаты ( Bi2O3 - 2MoO3), вольфраматы ( CoO - WO3), ванадаты и др. В большинстве случаев они являются оксидами переходных металлов, причем в состав катализаторов часто входят оксиды, модифицирующие свойства контакта. [7]
Некоторые металлы образуют гомологические ряды оксидов, такие, как TinChn-i или Mon03n - i, со структурами, родственными структурам простых оксидов М02 и МОз. Многие оксиды переходных металлов имеют отклонения от стехиометрии и вследствие этого являются полупроводниками, другие оксиды обладают интересными магнитными и электрическими свойствами, которые интенсивно изучались в последние годы. Обсудим некоторые из этих свойств оксидов при более детальном рассмотрении выборочных систем металл - кислород; при этом будем отмечать особенности некоторых оксидов. [8]
Добавление оксидов переходных металлов в состав стекломассы окрашивает стекла и даже делает их непрозрачными. [9]
Экспериментальные данные показывают, что электрическая проводимость ферритов сильно возрастает, когда в эквивалентных кристаллографических положениях расположены разнова-лентные ионы одного и того же элемента. Применительно к оксидам переходных металлов впервые на это указал Вагнер. В дальнейшем этот вопрос на примере ферритов-шпинелей подробно изучен Вервеем и некоторыми другими исследователями. [10]
Весьма перспективным методом улучшения показателей пиролиза является применение гетерогенных катализаторов. В качестве катализаторов обычно используют оксиды переходных металлов или их композиции с оксидами щелочных или щелочноземельных металлов, осажденных на носители. В настоящее время наиболее отработанным в СССР является катализатор на основе KVO3 и различных промоторов, снижающих коксообра-зование. Этот катализатор, разработанный совместно МИНХиГП и ВНИИОСом, прошел полупромышленные испытания, которые показали, что катализатор может работать более двух месяцев без регенерации, не теряя при этом активности и при умеренном отложении кокса. При 780 С и времени контакта 0 1 - 0 2 с выход этилена составляет 37 - 40 % ( масс.), а суммы ненасыщенных углеводородов 58 - 62 % ( масс.) на сырье. Процесс каталитического пиролиза осуществляют в обогреваемых вертикальных трубах печей специальной конструкции. [11]
Очевидно, что вместе с изменением структуры электроны освобождаются от поляризационной связи и, как в обычном проводнике, экранируют электрическое поле. Такие фазовые переходы экспериментально наблюдаются в оксидах переходных металлов, низкоразмерных проводниках ( см. § 4.4) и в суперионных проводниках. В отличие от пробоя эти переходы в проводящее состояние обратимы. При этом нарушение устойчивой проводимости в отличие от пробоя также является обратимым. [12]
К сожалению, отмеченные особенности узкозонных магнитных полупроводников до сих пор практически не изучены. Наиболее полно из этого класса веществ исследованы оксиды переходных металлов. Ферриты же как более сложные магнитные соединения менее изучены и в настоящее время отсутствует единое толкование механизма проводимости в них. [13]
Под руководством Я. И. Герасимова начато изучение термодинамических свойств металлических сплавов сначала в жидком, а потом и в твердом состоянии. Существенно было расширено исследование кислородсодержащих систем, в том числе оксидов тугоплавких металлов и их соединений с оксидами щелочноземельных и переходных металлов, а также фаз переменного состава в оксидных, халькогенидных и металлических системах. Развитие этих работ тесно связано с совершенствованием экспериментальных методов термодинамики: метода гетерогенных равновесий, метода электродвижущих сил в нескольких вариантах и метода измерения давления насыщенного пара. [14]
Поры образуются в зернах Si N как трехмерные структуры. После приготовления керамика приводится в контакт с кислотой, в результате чего происходит по крайней мере частичное растворение и удаление компонентов, включенных в SisN таких как оксиды редкоземельных металлов, оксиды переходных металлов или BiiOi. Пористая керамика имеет чрезвычайно высокую устойчивость к кислотам и щелочам, высокую прочность и пригодна к использованию в качестве фильтров и каталитических устройств. [1]
В окислах переходных металлов в образовании валентной связи участвуют afs - электроны металлических элементов. А твердые тела, химические связи в которых возникают с участием ds - электронов хотя бы одного из компонентов, характеризуются заметной областью гомогенности уже при относительно низких температурах. Поэтому оксиды переходных металлов относятся к типичным полупроводникам за счет нарушения стехио-метрического состава. В окислах простых металлов за межатомную связь ответственны sp - электроны, в результате чего они проявляют свойства диэлектриков. Но поскольку разница между полупроводниками и диэлектриками не качественная ( см. гл. I), окислы простых металлов в условиях высоких температур становятся типичными полупроводниками. [2]
В окислительных процессах активны не только катализаторы основного типа. В многочисленных исследованиях была продемонстрирована возможность применения кислотного типа катализаторов в реакциях окисления различных веществ. Это близко к значениям энергии активации данной реакции на оксидах переходных металлов. [3]
Одной из причин потери каталитической активности является отложение углерода на катализаторе. Факторы, влияющие на отложение углерода, особенно в случае применения такого технологического сырья, как тяжелое масло процесса Коалкон, включают: соответствующее соотношение между гидрогенизационной и крекирующей активностями ( см. разд. Необходимое соотношение между гидрогенизационной и крекирующей активностями может быть установлено изменением относительных количеств компонентов: оксида переходного металла и твердых кислот. [4]
-
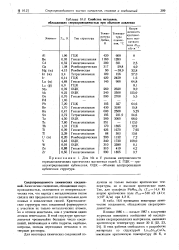
Свойства металлов, обладающих сверхпроводимостью при обычном давлении.
Химические соединения, обладающие сверхпроводимостью, отличаются от интерметаллических тем, что наряду с металлическим типом связи в них предполагается значительная доля ионных и ковалентных связей. Кристаллические структуры этих соединений формируются с участием не только металлических атомов, но и атомов неметалла, или с участием одних атомов неметаллов. В этой структуре кристаллизуется чрезвычайно большое число соединений, включающих в себя гидриты, карбиды, нитриды, оксиды переходных металлов и их твердые растворы. [5]
-

Схематическое представление плотности состояний N ( E для нормального ( а и ферромагнитного ( б металлов. EF - энергия Ферми.
Следует иметь в виду, что полосовая структура относится лишь к ab - плоскостям. Будучи скореллированными, полосы из разных аб-плоскостей уже сами образуют ас - или бс-плоскости с упорядочением соответствующего характера. Сказанное позволяет считать, что флуктуации стехиометрии допантов тоже могут и должны влиять на формирование периодического цепочечного ( полосового) упорядочения в оксидах переходных металлов. [6]
При первом предположении исходят из возможности образования кислород-углеродных комплексов при адсорбции кислорода на поверхности углерода. Роль катализатора в данном случае сводится к ускорению процессов образования или распада этих комплексов. При втором предположении катализатор рассматривают как переносчик кислорода между газовой фазой и углеродной матрицей путем попеременного окисления-восстановления катализатора. К такого типа катализаторам обычно относят оксиды переходных металлов. [7]
Нитриды
Нитриды переходных металлов
Так, в сконструирован метод производства тиглей из нитрида титана, метод приготовления тиглей из нитридов титана и циркония. Лодочки, изготовленные из сплавов системы Ti-В-N удачно применяются в качестве контейнеров для испарения алюминия при вакуумной металлизации.
Такие лодочки сильно стойки супротив коррозирующего поведения расплавленного алюминия и могут использоваться в течение некоторых дней, то что может дать потенциальность подготовить непрерывный ход металлизации оказались, пластмасс, бумаги. В качестве примера можно указать на высокие эксплуатационные качества фильер для текстильной индустрии (протяжки синтетических волокон), производимых лионской компанией Ж- Босюз (Франция).
Сии фильеры получаются карбонированием молибдена; поверхность насчитывает твердость 1400 Hv, а также по эксплуатационным свойствам они обгоняют стальные хромированные фильеры. По достоверным сведениям, хорошим материалом для выработки тиглей для испарения алюминия составляет композиция из 50% TiB2 и 50% BN, что довольно электропроводна, для того чтоб ее можно было нагревать токами ненизкой частоты.
Преимущество такого нагрева заключается в возможности испарения тонких слоев (пленок) расплавленного алюминия, что направляется мигрировать из тигля во досуг службы. Для устранения миграции используются тигли, толщина стенок которых менее, нежели толщина скин слоя в высокочастотном поле, что в свою череда зависит от удельного электро сопротивления сырья тигля и частоты.
Так как противодействие композиции TiB2 + BN при 1100-1200° С (температуре, необходимой для испарения алюминия) равно 2 - 10 3 ом- см, то при частоте 200 кг толщина скин слоя порядка 5 миллиметр, то что и определяет выбор толщины стенки тигля с учетом тоже таких факторов, как предотвращение турбулентности расплава в последствии его экранирования от высокочастотного поля. Нитрид титана удачно употребят для припыливания поверхности изложниц с целью приобретения чистой поверхности отливок.
Большая твердость нескольких нитридов дает возможность их использовать для правки шлифовальных кругов обкаткой кружками, так, например, из литого нитрида титана. Нитриды титана и циркония использовались в качестве проводящего сырья ториевых катодов, в изготовлении зажигателен к выпрямителям применялась композиция, содержащая 25% TiN + 75%.
Непростой нитрид титана и хрома рекомендуется в качестве высоко омного сопротивления. Нитрид ниобия применяется в качестве детектора для радиоаппаратуры, работающей при 170° С, в конструкции трубок для передачи изображений, напротив, тоже для сверхпроводящих болометров. Во всех без исключения этих случаях применяется дарование нитрида ниобия переходить в сверхпроводящее состояние.
Добавлением к карбида ниобия получается усилить точку перевода в сверхпроводящее состояние до 17-18°, то что разрешает расширить употребление сверхпроводящих свойств нитрида ниобия. Нитрид хрома CrN представляется перспективным полупроводником, в частности, для использования его в термоэлектрических генераторах, для этих же целей перспективен нитрид скандия. Немногие нитриды, в частности нитриды хрома, являются перспективными катализаторами.
По достоверным сведениям патента, нитриды переходных металлов в форме покрытий на самих переходных металлах являются перспективными материалами для выработки электродов солионов - электрохимических приборов, предназначенных для измерений чрезвычайно малых акустических давлений, преобразования энергии минувших в электрическую и основанных на транспорте малых количеств субстанции в ионных растворах.
Электроды солионов из переходных металлов (с нитридными покрытиями) располагают хорошей электропроводностью и устойчивостью к химическим и электрохимическим воздействиям, т. е. фактически инертны в растворе электролита солиона.
Мононитрид урана составляет перспективным ядерным топливом, так как в разница от карбида и двуокиси урана не взаимодействует с множеством элементов, что могут быть использованы в контакте с ним, насчитывает свыше высокую теплопроводность при температурах выше 800° С, нежели монокарбид урана, меньше склонен к возгоранию и гидролизу, нежели карбид, насчитывает высокое содержание урана, а также по радиационной стойкости не уступает карбиду и двуокиси урана. Его можно применить в тепловыделяющих элементах дисперсионного типа, в реакторах всевозможных типов.
Термисторы
Термисторы - это по сути термометры сопротивления, выполненные на основе смешанных оксидов переходных металлов. Два основные типа термисторов – NTC (с отрицательным температурным коэффициентом сопротивления) и PTC ( с положительным коэффициентом). Наиболее распространенный тип – NTC. РТС термисторы используются только в очень узких диапазонах температур, в несколько градусов, в основном в системах сигнализации и контроля.
Конструкция и материалы
Большим преимуществом термисторов является разнообразие форм и миниатюрность. Основные конструктивные типы: бусинковые (0,1-1 мм), дисковые (2,5-18 мм), целиндрические (3-40 мм), пленочное покрытие (толщина 0,2-1 мм). Выпускаются бусинковые термисторы диаметром до 0,07 мм с выводами толщиной 0,01 мм. Такие миниатюрные датчики позволяют измерять температуру внутри кровеносных сосудов или растительных клеток.
Большинство термисторов – керамические полупроводники, изготовленные из гранулированных оксидов и нитридов металлов путем формирования сложной многофазной структуры с последующим спеканием (синтерация) на воздухе при 1100-1300 °С. Сложные двойные и тройные структуры оксидов переходных металлов, такие как (AB)3O4, (ABC)3O4 лежат в основе термисторов. Распространенной формулой является (Ni0.2Mn0.8)3O4. Наиболее стабильными термисторами при температурах ниже 250 °С являются термисторы на основе смешанных оксидов мания и никеля или магния, никеля и кобальта, имеющие отрицательный ТКС. Удельная проводимость термистора r (25 °C) зависит от химического состава и степени окисления. Дополнительное управление проводимостью осуществляется добавлением очень малых концентраций таких металлов как Li и Na.
При изготовлении бусинковых термисторов бусинки наносятся на две параллельные платиновые проволоки при температуре 1100 °С, проволоки разрезаются на куски для получения необходимой конфигурации выводов. На бусинки наносится стеклянное покрытие, спекаемое при 300 °С, либо бусинки герметизируются внутри миниатюрных стеклянных трубок. Для получения металлических контактов в дисковых термисторах, на диск наносится металлическое покрытие Pt-Pd-Ag и выводные проводники соединяются с покрытием пайкой или прессованием.
Номинальное сопротивление термисторов значительно выше, чем у металлических термометров сопротивления, оно обычно составляет 1, 2, 5, 10, 15 и 30 кОм. Поэтому может применяться двухпроводная схема включения.
Номер патента: 2031464
Класс(ы) патента: H01F1/053, C22C1/05, B22F1/00
Номер заявки: 5015724/02
Дата подачи заявки: 01.07.1991
Дата публикации: 20.03.1995
Заявитель(и): Сибирский химический комбинат
Автор(ы): Буйновский А.С.; Жиганов А.Н.; Кравченко И.В.; Кондаков В.М.; Макасеев Ю.Н.; Софронов В.Л.; Штефан Ю.П.; Чижиков В.С.
Патентообладатель(и): Сибирский химический комбинат
Описание изобретения: Изобретение относится к способам получения магнитных сплавов на основе редкоземельных и переходных металлов. Эти сплавы, в основном, применяются для получения высокоэнергетических постоянных магнитов и могут содержать один или несколько редкоземельных металлов (РЗМ) (неодим, празеодим, тербий и т. д.), переходные металлы (железо, никель, кобальт) и легирующие компоненты (бор, алюминий, цирконий, галлий и другие), повышающие магнитные характеристики материала.
Известен способ получения магнитных сплавов на основе РЗМ, включающий приготовление шихты из фторидов РЗМ, переходных металлов, легирующих добавок и восстановителя, металлотермическое восстановление и отделение полученного сплава от шлака.
Недостатками способа являются не очень высокие выходы и неравномерное распределение в слитке основных и легирующих компонентов сплава.
Целью изобретения является повышение выхода сплавов в слиток и улучшение их качества при заданном равномерном распределении в них основных и легирующих компонентов, а также сокращение затрат на производство.
Указанная цель достигается тем, что в способе получения магнитных сплавов на основе редкоземельных и переходных металлов, включающем приготовление порошковой шихты из фторидов редкоземельных и переходных металлов, легирующих добавок и восстановителя, восстановление и отделение полученного сплава от шлака, для приготовления шихты используют порошок фторидов металлов с размером частиц менее 0,08 мм. Порошки с размером частиц более 0,08 мм подвергают измельчению и выделяют нужную фракцию.
Достижение поставленной цели обеспечивается тем, что мелкие фториды позволяют приготовить гомогенизированную шихту с равномерным распределением в ней фторида неодима, что создает равномерность горения шихты.
Способ был опробован в опытно-промышленных условиях и это позволило увеличить средний выход сплавов в слиток до 99,0-99,5%.
П р и м е р (по прототипу). Для получения сплава 30 Nd-1B-69Fe ( мас.%) 2010 г трифторида неодима (неодима - 1440 г), 3320 г трифторида железа (железа - 1656 г), 48 г бора и 1656 г порошка железа смешивают с 2600 г кальциевой стружки, помещают в тигель и герметичный реактор. Избыток кальция 10% от стехиометрии. Фториды неодима и железа получают осаждением из соответствующих растворов солей плавиковой кислотой, дальнейшей сушкой и прокалкой осадков трифторидов.
Трифторид неодима имеет следующий гранулометрический состав: фракция (+2,0 мм) 24%, фракция (-2,0) - (+0,08) мм 44% и фракция (-0,08) мм 32%.
Восстановление проводят при местном инициировании реакции электрической спиралью. После восстановления получают сплав массой 4176 г (87,0%). Химический анализ сплава показывает содержание неодима - 28%, бора - 1,03%, железо - остальное. Степень восстановления трифторида неодима - 81,2%.
Примеры по предлагаемому способу.
П р и м е р 1. Получение сплава 69Fe-30Nd-1B (мас.%), для шихты используется трифторид неодима с размерами частиц (+2) мм.
Исходная смесь (шихта), г: трифторид неодима 2350; трифторид железа 1970; железо (порошок) 2200; ферробор 285; кальций (стружка) 2240.
Трифториды неодима и железа получают сухим фторированием оксидов металлов элементным фтором. Восстановление проводят аналогично примеру-прототипу. Выход сплава в слиток - 4750 г (92,9%).
Содержание компонентов в слитке, мас.%: неодим 26,1; празеодим 0,6; железо 69,0; бор 1,2; кальций 0,03; остальные 2,47.
П р и м е р 2. Получение сплава Fe-Nd-B, для шихты используется трифторид неодима с гранулометрическим составом (-2)-(+0,08) мм.
Состав и количество шихты аналогичны приведенным в примере 1.
Выход сплава - 5035 г (98,5%).
Содержание компонентов в сплаве, мас.%: неодим 29,3. празеодим 0,9; железо 68,4; бор 1,1; кальций 0,03; остальные 0,27.
П р и м е р 3. Получение сплава Fe-Nd-В, для шихты используется трифторид неодима с размерами частиц (-0,08) мм.
Состав и количество шихты аналогичны приведенным в примере 1.
Выход сплава - 5100 г (99,7%).
Содержание компонентов в сплаве, мас.%: неодим 29,5; празеодим 0,8; железо 68,5; бор 1,0; кальций 0 ,03; остальные 0,17.
П р и м е р 4. Получение сплава Fe-Nd-B. Все проводится аналогично описанным примерам. Отличие заключается лишь в том, что использовали трифторид неодима фракции (+2) мм и перед приготовлением шихты его измельчили в шаровой мельнице и отклассифицировали, выделив фракцию (-0,08) мм.
Выход сплава в слиток - 5090 г (99,5%).
Содержание компонентов в сплаве, мас.%: неодим 29,5; празеодим 0,8; бор 1,0; железо 69,6; кальций 0,03; остальные 0,7.
Как следует из приведенных примеров, наилучшие показатели при восстановлении - использование шихты, состоящей из частиц с размером (-0,08) мм. В этом случае выход близок к 100%. Получены материалы, соответствующие заданному составу.
Номер патента: 2022711
Класс(ы) патента: B22F3/24
Номер заявки: 4944480/02
Дата подачи заявки: 11.06.1991
Дата публикации: 15.11.1994
Заявитель(и): Институт проблем сверхпластичности металлов РАН
Автор(ы): Петрова Л.В.; Зарипов Н.Г.; Ефимов О.Ю.; Соколов Ю.Н.; Питюлин А.Н.
Патентообладатель(и): Институт проблем сверхпластичности металлов РАН
Описание изобретения: Изобретение относится к порошковой металлургии, а именно к способам получения изделий из карбидов переходных металлов.
Известен способ получения изделий из карбидов переходных металлов, включающий прессование заготовки из порошка и последующее спекание в защитной атмосфере. К недостаткам данного способа относятся низкие прочностные и эксплуатационные свойства полученных изделий из-за высокой остаточной пористости, из-за неравномерности пористости при получении тонкостенных изделий, например стаканов, из-за сложностей, возникающих при прессовании и хранении заготовки до спекания, большой усадки и коробления изделий при спекании.
Также известен способ получения изделий из карбидов переходных металлов, включающий получение заготовки, ее нагрев и деформирование до получения конечной формулы изделия. Данный способ как наиболее близкий к предлагаемому принят за прототип.
В связи с тем, что температура хрупко-пластичного перехода карбидов переходных металлов достаточно высока, например для карбида титана она превышает 1200оС, штамповку карбидов необходимо производить при температуре более 1300оС в защитной атмосфере из-за интенсивного окисления, что резко снижает производительность процесса, снижает технологические возможности способа. Одновременно возникают трудноразрешимые проблемы с системой нагрева, штамповым материалом, с адгезией материала заготовки со штамповым материалом со смазкой. Исходя из вышеизложенного, современный уровень техники хотя и позволяет штамповать карбиды переходных металлов, но полученные изделия слишком дороги и поэтому производить штамповку изделий из карбидов нерентабельно.
Целью изобретения является расширение технологических возможностей способа за счет изготовления сложно- профильных, преимущественно тонкостенных изделий.
Поставленная цель достигается тем, что в способе получения изделий из карбидов переходных металлов, включающем получение заготовки, нагрев и деформацию, получают заготовку из карбида нестехиометрического состава, преимущественно с составом, соответствующим нижнему пределу области гомогенности, нагрев производят до температуры в 1,05-1,7 раза выше температуры хрупко-пластичного перехода материала заготовки, деформируют заготовку со скоростью деформирования 0,1-250 мм/мин до получения конечной формы изделия, после чего производят насыщение материала изделия углеродом, например до получения стехиометрического состава, путем отжига в атмосфере углеродсодержащих или в засыпке из углеродного порошка.
Насыщение углеродом материала изделия рекомендуется производить при температуре в 0,75-0,95 от температуры плавления материала заготовки в течение более 10 мин. Рекомендуется производить насыщение углеродом изделия в несколько этапов при повышении температуры на 50-200оС на каждом этапе, но ниже температуры в 0,95 от температуры плавления материала изделия на последнем этапе.
Сущность заявляемого способа состоит в том, что температура хрупко-пластичного перехода карбидов переходных металлов зависит от химического состава карбидов, так температура хрупко-пластичного перехода карбида титана стехиометрического состава, как правило, превышает 1200оС, а нестехиометрического состава, как правило, превышает 1200оС, а нестехиометрический карбид титана с составом на нижнем пределе области гомогенности TiC0,47 имеет температуру хрупко-пластичного перехода 700оС. Совокупность реальных с точки зрения технологии температур при штамповке нестехиометрических карбидов, которые позволяют реализовать большие степени деформации и получать сложнопрофильные изделия с возможностью сквозного науглероживания изделия из нестехиометрического карбида титана дает возможность получать сложнопрофильные, в том числе и тонкостенные, изделия из карбидов переходных металлов стехиометрического состава.
Экспериментальным путем было установлено, что при снижении температуры деформирования заготовки ниже 1,05 от температуры хрупко-пластичного перехода нецелесообразно из-за малой допустимой степени деформации и возможного образования и развития трещин в процессе деформации. Превышение температуры деформации величины 1,7 от температуры хрупко-пластичного перехода также нерационально, так как температура деформирования в данном случае приближается к температуре деформирования стехиометрических карбидов, при этом возникают перечисленные проблемы, характерные для реализации способа-прототипа.
Было также установлено, что поскольку температура хрупко-пластичного перехода зависит от многих параметров, данная температура наиболее полно отражает структурные состояния материала заготовки и является надежной точкой отсчета. Температура плавления карбида в данном случае не может быть использована, так как оптимальная температура деформации может изменяться более, чем на 200оС при различной степени загрязненности карбида азотом или кислородом при совершенно идентичных параметрах структуры.
Снижение скорости деформирования ниже 0,1 мм/мин нецелесообразно из-за снижения производительности процесса и роста эксплуатационных затрат. При этом увеличивается также коррозия и вероятность адгезионных процессов между материалом штампа и заготовки. Превышение скорости деформирования выше 250 мм/мин также нецелесообразно из-за возможности появления и развития трещин в материале заготовки.
Поскольку процесс науглероживания карбидов нестехиометрического состава - диффузионный, то снижение температуры науглероживания изделий ниже температуры науглероживания изделий ниже температуры в 0,75 от температуры плавления материала изделий нецелесообразно из-за резкого уменьшения скорости диффузии и, соответственно, увеличения времени, необходимого для сквозной карбидизации изделия. При повышении температуры в 0,95 от температуры плавления материала изделия возможно частичное оплавление изделия, потеря им геометрической формы и эксплуатационных свойств.
Время карбидизации - науглероживания менее 10 мин задавать нецелесообразно из-за низкой скорости диффузии углерода в нестехиометрическом карбиде титана и, соответственно, из-за возможности карбидизации изделия не на полную глубину. Верхний предел времени науглероживания устанавливать нецелесообразно, так как он зависит от размеров и формы обрабатываемого изделия. Если даже необходимое время карбидизации будет превышено, насыщение изделия углеродом прекратится при достижении карбидом стехиометрического состава.
Время ограничения науглероживания подбирается для каждого вида изделия индивидуально в зависимости от свойств и структуры. Поскольку скорость диффузии углерода в карбиде титана возрастает с повышением температуры и, соответственно, сокращается время насыщения углеродом, целесообразно с увеличением содержания углерода в изделии поднимать температуру насыщения изделия, но поднимать на каждом этапе температуру менее, чем на 50оС, нецелесообразно из-за слабого различия коэффициентов диффузии углерода при данном интервале температур. Повышение температуры более чем на 200оС также нецелесообразно из-за возможности прорыва пленки карбида на поверхности изделия жидким карбидом нестехиометрического состава, который мог сохраниться при неполной карбидизации изделия.
В доступной патентной и научно-технической литературе не обнаружено каких-либо упоминаний о технологических процессах, в которых были бы совмещены штамповка керамики и насыщение углеродом отштампованных деталей, а также какие-либо способы, в которых для получения изделий из одного материала предварительно бы штамповали заготовку из материала с другим химическим составом.
Получали тонкостенный стакан из карбида титана с высотой 30 мм, внешним диаметром 20 мм, с толщиной стенок и дна 1 мм. Для этого смешивали шихту из порошков титана и углерода в соотношении необходимом для получения карбида титана с составом TiC0,5. Шихту прессовали в заготовку диаметром 100 мм, укладывали заготовку в реакционную пресс-форму, инициировали в заготовке реакцию горения и компактировали до малопористого состояния. В результате была получена заготовка диаметром 100 мм и высотой 12 мм из карбида титана с составом TiC0,5, в котором размер зерна составил 8 мкм, а пористость не превышала 5% (объемных). Из данных заготовок на электроэрозионном станке вырезали заготовку под штамповку диаметром 20 мм, укладывали заготовку в штамп нагревали ее до температуры 950оС, что соответствовало 1,36 от температуры хрупко-пластичного перехода и деформировали до получения формы конечного изделия со скоростью деформирования 1 мм/мин. Отштампованные изделия извлекали из штампа, обрезали верхнюю часть стакана под размер готового изделия алмазной дисковой пилой и производили насыщение изделия углеродом в засыпке из активированного угля сначала при температуре 1600оС в течение 4 ч в вакууме глубиной 10-4 мм рт.ст. Затем в течение 10 ч при температуре 1800оС и 1 ч при температуре 2000оС. В результате был получен стакан указанных размеров из стехиометрического карбида титана. Пористость материала составляла 0,3% (объемных).
Кроме того, было выполнено еще 4 эксперимента по штамповке стаканов из карбида титана с составом TiC0,5.
Штамповали изделие при температуре 735оС (1,05 от температуры хрупко-пластичного перехода) со скоростью деформирования 0,1 мм/мин и при температуре 1200оС (1,7 от температуры хрупко-пластичного перехода) со скоростью 250 мм/мин. В обоих случаях были получены годные изделия.
Также штамповали упомянутые изделия при температуре 710оС и скорости деформирования 0,05 мм/мин и при 1250оС и скорости деформирования 280 мм/мин. В обеих случаях трещины, возникшие в процессе деформирования в верхней части изделия достигли его дна, т.е. был получен неисправимый брак.
Годные изделия насыщали углеродом в засыпке из активированного угля при температуре 1150оС, 1240оС, 1570оС, 1600оС, что соответствует температурам в 0,7; 0,75; 0,95; 0,97 от температуры плавления карбида титана с составом TiC0,5. Во 2-м и 3-м случаях были получены годные изделия. В первом случае сквозное насыщение углеродом до стехиометрического состава не наступило даже через 250 ч, что делает изготовление изделий экономически невыгодным. В последнем случае было получено покоробленное изделие из-за частичного подплавления.
Таким образом, при реализации способа появляется возможность получения особо тонкостенных, беспористых изделий из карбидов переходных металлов, которые получать методами порошковой металлургии или сложно или невозможно, что расширяет технологические возможности способа-прототипа.
