
Енергетичний ефект хімічних реакцій
Хімічні реакції завжди супроводжуються виділенням або поглинанням енергії. Кількість виділеної або поглиненої енергії називається тепловим ефектом хімічної реакції (Q). Реакції, що супроводжуються виділенням енергії, називаються екзотермічними, поглинанням енергії, — ендотермічними.
Хімічні рівняння, в яких наводяться теплові ефекти хімічних реакцій, називаються термохімічними, наприклад:
У цьому рівнянні зазначені агрегатні стани речовин (г.— газоподібний, р.— рідкий), оскільки від них залежить тепловий ефект реакції.
Ентальпі́я — термодинамічний потенціал, що характеризує стан термодинамічної системи при виборі як основних незалежних змінних ентропії (S) і тиску (P). Позначається H(S,P,N,xi) або W(S,P,N,xi), де N — число частинок системи, xi — інші макроскопічні параметри системи. Ентальпія — адитивна функція, тобто ентальпія всієї системи дорівнює сумі ентальпій її складових частин. Із внутрішньою енергією E системи ентальпія зв'язана співвідношенням:
![]() ,
,
де E - внутрішня енергія, P - тиск, V - об'єм.
Таким чином ентальпія дорівнює сумі внутрішньої енергії і добутку тиску на об'єм.
Ентальпія залежить від тиску й ентропії системи, тобто при незмінних N і xi її повний диференціал дорівнює:
![]() .
.
Ентальпія використовується для опису ізобарних процесів, тобто процесів, які відбуваються при сталому тиску. Якщо процес проходить при сталому тиску, то приріст ентальпії дорівнює переданій тілу теплоті dQ = TdS.Тож,
,
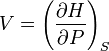
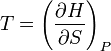
.
Вн́утрішня ене́ргія тіла (позначається як E або U) — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Внутрішня енергія є однозначною функцією рівноважного стану системи. Це означає, що кожний раз, коли система опиняється в даному рівноважному стані, її внутрішня енергія приймає властиве цьому стану значення, незалежно від передісторії системи. Отже, зміна внутрішньої енергії при переході з одного стану в інший буде завжди дорівнювати різниці значень в цих станах, незалежно від шляху, по якому здійснювався перехід. Внутрішню енергію тіла не можна виміряти напряму. Можна визначити тільки зміну внутрішньої енергії:
де — кількість теплоти, передана термодинічній системі, — робота, виконана над термодинамічною системою[1] або:
де , робота виконана термодинамічною системою.
Тепловий ефект хімічної реакции У кожному речовині запасено певну кількість енергії. З цією властивістю речовин ми бачимо за сніданком, обідом чи вечерею, оскільки продуктів харчування дозволяють нашому організму використати енергію найрізноманітніших хімічних сполук, які у їжі. У організмі цю енергію перетворюється на рух, роботу, йде підтримку постійної (і досить високою!) температури тела. Однією з найбільш відомих учених, що працюють у області термохимии, є Бертло. Бертло- професор хімії Вищої фармацевтичної школи Парижі (1859г). Міністр освіти і закордонних дел. Починаючи з 1865 Бертло активно займався термохимией, провів великі калориметричні дослідження, що призвели, зокрема, до винаходу " калориметрической бомби " (1881); йому належать поняття " экзотермической " і " эндотермической " реакцій. Бертло отримані великі даних про теплових ефекти величезної кількості реакцій, швидше про теплоту розкладу і освіти багатьох веществ. Бертло досліджував дію вибухових речовин: температуру вибуху, швидкості згоряння поширення вибуховий хвилі і др. Енергія хімічних сполук зосереджена головним чином хімічних зв'язках. Щоб зруйнувати зв'язок між двома атомами, потрібно затратити енергію. Коли хімічна зв'язок утворюється, енергія выделяется. Будь-яка хімічна реакція залежить від розриві одних хімічних зв'язків й освіті других. Коли результаті хімічної реакції при освіті нових зв'язків виділяється енергії більше, ніж знадобилося для руйнації " старих " зв'язків у вихідних речовинах, то надлишок енергії вивільняється як тепла. Прикладом можуть бути реакції горіння. Наприклад, природного газу (метан CH4) згоряє в кисні повітря з великої кількості теплоти (рис. 1а). Такі реакції є экзотермическими. * Реакції, що проходять із виділенням теплоти, виявляють позитивний парниковий ефект (Q>0, DH За інших випадках на руйнація зв'язків у вихідних речовинах потрібно енергії більше, що може виділитися при освіті нових зв'язків. Такі реакції відбуваються лише за підводі енергії ззовні й називаються эндотермическими. * Реакції, які тривають від поглинанням теплоти із довкілля (Q0), тобто. з негативним тепловим ефектом, є эндотермическими.
Термохімічні розрахунки, хімічна спорідненість Термодинаміка – це наука про взаємні перетворення різних видів енергії, про закони, яким підпорядковуються ці перетворення, про напрямок самовільного проходження різних процесів. Хімічна термодинаміка вивчає в цьому плані фізико-хімічні процеси: хімічні реакції, фазові переходи (наприклад, кристалізацію, випаровування, розчинення) та ін. Хімічні реакції супроводжуються поглинанням або виділенням енергії (найчастіше теплоти) і відповідно називаютьсяендотермічними або екзотермічними. Розділ хімії, що вивчає теплові ефекти реакцій, називається термохімією. Термохімія, яка історично виникла раніше, є складовою частиною ширшої галузі знань, а саме – хімічної термодинаміки. Перш ніж почати виконання термохімічних розрахунків, необхідно вивчити основні поняття і закони термохімії та хімічної термодинаміки. В термохімії найчастіше користуються двома законами: а) закон Лапласа – Лавуазьє (1770): теплота розпаду будь-якої речовини дорівнює теплоті утворення цієї речовини з протилежним знаком; б) закон Гесса (1840): тепловий ефект хімічної реакції не залежить від кількості окремих стадій та їх послідовності, а визначається тільки кінцевим і початковим станами системи. У термодинаміці розрізняють чотири термодинамічні функції, які є функціями стану, тобто підлягають закону Гесса: 1) внутрішня енергія U та її зміна DU (при DV = 0); 2) ентальпія Н та її зміна DН (при DР = 0); 3) ентропія S та її зміна DS; 4) вільна енергія, або енергія Гіббса G та її зміна DG (при DР = 0, DТ = 0).
Розрізняють вищу на нижчу теплоту згорання палива.
Вища теплота згорання палива Qвр – теплота, що виділяється при повному окисленні горючих складових палива, і теплота, що виділяється при конденсації водяної пари, що міститься в продуктах згорання палива.
Нижча теплота згорання палива Qнр – теплота, що виділяється при повному окисленні всіх горючих складових палива.
В СРСР прийнято було рахувати теплові баланси по нижчій теплоті згорання палива, а в Англії, США та інших – по вищій.
Це пояснювалося тим, що вони спалюють висококалорійні малово-логі палива, для яких майже немає різниці між вищою та нижчою теплотою згорання. А ми спалювали високовологі палива – буре вугілля, антрацит тощо, тому для аналізу роботи котлів легше використовувати нижчу теплоту згорання. Крім того, у переважній більшості радянських та українських котлів водяна пара у димових газах знаходиться у паровій фазі і не конденсується корисно в котлі.
Теплоту згорання визначають експериментально за допомогою калориметра. В розрахунках використовують такі емпіричні формули:
— для твердого та рідкого палива, кДж/кг для газового палива, кДж/м3
Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі. Поняття ентропії було вперше введено у 1865 році Рудольфом Клаузіусом. Він визначив зміну ентропії термодинамічної системи при оборотному процесі як відношення загальної кількості теплоти ΔQ, отриманої або втраченої системою, до величини абсолютної температури T:
Вільна енергія Гіббса (або просто енергія Гіббса, або потенціал Гіббса, або термодинамічний потенціал у вузькому значенні) - це термодинамічний потенціал такого вигляду:
![]()
Енергію Гіббса можна розуміти як повну хімічну енергію системи (кристала, рідини і т.п.)
