
24. Белково-углеводные комплексы (бук) внеклеточного матриксаБук - особый вид соединений
БУК классифицируются по 2 критериям: (1) количеству (доле) углеводов в комплексе и (2) качественному моносахаридному составу. Различают протеогликаны (свыше 95% углеводов), мукопротеины (10-50% углеводов) и гликопротеины (менее 10% углеводов).
ГЛИКОПРОТЕИНЫ, соединения, в молекулах которых остатки олиго- или полисахаридов ковалентно связаны (О- или N-гликозидными связями) с полипептидными цепями белка. Гликопротеины широко распространены в природе. К ним относятся важные компоненты сыворотки крови (иммуноглобулины, трансферрины и др.), групповые вещества крови, определяющие групповую принадлежность крови человека и животных, антигены многих вирусов (гриппа, кори, энцефалита и др.), некоторые гормоны, лектины, ферменты.
В образовании О-гликозидной углевод-белковой связи участвуют гидроксиаминокислоты; известны комбинации галактоза (Gal) – гидроксилизин, галактоза или арабиноза – гидроксипролин, но чаще в узле углевод-белковой связи находятся серин или треонин. Известно присоединение остатков N-ацетилглюкозамина (GlcNAc), маннозы (Man) и галактозы к серину, фукозы (Fuс) к треонину, однако подавляющее большинство таких гликопротеинов содержит в узле углевод-белковой связи один и тот же дисахаридный фрагмент (так называемый «кор» или стержень), который состоит из остатков галактозы и N-ацетилгалактозамина (GalNAc) и имеет строение Galβl – 3GalNAcαl -(цифры обозначают номера атомов С в моносахаридах, участвующих в образовании гликозидных связей, греч. буквы – конфигурацию аномерного атома С). Кор связан с атомом О гидроксильной группы остатка серина или треонина (см., напр., ф-лу I). В состав углеводных цепей таких гликопротеинов входят также остатки N-ацетилглюкозамина, L-фукозы и(или) N-ацетилнейраминовой к-ты (NeuAc).
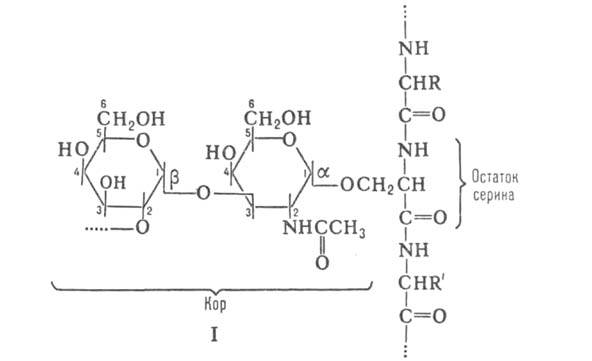
Полипептидные цепи о-гликозилпротеинов, в отличие от обычных белков, сильно обогащены остатками серина и треонина.
В гликопротеинах, у которых углеводная и полипептидная цепи соединены N-гликозидными (гликозил-амидными) связями (N-гликозилпротеины), остаток N-ацетилглюкозамина связан с атомом N амидной группы остатка аспарагина в полипептидной цепи. В этом случае кор углеводной цепи гликопротеинов – пентасахарид:
![]()
Функции глико- и мукопротеинов:
1. Являются структурными компонентами мембраны клетки, коллагеновых,эластиновых и фибриновых волокон, костного матрикса;
2. Защитные свойства: муцины выполняют роль смазочного материала,обусловливая уменьшение трения соприкасающихся поверхностей
3. Транспортные молекулы для витаминов, липидов, микроэлементов
4. Иммунная защита: иммуноглобулины, антигены гистосовместимости, комплемент, интерферон - вещества гликопротеиновой природы
5. Гормоны - гликопротеины: тиротропин, хорионический гонадотропин
6. Ферменты глико- и мукопротеиновой природы: гидролазы, нуклеазы,
гликозидазы, факторы свертывания
7. Выполняют роль соединительного элемента в межклеточном взаимодействии
Структурные гликопротеины.
ФИБРОНЕКТИН – димер из двух полипептидных цепей, связанных между собой дисульфидными мостиками, содержит 4-5% углеводов. Различают:1)растворимый Фибронектин плазмы;2)нерастворимый Фибронектин тканей.
Отличаются эти две разновидности по степени гликозилирования.
1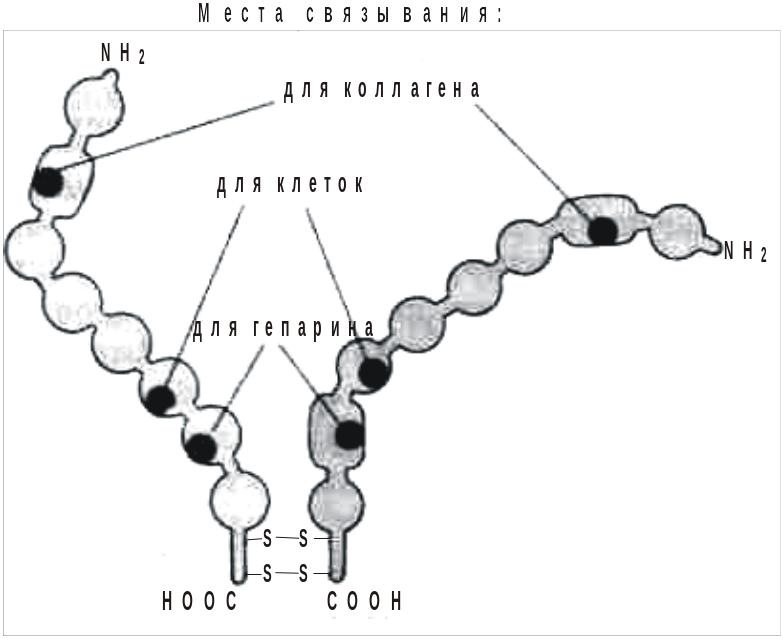 ).
Контролирует расположение мезенхимальных
клеток вдоль базальной мембраны.
).
Контролирует расположение мезенхимальных
клеток вдоль базальной мембраны.
2)Фибронектин взаимодействует с компонентами комплемента, способствуя проявлению их защитных св-в.
3). Контролирует рост коллагеновых волокон, взаимодействуя с коллагеном.
4). Необходим для формирования зачатков зубов.
ЛАМИНИН – обязательный компонент всех базальных мембран, соответствует распространению коллагена IV-го типа. Ламинин содержит большое количество цистеина. Оксипролин и оксилизин отсутствуют. Основная функция - обеспечивать адгезию (прилипание) клеток вдоль базальных мембран.
ПРОТЕОГЛИКАНЫ
Протеогликаны построены из цепей ГАГ, связанных ковалентно с "коровыми" белками
Протеогликаны - второй по значимости компонент соединительной ткани, образующий межуточное вещество или вещество внеклеточного матрикса соединительной ткани.
Межуточное вещество состоит из комплекса гликозоаминогликанов с белком. В отличие от гликопротеидов, у которых углеводный компонент составляет всего несколько процентов (по массе), углеводная часть протеогликанов составляет 95% и более. Схематично строение протеогликанов:
Гликозаминогликан / связывающий трисахарид /серин кóрового белка
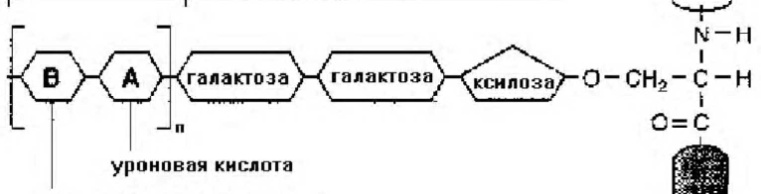
N-ацетилированный сахар
Функции протеогликанов.
1) Связывание катионов К+, Na+;
2) Связывание воды;
3) Из-за высокой вязкости гиалуроновая кислота служит смазочным материалом в суставах;
4) Гиалуроновая кислота участвует в морфогенезе мезенхимальных клеток;
5) Все выше перечисленные свойства протеогликанов придают эластичность, тургор соединительной ткани.
В зависимости от типа связи между углеводной и белковой частями БУК различают 2
типа БУК:
· БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОН-
ЛИЗ) белковой молекулы;
· БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой
молекулы.
Белковые части обоих типов БУК синтезируются по законам матричного синтеза, а
углеводные части — нематрично по двум механизмам:
· углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного
добавления моносахаридов к синтезированной белковой части с помощью
ферментов гликозилтрансфераз, обдадающих очень большой специфичностью;
· углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной
матрице — долихоле (полиизопреновое соединение) — и только затем
присоединяется к синтезированной белковой части.
Гликозоаминогликаны (ранее - мукополисахариды) делят на 6 основных классов:
1) Гиалуроновая кислота (содержит повторяющиеся дисахариды из гексуроновой кислоты и N-ацетилгексозамина). Белка в ней не более 1-2%;

2) Хондроитинсульфаты - важная составная часть хряща, содержат довольно большое количество белка;
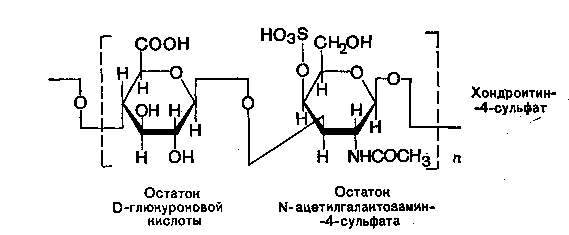
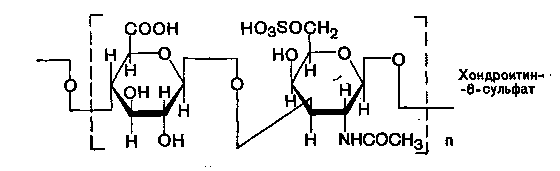
3) Дерматансульфаты характерны для дермы (кожи), резистентны к действию гиалуронидаз

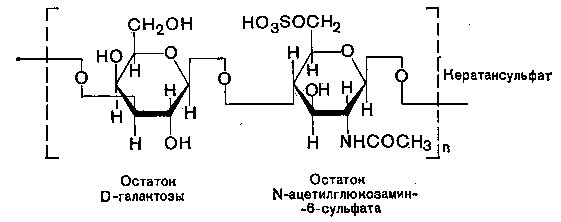
4) Кератансульфаты: из роговицы глаза (кератансульфат I), из хрящевой ткани (кератансульфат II);
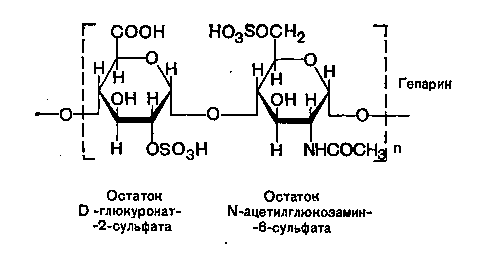
5) Гепарин известен прежде всего как антикоагулянт; 6) Гепарансульфаты.
Гепарин и гепаран сульфаты:состоят из D-глюкуронат -2-сульфата (или идуронат-2-сульфата) + N-сульфо-D-глюкозамин-6-сульфата Связь α(1, 4)(гепараны менее сульфированы чем гепарины)
Синтезируются гликозаминогликаны в фибробластах. В конечном виде протеогликановая молекула представляет собой сложный агрегат: Например, протеогликан из хряща устроен следующим образом: олигосахаридные цепи кератансульфата и хондроитинсульфата ковалентно связаны с полипептидным остовом (коровый белок) субъединицы. Эти субъединицы нековалентно связаны с длинной нитевидной молекулой гиалуроновой кислоты с помощью специальных связующих белков. Длина гиалуроновой кислоты может быть самой разной (от 420нм до 4200 нм).
Р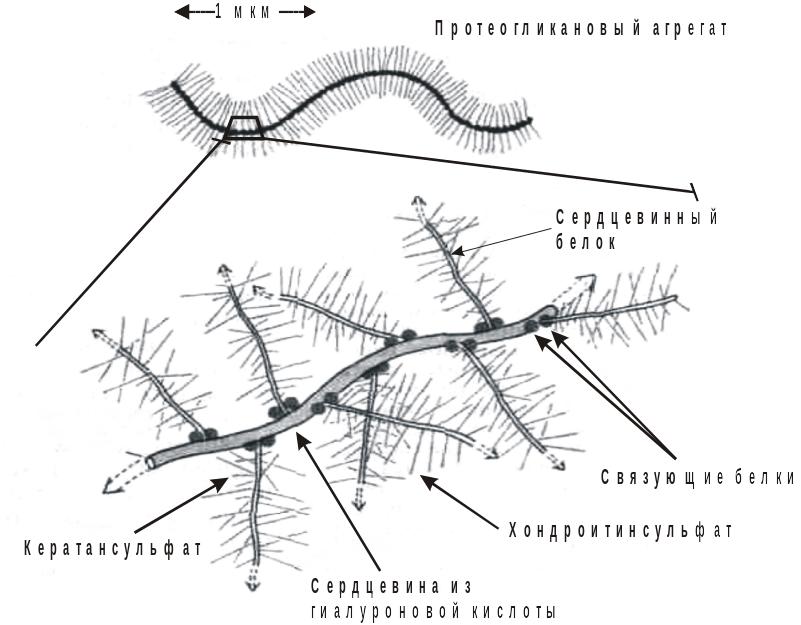 оль
долихола
оль
долихола
![]()
Образование олигосахаридной части N-связанных БУК происходит отдельно от белковой части. Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых
единиц).
Передача питания, энергии, информации в клетках происходит при помощи белков, которые для этого должны стать водорастворимыми – гликозилироваться. В этом процессе участвуют транспортные липиды – долихолы, присутствующие в организме. Долихолы играют главную роль в защите клеточных мембран, стабилизации клеточных белков и поддержании иммунной системы организма.
При воспалительных процессах долихолы стремительно вымываются из организма, процессы гликозилирования замедляются, клетки начинают умирать. Полипренол – растительный аналог долихола, его естественный предшественник, очень близкий к нему по своей форме и структуре. Для преобразования ему нужна всего одна связь, которая и синтезируется в желудочно-кишечном тракте при употреблении полипренола с пищей. Причем долихолов в этом случае образуется столько, сколько нужно. Организм сам запускает процесс регенерации.
Таким образом, обладая способностью при попадании в организм преобразовываться в долихолы и встраиваться в клеточную мембрану, полипренолы практически полностью восстанавливают поврежденную клетку.
Сиаловые кислоты, их количественное определение в сыворотке крови (по методу Гесса), значение:
Гесса реакция(Е. L. Hess) метод количественного определения сиаловых кислот в сыворотке крови, основанный на их гидролитическом отщеплении от сывороточных гликопротеидов в присутствии трихлоруксусной кислоты и образовании окрашенного соединения при нагревании получаемой смеси с реактивом, содержащим серную и уксусную кислоту.
Сиаловые кислоты или N-ацетилнейраминовые кислоты играют важную роль в качестве строительных блоков гетерополисахаридов, входящих в состав гликопротеинов и гликолипидов. В сыворотке крови определяют только связанные сиаловые кислоты.
Принцип
При добавлении трихлоруксусной кислоты к сыворотке крови происходит мягкий гидролиз,приводящий к отщеплению сиаловых кислот из состава сиалогликопротеинов сыворотки крови. Образующиеся сиаловые кислоты при нагревании с уксусно-сернокислым реактивом дают буровато-розовое окрашивание, интенсивность которого пропорциональна концентрации сиаловых кислот.
Практическое значение.
Концентрация их в крови возрастает при различных воспалительных процессах(эндокардите, остеомиелите), при турбекулёзе,нефрозе,инфаркте миокарда,при других процессах, протекающих с деструкцией соед-ой ткани.
Снижение отмечается у больных с гемохроматозом, болезнью Вильсона.
