
Электроды первого рода. К ним чаще всего относят электроды из металла, погруженного в раствор, содержащий его катионы.
Например, цинковый электрод первого рода схематически можно записать так:
Zn2+ | Zn,
где разделительная черта обозначает межфазную границу раздела, на которой протекает электродная реакция:
Zn2+ + 2ē Zn0.
Равновесный потенциал цинкового электрода в соответствии с уравнением Нернста можно записать:
![]()
![]() ,
,
т. к. аZn = 1, т.е. активность атомов металла в электроде из чистого металла и активность твердого соединения принимается равной единице. Так как потенциал электрода зависит от активности катионов металла, металлические электроды первого рода называют также электродами, обратимыми относительно катионов.
Реже встречаются электроды первого рода, состоящие из металла, погруженного в раствор, содержащий его анионы. Например, на теллуровом неметаллическом электроде первого рода:
Те | Те2-
протекает следующая реакция:
Те + 2ē = Те2-.
Потенциал такого электрода выражается уравнением
![]()
![]()
![]()
![]() ,
,
т. к. аТe = 1.
2. Газовые электроды. Иногда их относят к электродам первого рода. Состоят из инертного металла (обычно платины), контактирующего одновременно с газом и с раствором, содержащим ионы этого газа. Газовые электроды могут быть обратимы относительно катионов (водородный) или анионов (хлорный, кислородный).
На газовом хлорном электроде:
Pt, Cl2|Cl-
протекает реакция
1/2 Сl2 + ē = Cl-
и электродный потенциал записывается в виде:
![]()
![]() ,
,
где
![]() - относительно парциальное давление
хлора.
- относительно парциальное давление
хлора.
Для любого газа
![]() ;
Рэкс и Рст экспериментальное
и стандартное давления, выраженные в
одних и тех же единицах.
;
Рэкс и Рст экспериментальное
и стандартное давления, выраженные в
одних и тех же единицах.
Электроды второго рода. Состоят из металла, покрытого слоем труднорастворимого соединения (соли, гидроксида, оксида) этого металла и погруженного в раствор, содержащий такой же анион, что и труднорастворимое соединение. Примерами электродов второго рода могут служить каломельный и хлорид-серебряный электроды. Хлорид-серебряный электрод можно представить схемой:
Ag, AgCl | Cl-
ему отвечает электродная реакция
AgCl + ē = Ag + Cl-.
Электродный потенциал можно представить уравнением:
![]()
![]() =
=![]() -
b0 ln
-
b0 ln![]() ,
,
т.к. аAgCl = 1 и аAg = 1. Электроды второго рода обратимы относительно аниона.
4. Окислительно-восстановительные электроды. Состоят из инертного металла (обычно платины), погруженного в раствор, содержащий окисленную и восстановленную формы вещества. Платина играет только роль передатчика электронов, но сама не участвует в обратимой окислительно-восстановительной реакции, протекающей в растворе.
Выделяют простые и сложные окислительно-восстановительные системы. Примером простой окислительно-восстановительной системы может служить электрод
Cu2+, Cu+ | Pt.
В такой системе электрохимическая реакция состоит только в изменении заряда иона
Cu2+ + ē = Cu+
и выражение для потенциала имеет вид
![]()
![]() .
.
В сложной окислительно-восстановительной системе участвуют и другие компоненты раствора (Н+, ОН-, Н2О). Например, на электроде
H+, Cr2O72-, Cr3+ | Pt
протекает реакция
Cr2O72- + 14Н+ + 6ē = 2Сr3+ + 7H2O.
Уравнение Нернста для потенциала этого электрода имеет вид:
![]()
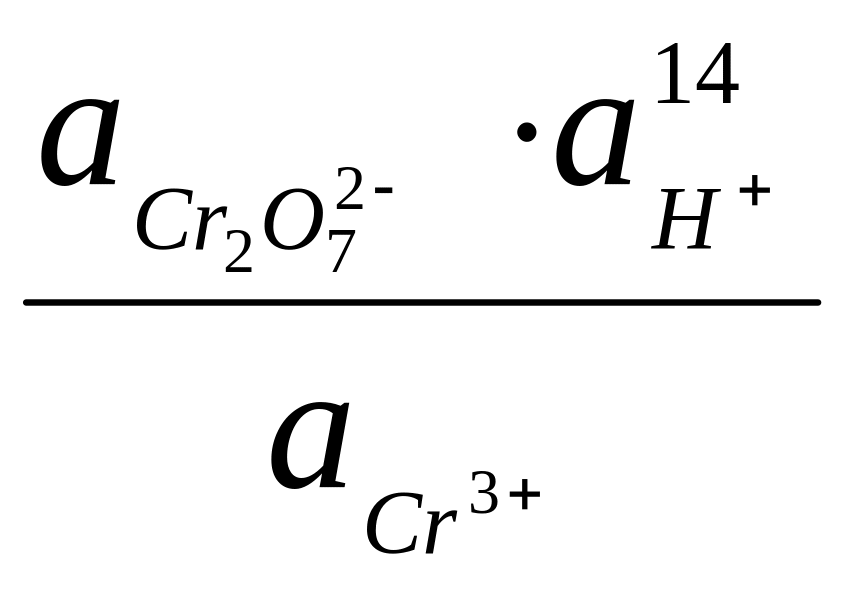 ,
,
![]() = 1.
= 1.
Электроды третьего рода. Встречаются довольно редко. Состоят из металла, покрытого труднорастворимой солью этого металла с добавлением более растворимой соли второго металла с одноименным анионом и погруженного в раствор, содержащий хорошо растворимую соль второго металла.
Например, систему
Ag, AgCl, PbCl2 | Pb2+
можно отнести к электродам третьего рода [ ].
Ионообменные (мембранные) электроды. К ионообменным относят электроды, состоящие из двух фаз: ионита и раствора, содержащего обмениваемый ион. Потенциал на межфазной границе возникает за счет ионообменного процесса между ионитом и раствором. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому электроды называют также ионселективными. Известны ионселективные электроды, обратимые относительно ионов натрия, калия, кальция и др. Стеклянный электрод является обратимым относительно катиона водорода (см. работу 7 раздел 1).
По принципу применения электроды делят на индикаторные и электроды сравнения. Индикаторными называют электроды, потенциал которых однозначно меняется с изменением концентрации определяемых ионов. Индикаторными могут быть все типы рассмотренных выше электродов (электроды первого рода, второго рода, газовые, окислительно-восстановительные и др.). К электродам сравнения относят стандартный водородный электрод и электроды второго рода: каломельный и хлорид-серебряный. Электроды второго рода обладают высокой стабильностью, равновесный потенциал их хорошо воспроизводится, быстро устанавливается. Поэтому такие электроды применяют в качестве электродов сравнения (эталонов) в практических электрохимических измерениях.
При использовании различных электродов сравнения электродные потенциалы выражают либо в шкале принятого электрода сравнения, либо (когда это возможно) переводят измеренное значение в водородную шкалу.
Электрохимический (гальванический) элемент состоит как минимум из двух электродов. Источником электрической энергии в элементе является свободная энергия химической реакции, протекающей в нем (химические элементы). Существуют и концентрационные элементы, они состоят из двух одинаковых электродов, отличающихся концентрацией (активностью) растворов электролитов, давлением газов и др. Электрическая энергия в них возникает за счет выравнивания концентраций (активностей), давлений и т.д.
Электродвижущая сила ЭДС электрохимического элемента определяется как разность двух условных электродных потенциалов Е+ и Е-, которые характеризуют каждый из электродов, составляющих элемент
Е = Е+ - Е-,
при условии устранения диффузионного потенциала. Диффузионный потенциал возникает на границе двух растворов и обусловлен разной скоростью перемещения (переносом) ионов. Для его устранения на границе двух растворов помещают солевой мост (П - образную стеклянную трубку, заполненную чаще всего насыщенным раствором хлорида калия).
Знак электрода в гальваническом элементе оценивается по значениям стандартных электродных потенциалов [ ]. Отрицательным является электрод с меньшим значением электродного потенциала.
В основе работы любого электрохимического элемента лежат окислительно-восстановительные реакции, протекающие раздельно: на отрицательно электроде – окисление, на положительном – восстановление. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.
Рассмотрим принцип работы электрохимического
элемента на примере элемента Даниэля
- Якоби, состоящего из цинкового и медного
электродов. Отрицательным электродом
в схеме элемента является цинковый
электрод (![]() =
-0,763 В), а положительным – медный (
=
-0,763 В), а положительным – медный (![]() =
0,337 В). В схеме электрохимического
элемента принято отрицательный электрод
записывать слева, а положительный -
справа. Металлы располагаются на концах
цепи, а электролиты – внутри. Металл и
твердое соединение или два раствора в
одном электроде разделяются запятыми.
=
0,337 В). В схеме электрохимического
элемента принято отрицательный электрод
записывать слева, а положительный -
справа. Металлы располагаются на концах
цепи, а электролиты – внутри. Металл и
твердое соединение или два раствора в
одном электроде разделяются запятыми.
Запишем элемент Даниэля-Якоби следующим образом:
(-) Zn | ZnSO4 || CuSO4 | Cu (+).
В ертикальные
линии в схеме обозначают межфазные
границы раздела. Двойная вертикальная
черта в месте соприкосновения двух
растворов означает, что диффузионный
потенциал на границе растворов устранен,
и этот элемент относится к типу
гальванических элементов без переноса
ионов. В гальваническом элементе с
переносом ионов диффузионный потенциал
не устранен, он может увеличивать или
уменьшать общую ЭДС элемента. В этом
случае меж-электронная граница вместо
двойной вертикальной линии обозначается
пунктирной вертикальной линией ( ).
Электродные реакции на электродах:
ертикальные
линии в схеме обозначают межфазные
границы раздела. Двойная вертикальная
черта в месте соприкосновения двух
растворов означает, что диффузионный
потенциал на границе растворов устранен,
и этот элемент относится к типу
гальванических элементов без переноса
ионов. В гальваническом элементе с
переносом ионов диффузионный потенциал
не устранен, он может увеличивать или
уменьшать общую ЭДС элемента. В этом
случае меж-электронная граница вместо
двойной вертикальной линии обозначается
пунктирной вертикальной линией ( ).
Электродные реакции на электродах:
(-): Zn – 2ē = Zn2+
(+): Cu2+ + 2ē = Cu0
Суммарный процесс при работе элемента определяется равновесием токообразующей реакции
Zn + Cu2+ = Zn2+ + Cu.
За счет протекания этой реакции возникает ЭДС, которая зависит от активностей компонентов следующим образом:
Е =
![]() -
-
![]() =
+
=
+
![]()
![]() -
-
-
-
или
Е = Е0 +
![]()
![]() ,
,
где Е0 = - .
Различают элементы с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относится рассмотренный элемент Даниэля - Якоби.
К элементам с одним электролитам может быть отнесен, например, элемент, состоящий из электрода первого рода, обратимого относительно катиона, и электрода второго рода, обратимого относительно аниона электролита
(-) Cd | CdCl2 | Hg2Cl2, Hg (+).
Реакции на электродах
(-): Cd – 2ē = Cd2+
(+): HgCl2 + 2ē = 2Hg + 2Cl-
Суммарная реакция в элементе
Cd + Hg2Cl2 = Cd2+ + 2Hg + 2Cl-.
Выражение для ЭДС этого элемента
Е =
![]() -
-
![]() =
=
![]() - b0lnaCl
-
- b0lnaCl
-
![]() -
-
![]() .
.
Электрохимические (гальванические) элементы используются не только как химические источники электрической энергии, но и в потенциометрии. Потенциометрия относится к электрохимическим методам исследования и широко применяется при определении многих физико-химических характеристик электролитов и термодинамических функций реакций, протекающих в электрохимических элементах, а также в анализе: прямая потенциометрия (например, рН-метрия) и потенциометрическое титрование [ ].
ВАРИАНТ 1. ИЗМЕРЕНИЕ ЭДС ЭЛЕМЕНТА ДАНИЭЛЯ - ЯКОБИ
2.1. В Ы П О Л Н Е Н И Е Р А Б О Т Ы
2.1.1. Приготовьте элемент Даниэля – Якоби.
Медный и цинковый электроды зачистите наждачной бумагой, тщательно промойте водопроводной водой, ополосните дистиллированной водой и осушите фильтровальной бумагой. Затем погрузите медный электрод в стакан с раствором CuSO4, цинковый электрод – в стакан с раствором ZnSO4 заданных концентраций (варианты заданий в табл. 1). Электроды должны были покрыты раствором на 3/4 высоты пластины из меди и цинка.
Таблица 1
