
- •1. Механизм электролитической диссоциации ионных веществ
- •2. Теория электролитической диссоциации
- •3. Соотношения между коэффициентами активности и концентрацией растворов электролитов
- •7. Числа переноса определяются подвижностями ионов: чем больше подвижность данного иона, тем большую долю электричества он переносит.
3. Соотношения между коэффициентами активности и концентрацией растворов электролитов
Коэффициент активности есть мера отклонения реальных (практических, экспериментальных) параметров от идеальных, разработанных в первом приближении для разбавленных растворов неэлектролитов. Величины их в растворах высоких концентраций становятся виртуальными. В самом деле, значения коэффициентов в несколько десятков, то есть отклонений от идеальных параметров в десятки раз, сложно приспособить к законам для практического применения в растворах, где доминируют процессы ассоциации или других межмолекулярных взаимодействий.
Тем не менее, имеется ряд фактических данных о зависимости коэффициентов активности электролитов от моляльности, причем при некоторых концентрациях (от децимоляльных для одних электролитов до нескольких моляльностей для других) наблюдается точка минимума.
Известно несколько методов определения и расчета коэффициентов активности. Поскольку электростатические взаимодействия весьма заметны в растворах электролитов, то остановимся на расчетах коэффициентов активности ионов. Они зависят от ионной силы, вычисляемой по известному уравнению:
I = (1/2)·S[Ai]·zi2,
где zi - заряд иона Аi; S - cумма всех ионов, присутствующих в растворе. Ионная сила учитывает электростатическое влияние всех ионов в растворе. Она имеет размерность концентрации и для растворов сильных I-I электролитов численно равна ей.
Одним из наиболее применяемых методов определения коэффициентов активности индивидуальных ионов является оценка по приближению Дебая-Хюккеля [8]
lggi = -Azi2(I)1/2
в случае, когда I £ 0.01 M, и
lggi = -Azi2(I)1/2/[1+aB(I)1/2],
если I = 0.01-0.1 M, где A и B - константы, зависящие от температуры и диэлектрической проницаемости растворителя (для воды при 298 К А » 0.5 и В » 0.33); а - эмпирическая константа, учитывающая размеры ионов и характеризующая среднее расстояние сближения сольватированных ионов в предположении, что они являются жесткими сферами. Значение а можно приближенно было принято считать постоянным, не зависящим от природы иона и равным ~ (3…5)×10-8 см (хотя с этим трудно согласиться).
В разбавленных растворах (I < 0.1 M) коэффициенты активности ионов меньше единицы, но при I ® 0 величина gi ® 1. Растворы с очень низкой ионной силой (I < 0.0001 M) можно считать идеальными. При высоких ионных силах коэффициенты активности начинают зависеть от природы ионов, а затем и от общего состава раствора. В этих случаях для нахождения коэффициентов активности следует пользоваться конкретными справочными данными. В очень концентрированных растворах (ионная сила больше единицы) коэффициенты активности ионов могут быть намного больше единицы. Причиной этого считается связывание значительного количества растворителя в результате сольватации ионов и, таким образом, в увеличении кажущейся концентрации ионов. При ионных силах от 0.1 до 0.5 М во многих случаях хорошие результаты дают расчеты по уравнению Дэвиса [9]:
lggi = -Azi2(I)1/2/[1+aB(I)1/2]+ CI,
где а и С - константы (подбирают эмпирически для каждого конкретного электролита).
Экспериментально определить коэффициенты активности отдельных ионов невозможно, так как нельзя получить раствор, содержащий ионы только одного сорта. Опытным путем можно было измерить лишь средний коэффициент активности g± ионов электролита AmBn, который связан с коэффициентами активности составляющих его ионов An+ и Bm- следующим образом:
g± = (gAm· gBn)(m+n).
Уравнения Дебая-Хюккеля и Дэвиса пригодны в первом приближении и для расчетов коэффициентов активности незаряженных молекул (неэлектролитов). В этих случаях zi = 0 и в уравнениях Дебая-Хюккеля коэффициент активности неэлектролита равен единице при ионной силе I £ 0.1 М, при больших значениях ионной силы необходимо использовать уравнение Дэвиса, которое для неэлектролитов превращается в lgg = CI. Константа С в этом случае называется солевым коэффициентом, зависящим от диэлектрической проницаемости неэлектролита e. Для веществ с низкойe (газы, сахара, белки) C>0, g > 1. Для таких веществ наблюдается эффект “высаливания”, т.е. уменьшение их растворимости в воде в присутствии электролитов. Для веществ же с высокой e(например, для HCN e = 111) C< 0, g < 1.
Все, что было сказано выше, свидетельствует о непростой ситуации с коэффициентами активности как гидратированных или сольватированных ионов, так и нейтральных молекул (неэлектролитов), для которых до сего времени не было разработано единой, всеохватывающей теории, позволяющей однозначно рассчитывать g. Допускается неоправданно большое число подгоночных параметров при изменениях концентраций одного и того же растворенного вещества и природы растворителя.
Теория гидродинамических флуктуаций в растворах симметричных и несимметричных, сильных и слабых электролитов, предлагаемая нами, дает возможность оценивать коэффициенты активности и отдельных ионов, и недиссоциированных молекул, а также транспортные свойства во всем диапазоне изучаемых концентраций (от 0 до 4-5 моль/л) в любом растворителе.
4. Удельной проводимостью называют меру способности вещества проводить электрический ток. Согласно закону Ома в линейном изотропном веществе удельная проводимость является коэффициентом пропорциональности между плотностью возникающего тока и величиной электрического поля в среде: В системе СИ удельная электропроводность измеряется в сименсах на метр (См/м) или в Ом−1·м−1. В СГСЭ единицей удельной электропроводности является обратная секунда (с−1).
В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает.
5. Молярная электропроводность - это электрическая проводимость плоского слоя раствора электролита толщиной 1 см, содержащего 1 моль растворенного вещества. (эта величина обозначается греческой буквой λ). Зная удельную электропроводность, можно рассчитать молярную электропроводность по несложной формуле:
λ = 1000•κ/C
где C - концентрация раствора, моль/л; κ - удельная электропроводность Ом-1см-1.
с понижением концентрации электролита молярная электропроводность растет, и притом весьма быстро.
чем слабее межионное взаимодействие в растворе, тем свободнее движутся ионы, тем выше электропроводность.
Абсолютной скоростью движения иона называется его скорость при единичном градиенте потенциала в 1 В м-1; ее размерность [ui] = В м2 с-1
6. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB
всегда меньше единицы, но больше нуля (0 < α < 1).
При работе с раствором
сильного электролита необходимо
вычислить коэффициент электропроводности
по уравнению:
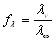
Закон разбавления Оствальда
Материал из Википедии — свободной энциклопедии
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
