
- •Часть III. Термохимия и ионные равновесия
- •1.2. Кислотность водных растворов кислот и оснований.
- •1.3. Сила кислот и оснований в водных растворах.
- •1.4. Буферные растворы.
- •1.5. Фотоколориметрический метод анализа.
- •2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
- •1. Теоретическая часть
- •1.2. Первое начало термодинамики.
- •1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
- •1.4. Теплота растворения, разведения, нейтрализации.
- •2. Определение теплот процессов
- •3. Определение теплоты нейтрализации сильной кислоты
2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
Вещества, поглощающие свет в видимой области спектра с длиной волны 400 нм и более, являются окрашенными. Если окраска вещества изменяется под влиянием каких-либо факторов (температура, кислотность среды и т.п.), оно называется соответствующим индикатором (индикатором температуры, индикатором кислотности и т.д.). Индикаторами кислотности чаще всего являются слабые кислоты или основания, степень ионизации которых зависит от кислотности среды.
Одноцветным индикатором называется слабая кислота или слабое основание, которое при изменении рН среды либо приобретает, либо теряет свою окраску. Это происходит потому, что либо нейтральная молекула, либо ион, образующийся при ее ионизации поглощает свет в видимой области спектра. Двухцветный индикатор при изменении рН среды изменяет свою окраску. В этом случае и нейтральная молекула и ион поглощают свет в видимой области спектра, однако их спектры поглощения различны.
Так, например, слабая органическая кислота п-нитрофенол практически бесцветна, поскольку ее спектр поглощения имеет максимум в области ближнего ультрафиолета (λмакс.< 400 нм), а в видимой области она свет не поглощает. При диссоциации п-нитрофенола происходит образование п-нитрофенолят-аниона, в котором с -электронной системой фенильного ядра сопряжена не одна, а две электронные пары атома кислорода. В результате взаимодействия такого ауксохрома с сопряженной системой хромофоров происходит значительный сдвиг длины волны поглощаемого излучения от 320 нм для п-нитрофенола до 400 нм для п-нитрофенолят-аниона и раствор из бесцветного становится желтым.
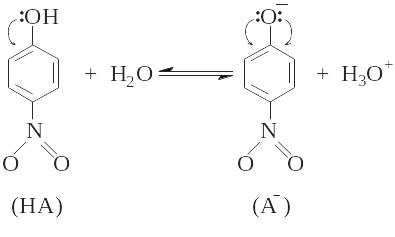
Если равновесие диссоциации слабой кислоты записать как
![]() ,
,
термодинамическая константа этого равновесия принимает вид:
![]() ,
,
а термодинамическая константа кислотности слабой кислоты равная произведению константы равновесия на активность воды принимает вид:
![]() .
.
Коэффициент активности нейтральных молекул HA зависит только от их концентрации и, поскольку для определения Ka используют достаточно низкие концентрации индикатора (10-3 10-4 моль/л), величина fHA близка к единице. Коэффициент активности анионов индикатора зависит от концентрации любых ионов, находящихся в растворе, то есть от ионной силы раствора. Согласно первому приближению теории сильных электролитов Дебая-Хюккеля средний коэффициент активности иона в растворе определяется выражением
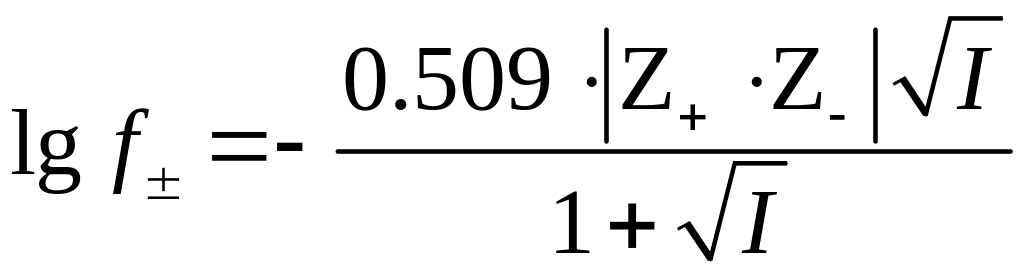 , (5)
, (5)
где
![]() и
и
![]()
заряд катиона и аниона, образующихся
при диссоциации слабой кислоты; I
ионная сила раствора, определяемая как
полусумма произведений концентраций
ионов на квадраты их зарядов:
заряд катиона и аниона, образующихся
при диссоциации слабой кислоты; I
ионная сила раствора, определяемая как
полусумма произведений концентраций
ионов на квадраты их зарядов:
![]() .
.
Следовательно, для вычисления термодинамической константы кислотности слабой кислоты достаточно определить активность ионов гидроксония и отношение концентраций аниона и недиссоциированной формы кислоты. Поскольку концентрация аниона равна произведению степени диссоциации на общую концентрацию кислоты: [A] = CHA, а концентрация недиссоциированной формы равна разности общей концентрации и концентрации ее диссоциированной формы
[HA] = CHA CHA = CHA (1), то
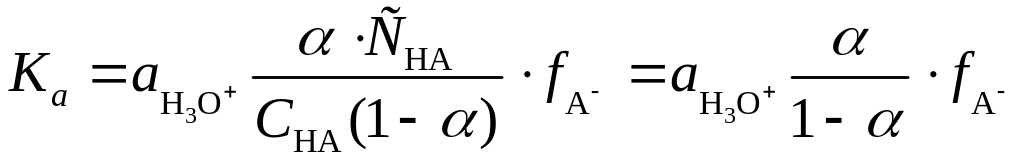 ,
,
или после
логарифмирования:
![]() .
.
Поскольку
![]() ,
а
,
а
![]() ,
то
,
то
![]() .
.
Степень
диссоциации слабой кислоты при данном
значении рН легко может быть найдена
фотоколориметрическим методом в том
случае, если слабая кислота является
одноцветным индикатором, незаряженная
форма которого является бесцветной, а
анион
окрашен. Так, на рис. 2а приведен спектр
поглощения раствора п-нитрофенола
в кислой среде (рН < 5), когда равновесие
его диссоциации полностью сдвинуто
влево. В этом случае
= 0, а значит п-нитрофенол
находится в растворе в виде недиссоциированной
формы НА. Спектр раствора представляет
собой спектр недиссоциированной формы.
В достаточно щелочной среде (рН > 9)
степень диссоциации п-нитрофенола
равна единице и он находится в растворе
исключительно в виде анионов А.
Спектр раствора представляет собой
спектр поглощения аниона. Если рН
раствора достаточен лишь для частичной
диссоциации п-нитрофенола,
спектр поглощения представляет собой
сумму спектров аниона и недиссоциированной
формы. Оптическая плотность раствора
п-нитрофенола,
измеренная при
= 400 нм в условиях, когда молярный
коэффициент экстинкции недиссоциированной
формы НА близок к нулю, определяется
лишь поглощением аниона ![]() . При данной
концентрации п-нитрофенола
зависимость оптической плотности от
рН (рис. 2б)
отражает
зависимость величины степени его
диссоциации от рН, сходную с представленной
на рис.1.
. При данной
концентрации п-нитрофенола
зависимость оптической плотности от
рН (рис. 2б)
отражает
зависимость величины степени его
диссоциации от рН, сходную с представленной
на рис.1.
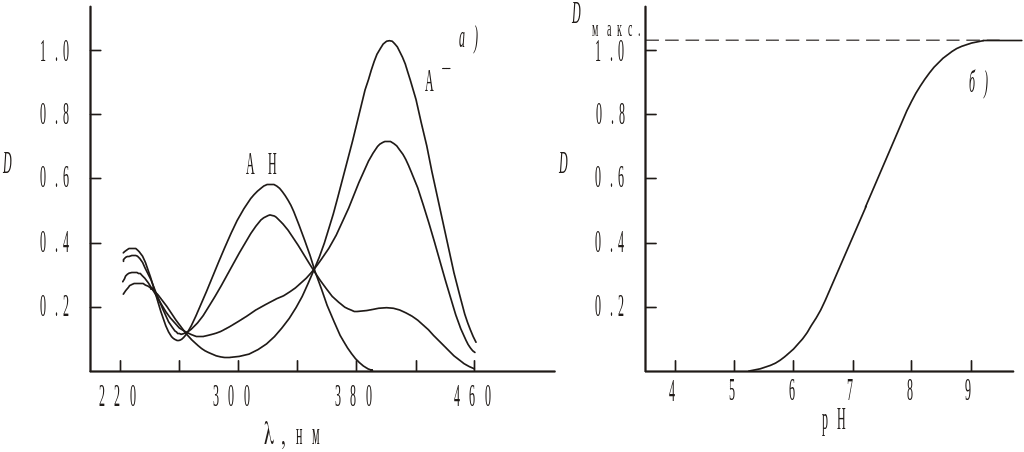
Рис.2. Спектр поглощения раствора п-нитрофенола при различных рН среды (а). Зависимость оптической плотности раствора п-нитрофенола от рН среды при = 400 нм (б).
В
соответствии с изменением степени
диссоциации, с ростом рН раствора
оптическая плотность меняется от 0 до
![]() . Степень
диссоциации при некотором данном
значении рН легко может быть найдена
как отношение
. Степень
диссоциации при некотором данном
значении рН легко может быть найдена
как отношение
![]() к
, поскольку
к
, поскольку
 .
.
Следовательно,
для точного определения термодинамической
константы кислотной диссоциации
одноцветного индикатора достаточно
приготовить его растворы с постоянной
концентрацией СHA
и такими
значениями рН
среды, при которых он диссоциирован
лишь частично, то есть в интервале рН
pKa
1. Измерение оптических плотностей таких
растворов позволяет определить степень
диссоциации и вычислить константу
диссоциации. Для определения интервала
значений рН таких растворов сначала
находят приблизительное значение ![]() и только после этого находят несколько
точных значений, из которых определяют
значения констант кислотности (Ka
=
и только после этого находят несколько
точных значений, из которых определяют
значения констант кислотности (Ka
=
![]() ).
Среднее арифметическое из них является
точным значением термодинамической
константы диссоциации одноцветного
индикатора.
).
Среднее арифметическое из них является
точным значением термодинамической
константы диссоциации одноцветного
индикатора.
3. Ход работы и обработка полученных данных
3.1. В мерную колбу емкостью 50 мл с помощью пипетки помещают 5 мл раствора индикатора, доливают до метки 0.02 н водный раствор NaOH, переливают в коническую колбу и тщательно перемешивают.
3.2. Полученный раствор заливают в кювету фотоколориметра, предварительно ополоснув ее тем же раствором, и измеряют величину (измерение проводят не менее трех раз, усреднив полученные результаты).
3.3. Готовят раствор индикатора с рН 7 для о- и п-нитрофенола и с рН 8 для м-нитрофенола. Для этого в мерную колбу емкостью 50 мл с помощью пипетки заливают 5 мл раствора индикатора и добавляют компоненты буферного раствора в количестве, определяемом из табл.2. Полученный раствор тщательно перемешивают.
3.4.
Измеряют величину
![]() (см. инструкцию к рН-метру) и с помощью
фотоколориметра измеряют величину
оптической плотности
полученного раствора.
(см. инструкцию к рН-метру) и с помощью
фотоколориметра измеряют величину
оптической плотности
полученного раствора.
3.5.
Используя значения
,
и
, вычисляют
степень диссоциации
и затем приближенное значение рК
индикатора:
![]() .
.
3.6.
Вычисляют расчетные значения рН семи
буферных растворов, лежащих в пределах
![]() :
:
![]() .
.
3.7.
Как описано выше (п. 3.3) готовят растворы
индикатора в буферных растворах с
величинами ![]() (требуемые объемы компонентов буферного
раствора находят из табл. 2), измеряют
для них величины
(требуемые объемы компонентов буферного
раствора находят из табл. 2), измеряют
для них величины ![]() и значения оптической плотности D
(как описано в п. 3.2). Заносят полученные
данные в табл. 1.
и значения оптической плотности D
(как описано в п. 3.2). Заносят полученные
данные в табл. 1.
Таблица 1
Индикатор: (
название)
=
; ![]() =
.
=
.
№ р-ра |
|
|
Di |
|
|
pKi |
Ki |
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
3.8.
Пользуясь величинами D
, Dмакс.
и pHизмер.
вычисляют 7 отдельных значений степени
диссоциации
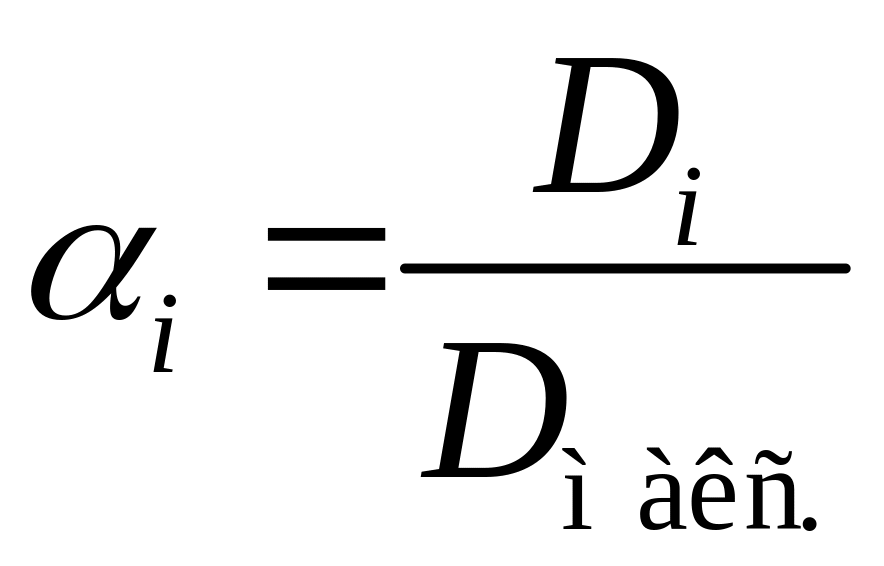 , значений
, значений ![]() по формуле
по формуле
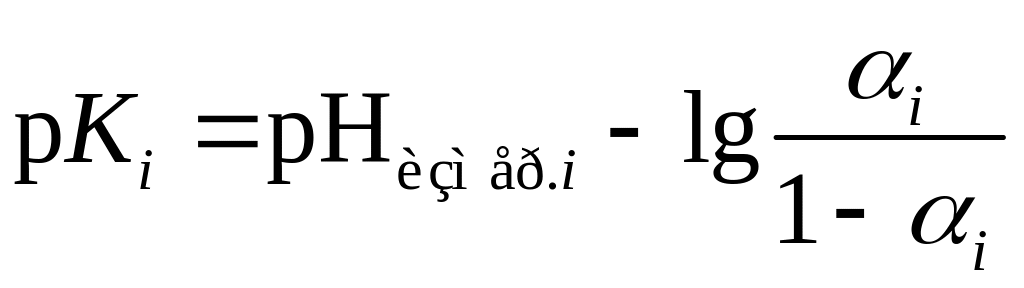 и, наконец, значений концентрационных
констант
и, наконец, значений концентрационных
констант
![]() .
.
3.9.
Находят из них среднее арифметическое
(Kсредн.),
затем по уравнению (5) вычисляют значение
коэффициента активности аниона индикатора
(ионная сила раствора составляет 0.1) и
используют его для вычисления
термодинамической константы кислотности
![]() и величины
и величины
![]() .
.
Таблица 2
Буферная система (ионная сила составляет 0.1):
0.1 н раствор КН2PO4 +0.05 н раствор буры (Na2B4O7)
-
рН*
 р-ра
р-раКН2PO4, мл
рН*
р-ра
КН2PO4, мл
рН*
р-ра
КН2PO4, мл
6.0
39.5
7.1
27.1
8.2
19.6
6.1
38.4
7.2
26.1
8.3
18.3
6.2
37.4
7.3
25.4
8.4
17.1
6.3
36.3
7.4
24.7
8.5
15.9
6.4
35.2
7.5
24.1
8.6
14.6
6.5
34.1
7.6
23.4
8.7
13.2
6.6
33.1
7.7
22.7
8.8
11.7
6.7
31.7
7.8
22.1
8.9
9.7
6.8
30.4
7.9
21.5
9.0
7.7
6.9
29.6
8.0
209
9.1
4.7
7.0
28.1
8.1
20.2
9.2
1.8
*Для получения раствора индикатора с заданным значением рН в мерную колбу на 50 мл налить 5 мл раствора индикатора, необходимое количество раствора КН2PO4 и довести до метки раствором буры.
Контрольные вопросы к теме: "Определение термодинамической константы кислотной диссоциации одноцветного индикатора"
1. Что такое кислоты и основания с точки зрения теории Бренстеда-Лоури?
2.
Чем характеризуется сила кислоты и
основания? Физический смысл величин
![]() .
.
3. Кислотность водных растворов, величина рН среды. Буферные растворы, зависимость рН и величины буферной емкости от их состава.
4. Фотоколориметрический метод анализа, закон светопоглощения.
5. Индикаторы кислотности среды. Фотоколориметрическое определение термодинамической константы кислотности одноцветного индикатора.
6. Ход работы и обработка полученных данных.
Литература
Практические работы по физической химии /Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой. -Л.: Химия, 1982.-С. 153157, 173179.
РАБОТА № 6
КАЛОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ НЕЙТРАЛИЗАЦИИ
