
- •2. Основные законы и формулы по разделам курса физики
- •2.1. Кинематика
- •Угловая скорость
- •2.2. Динамика
- •Это же уравнение в проекциях на касательную и нормаль к траектории точки
- •Сила трения качения
- •2.3. Работа и энергия
- •Сила упругости
- •2.4. Механика твердого тела Момент инерции материальной точки
- •Теорема Штейнера
- •Модуль момента силы
- •2.5. Тяготение. Элементы теории поля
- •2.6. Элементы механики жидкостей
- •Закон Архимеда
- •2.7. Молекулярно-кинетическая теория идеальных газов
- •2.8. Основы термодинамики
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •2.9. Реальные газы, жидкости и твердые тела
- •3. Примеры решения задач
- •Из равенства (3.4) находим
2.8. Основы термодинамики
Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы
![]() .
.
Средняя энергия молекулы
![]() ,
,
где i – число степеней свободы.
Внутренняя энергия идеального газа
![]() ,
,
где – количество вещества; m – масса газа; М – молярная масса газа; R – молярная газовая постоянная.
Первое начало термодинамики
![]() ,
,
где Q – количество теплоты, сообщенное системе или отданное ею; U – изменение ее внутренней энергии; А – работа системы против внешних сил.
Первое начало термодинамики в дифференциальной форме
![]() .
.
Связь между молярной С и удельной с теплоемкостями газа
![]() ,
,
где – молярная масса газа.
Молярные теплоемкости газа при постоянном объеме и постоянном давлении
![]() .
.
Уравнение Майера
![]() .
.
Изменение внутренней энергии идеального газа
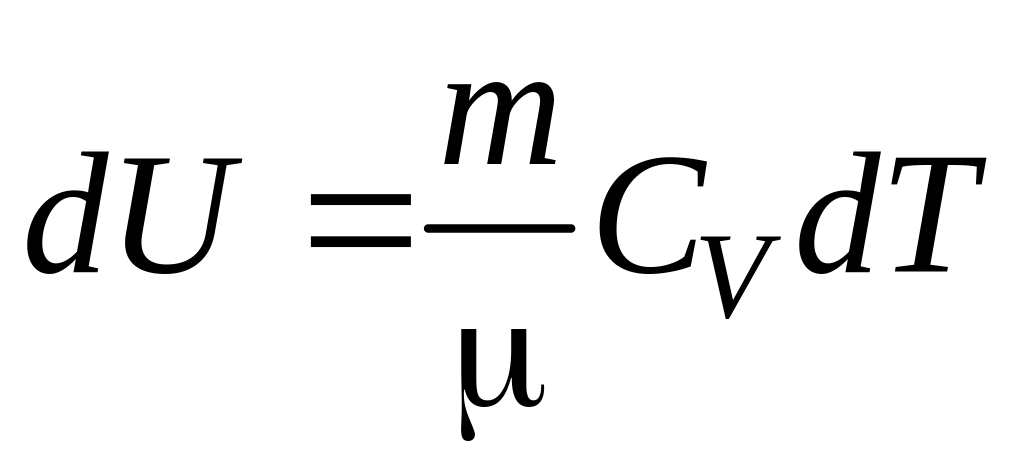 .
.
Элементарная работа, совершаемая газом при изменении его объема
![]() .
.
Полная работа при изменении объема газа
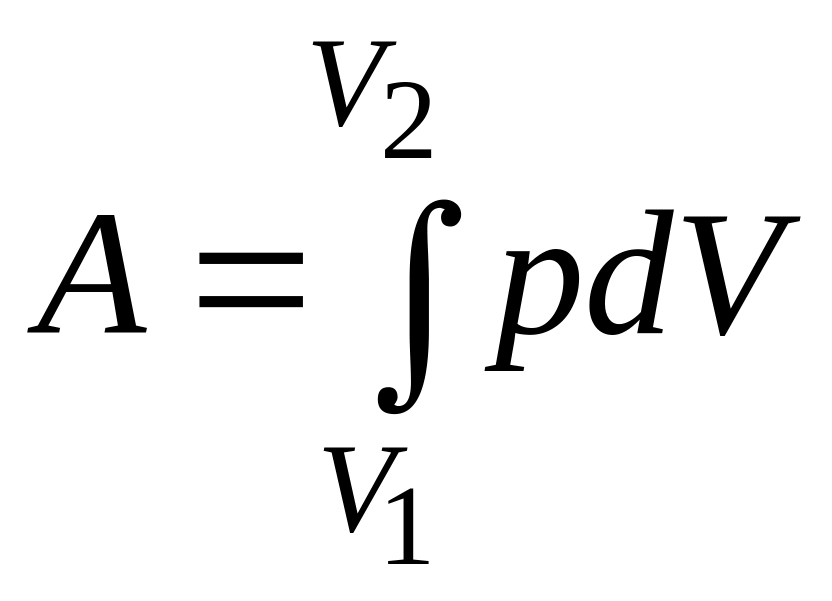 ,
,
где Vl и V2 – соответственно начальный и конечный объемы газа.
Работа газа:
при изобарном процессе
![]() ,
или
,
или
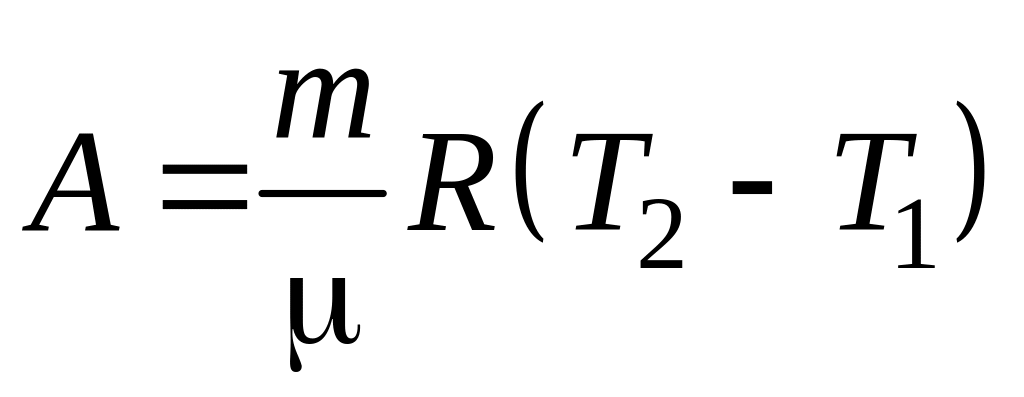 ;
;
при изотермическом процессе
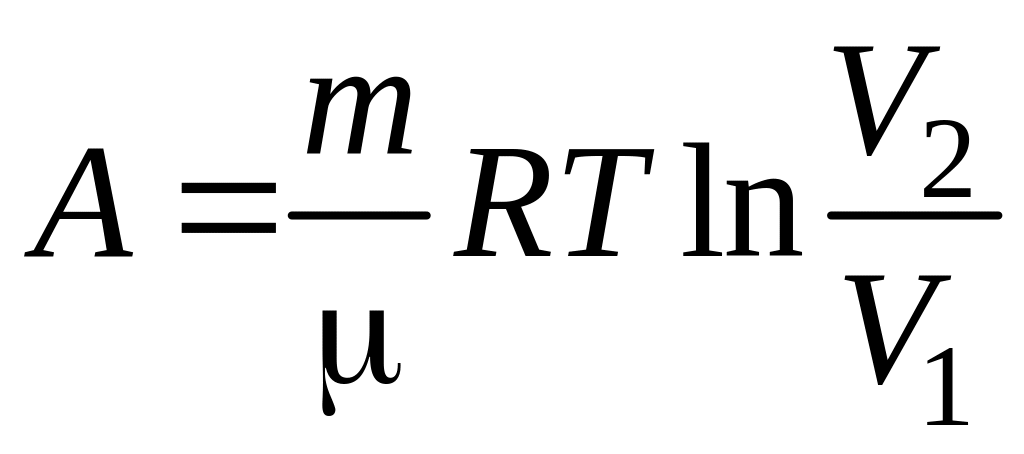 ,
или
,
или
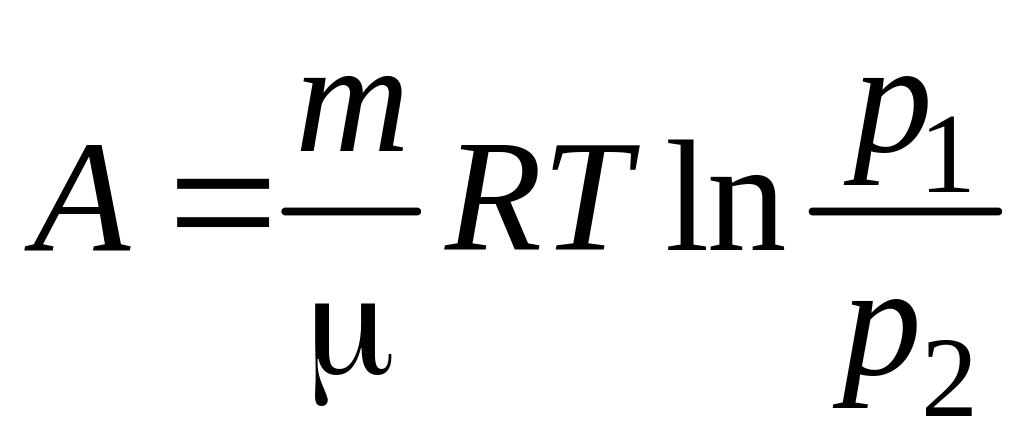 .
.
Уравнение адиабатного процесса (уравнение Пуассона)
pV = const, TV–1 = const, Tp1– = const,
где
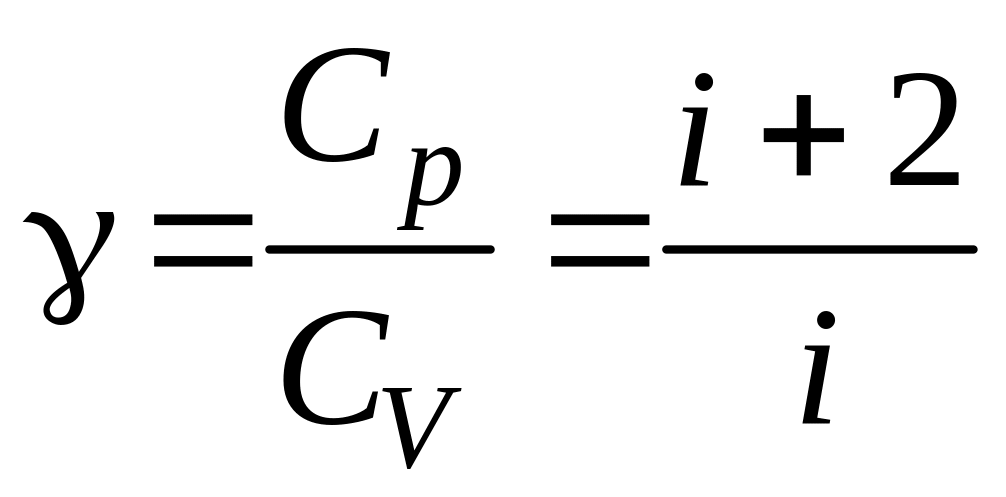 – показатель адиабаты.
– показатель адиабаты.
Работа в случае адиабатного процесса
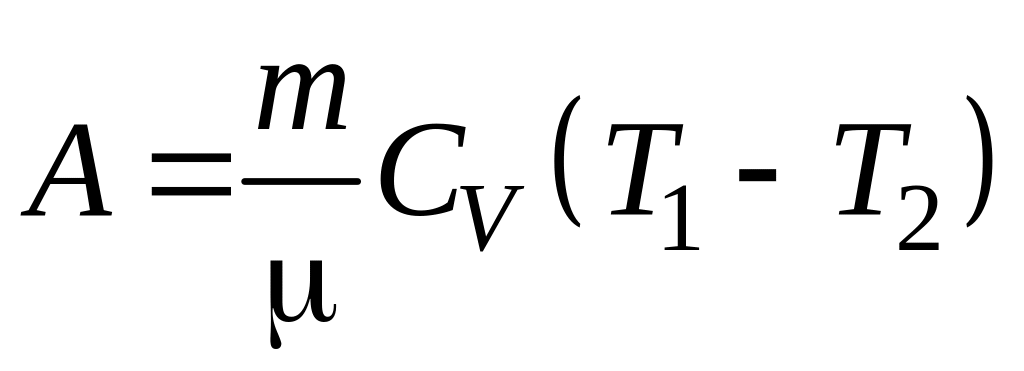 ,
или
,
или
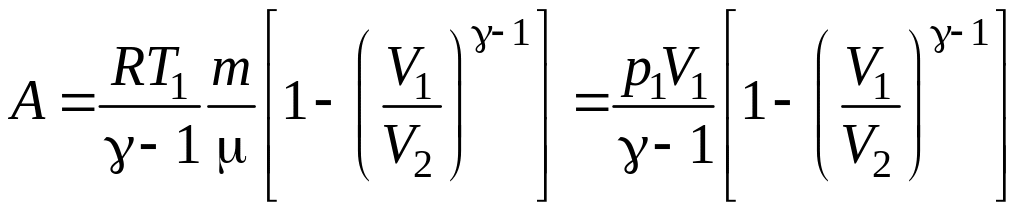 ,
,
где T1, T2, и Vl, V2 – соответственно начальные и конечные температура и объем газа.
Термический коэффициент полезного действия (кпд) для кругового процесса (цикла)
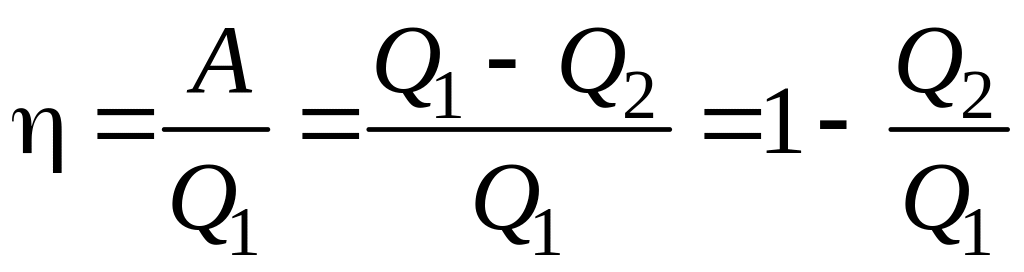 ,
,
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
Термический коэффициент полезного действия цикла Карно
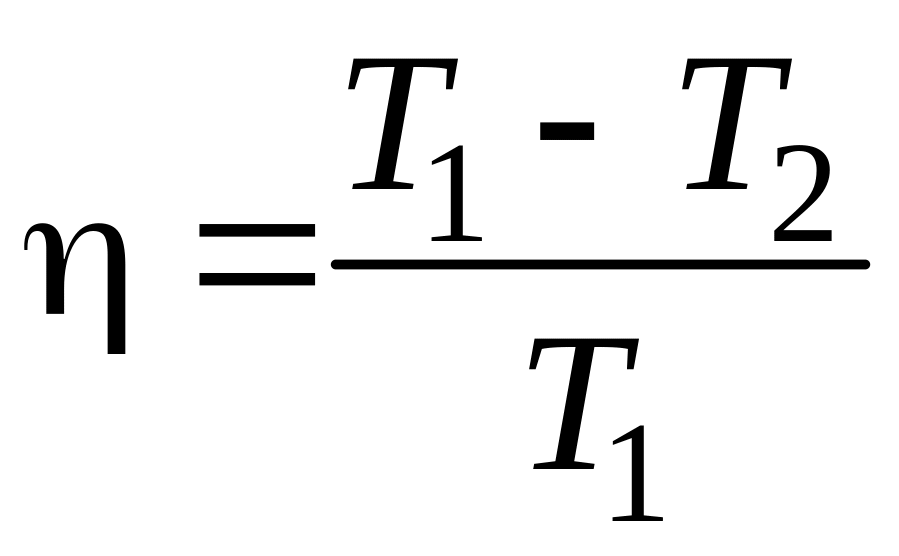 ,
,
где Т1 – температура нагревателя; Т2 – температура холодильника.
Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2
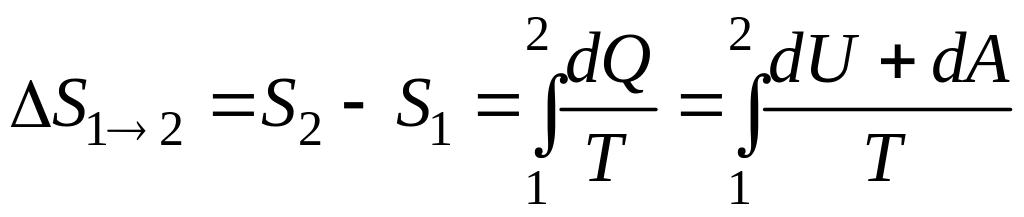 .
.
2.9. Реальные газы, жидкости и твердые тела
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля
 ,
,
где Vm – молярный объём; а и b – постоянные Ван-дер-Ваальса, различные для разных газов.
Уравнение Ван-дер-Ваальса для произвольной массы газа
 ,
,
где = m / – количество вещества, V = Vm.
Внутреннее давление, обусловленное силами взаимодействия молекул,
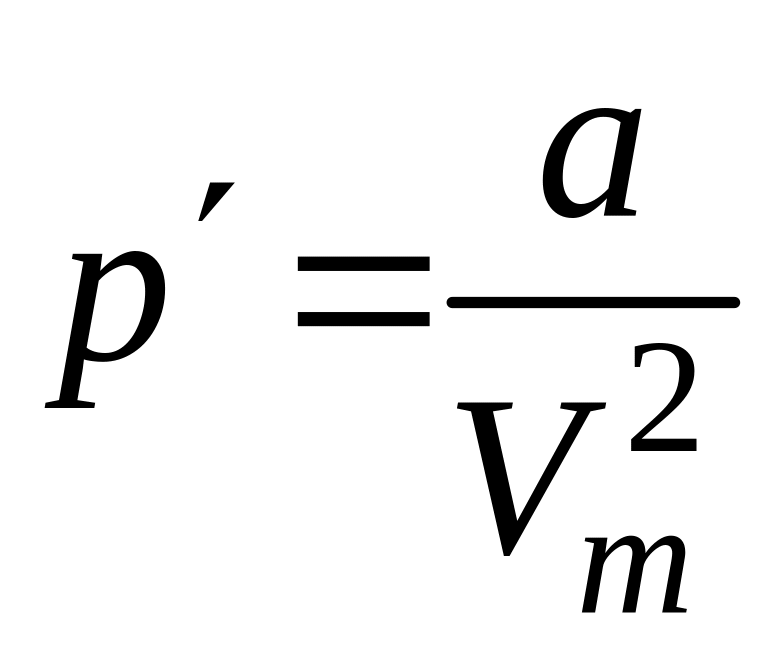 .
.
Критические параметры – объем Vк, давление рк и температура Тк – связаны с постоянными а и b Ван-дер-Ваальса соотношениями:
![]() .
.
Внутренняя энергия 1 моля реального газа
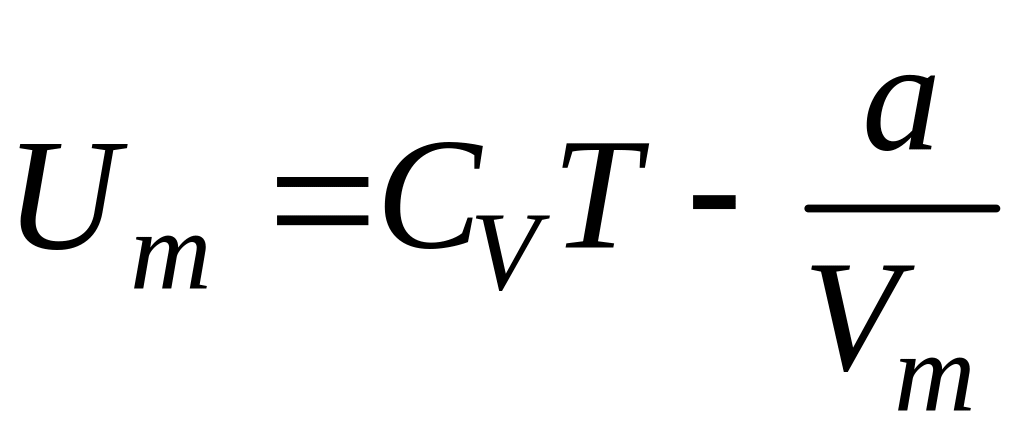 ,
,
где CV – молярная теплоемкость газа при постоянном объеме.
Поверхностное натяжение
![]() ,
или
,
или
![]() ,
,
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости; Е – поверхностная энергия (пропорциональна площади S поверхности пленки).
Формула Лапласа, позволяющая определить избыточное давление для произвольной поверхности жидкости двоякой кривизны:
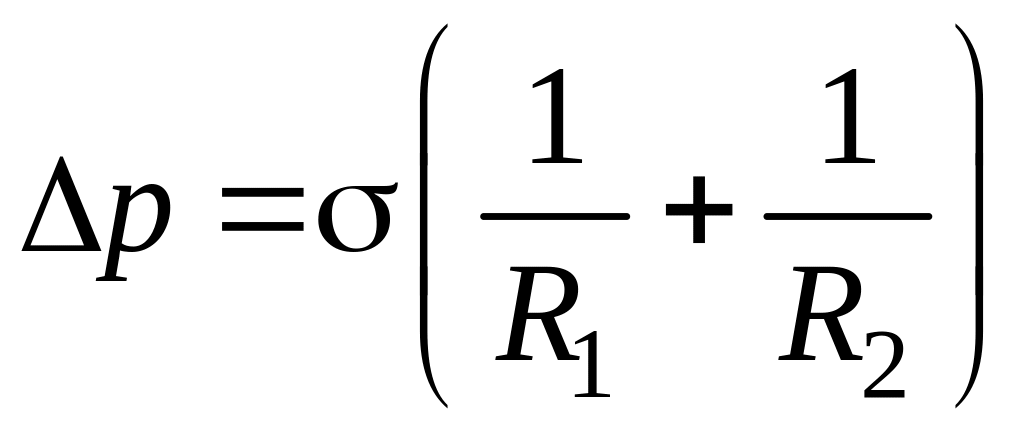 ,
,
где R1 и R2 – радиусы кривизны двух взаимно перпендикулярных нормальных сечений поверхности жидкости; радиус кривизны положителен, если центр кривизны находится внутри жидкости (выпуклый мениск), и отрицателен, если центр кривизны находится вне жидкости (вогнутый мениск). В случае сферической поверхности
![]() .
.
Высота подъема жидкости в капиллярной трубке
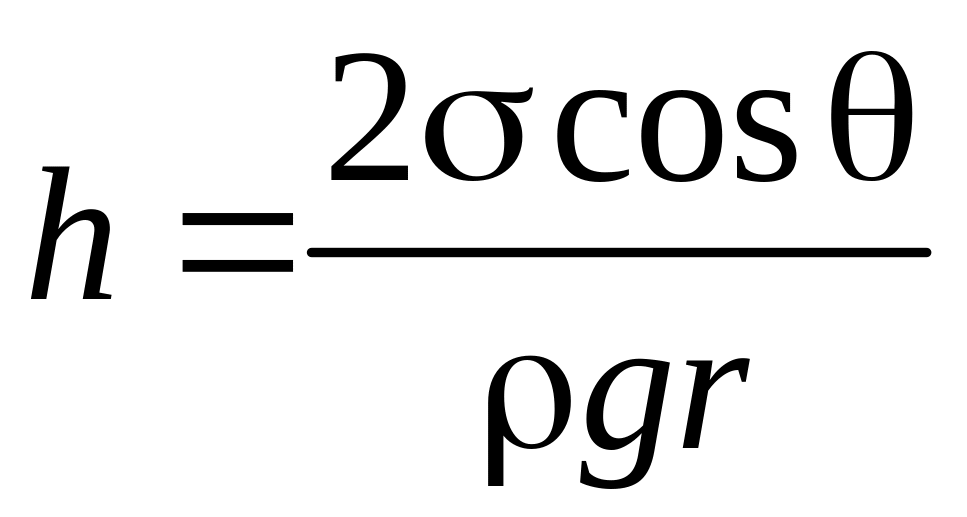 ,
,
где – краевой угол; r – радиус капилляра; – плотность жидкости; g – ускорение свободного падения.
Закон Дюлонга и Пти
![]() ,
,
где СV – молярная (атомная) теплоемкость химически простого твердого тела.
Уравнение Клапейрона – Клаузиуса, позволяющее определить изменение температуры фазового перехода в зависимости от изменения давления при равновесно протекающем процессе
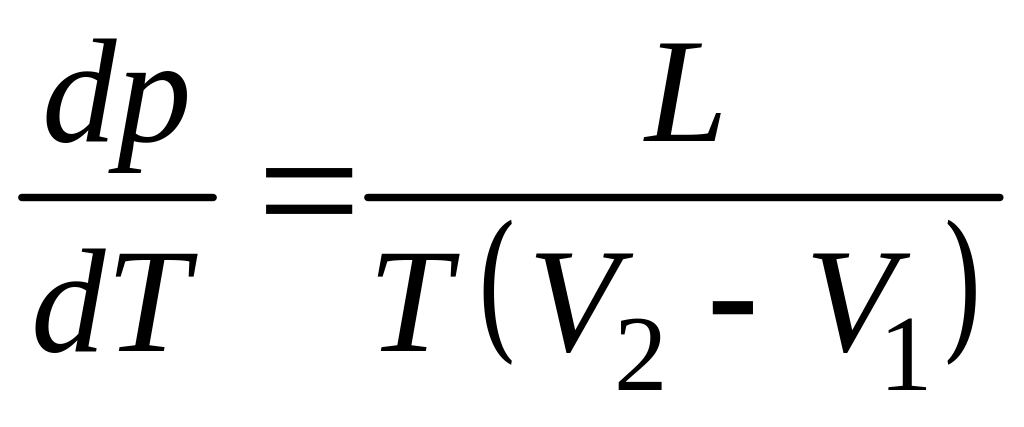 ,
,
где L – теплота фазового перехода; (V2 – V1) – изменение объема вещества при переходе его из первой фазы во вторую; Т – температура перехода (процесс изотермический).
При повышении температуры длина твердых тел возрастает в первом приближении линейно с температурой, т. е.
![]() ,
,
где l1 – длина тела при температуре t, l0 – его длина при температуре 0° С, а – коэффициент линейного теплового расширения.
Для твердых
изотропных тел
![]() ,
где b
– коэффициент объемного теплового
расширения.
,
где b
– коэффициент объемного теплового
расширения.
Относительное изменение длины стержня по закону Гука в случае деформации продольного растяжения (или одностороннего сжатия) стержня
![]() ,
,
где рн
– удельная нагрузка, т.е.
![]() ,
где F
– растягивающая (сжимающая) сила, S
– площадь поперечного сечения,
– коэффициент упругости.
,
где F
– растягивающая (сжимающая) сила, S
– площадь поперечного сечения,
– коэффициент упругости.
Величина
![]() называется модулем упругости (модулем
Юнга).
называется модулем упругости (модулем
Юнга).
Относительное изменение толщины стержня при продольном растяжении
![]() ,
,
где – коэффициент поперечного сжатия.
Величина
![]() называется коэффициентом
Пуассона.
называется коэффициентом
Пуассона.
Для закручивания стержня (проволоки) на некоторый угол необходимо приложить момент пары сил
 ,
,
где l – длина проволоки, r – ее радиус и N – модуль сдвига материала проволоки.
