
- •Прямое определение f-иона с фторселективным электродом
- •1. Определение электродной функции фторид-селективног электрода при комнатной температуре
- •2. Определение коэффициента селективности фторид-селективного электрода по отношению к Cl-ионам
- •3. Калибровка иономера по стандартным растворам без термокомпенсации
- •Введение
- •1.Описание и работа
- •1.1. Назначение и область применения
- •1.2. Устройство анализаторов
- •1.3.Структурная схема измерительного преобразователя
- •1.4. Электродные системы (эс)
- •1.5. Температурный датчик
- •1.6. Датчик кислорода
- •1.7. Органы управления анализатором
- •2. Использование по назначению
- •2.1. Особенности эксплуатации
- •2.2. Использование анализаторов
- •2.3 Ионометрические измерения рХ (pH) в режиме «рН-метр-иономер» на одноканальных анализаторах (один измерительный электрод) без термокомпенсации
- •2.3.1 Выбор измеряемого иона
- •Выбор режима
- •N1 Заряд ?
- •Введите число
- •Выбор режима
- •2.3.2. Градуировка (калибровка) анализатора по выбранному иону
- •Выбор режима
- •Хххх.Х n1
- •Выбор режима
- •2.4. Проведение измерений
Прямое определение f-иона с фторселективным электродом
Суть метода прямой потенциометрии состоит в сравнении равновесного потенциала ионоселективного индикаторного электрода в растворе определяемого иона с потенциалом того же электрода, погруженного в стандартный раствор того же вещества.
Устройство электрода схематически приведено на рис. 1. Электрод состоит из внешнего стакана (1), дном которого является монокристалл фторида лантана, активированного церием, и внутреннего стакана (2), который является внутренним хлорсеребряным электродом.
Рис.
1
При погружении электрода в раствор на внешней и внутренней поверхности мембраны из LaF3 возникают потенциалы, которые обусловлены гетерофазными реакциями, например, реакцией
LaF3 (тв) ⇄ LaF2–(тв) + F–(p-p). (1)
Пространственное разделение зарядов приводит к возникновению потенциала на поверхности. Равновесие (1) характеризуется уравнением Нернста:
 (2)
(2)
Эквивалентную схему потенциометрической ячейки запишем в виде:
внутренний электрод внешний электрод
сравнения 2 сравнения
Ag, AgCl KCl, нас. || NaF, NaCl ▓ испытуемый раствор || КCl, нас. AgCl, Ag
1 ![]()
const
const
Евнутр Евнеш
Измеряемая разность потенциалов складывается в этой цепи из потенциалов на всех ее элементах:
Еизм = Евнешн – Евнутр + 2 – 1, (3)
или после объединения постоянных
Еизм = (Евнешн – Евнутр– 1) + 2 = Е0 + RTpF, (4)
где Е0 – константа для данной электродной системы.
Таким образом, при использовании указанной выше схемы потенциометрической ячейки можно следить за изменением потенциала фторид-селективной мембраны (электрода), т.е. измерять pF в соответствии с уравнением (4).
Одним из основных приемом ионометрии является метод калибровки индикаторного электрода. Для этого измеряют зависимость Еизм от активности ионов в растворах с известной активностью.
Рис. 2. Фторид-селективный
электрод калибруют по растворам NaF,
которые перечислены в таблице.
Таблица 1
Зависимость показателя активности F-ионов от концентрации NaF в воде
СNaF, M |
1·10-1 |
1·10-2 |
1·10-3 |
1·10-4 |
1·10-5 |
1·10-6 |
pF |
1,122 |
2,046 |
3,016 |
4,005 |
5,000 |
6,000 |
После такой градуировки можно измерять pF в растворах практически любого состава при тех же температурных условиях. Современные потенциометры, позволяют сразу отградуировать его шкалу в значениях рХ, в нашем случае pF. Другим распространенным названием иономеров является название "рХ-метр", по аналогии с названием "рН-метр".
Одной из важнейших характеристик ионоселективного электрода является коэффициент селективности КX,X', который характеризует чувствительность электрода к мешающим ионам. Чем меньше коэффициент селективности, тем с большей избирательностью по отношению к определяемому иону в присутствии мешающих ионов работает данный электрод. Этот коэффициент можно определить, используя уравнение Никольского, которое в нашем случае имеет вид:
![]() (5)
(5)
если мешающий ион Cl–.
Один из способов
измерения
![]() заключается в изучении зависимости Е
от
заключается в изучении зависимости Е
от
![]() ,
в присутствии постоянного количества
мешающих Cl–-ионов.
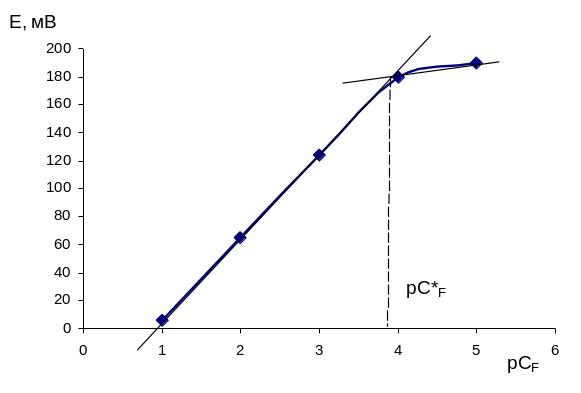
Общий вид такой зависимости показан на
рис. 1.5. В точке пересечения касательных
верхнего и нижнего участков кривой
справедливо равенство:
,
в присутствии постоянного количества
мешающих Cl–-ионов.
Общий вид такой зависимости показан на
рис. 1.5. В точке пересечения касательных
верхнего и нижнего участков кривой
справедливо равенство:
![]() (6)
(6)
Рис.
3.
![]()
где – коэффициент активности иона, зависящий от ионной силы раствора;
Х – коэффициент побочных реакций, зависящий от химического состава раствора.
Обычно основной побочной реакцией для F–-иона является реакция его протонизации, т.к. HF – кислота не очень сильная, pKa = 3,17. Ясно, что при постоянной ионной силе и постоянном рН раствора:
![]()
Эти принципы положены в основу метода определения фторида в водопроводной воде. Анализируемый и стандартный растворы разбавляют раствором фона, который является ацетатным буфером, содержащим NaCl и цитрат натрия. Цитрат-ион образует комплексы с содержащимися в воде Fe3+, Ca2+ и др., тем самым демаскирует F–.
Приборы, оборудование и реактивы
Анализатор жидкости Экперт-001 или его аналог.
Фторид-селективный электрод ЭF-VI или аналог.
Хлорид-серебряный электрод сравнения.
Мешалка магнитная.
Стаканы химические низкие вместимостью 50 мл – 5 шт.
Колбы мерные вместимостью 100 мл – 5 шт.
Пипетка мерная вместимостью 20 мл.
Промывалка.
Шпатель.
Пинцет.
Стандартный раствор NaF: 0,1000 моль/л. Готовят растворением 4,1990 г дважды перекристаллизованного и высушенного при 105 0С NaF в 500 мл дистиллированной воды.
Раствор фона: 0,1 моль/л по CH3COONa; 0,1 моль/л по CH3COOH; 0,1% по цитрату натрия (или лимонной кислоте); 0,2 моль/л по NaCl.
Стандартный раствор NaCl, 1 моль/л.
ПРАКТИЧЕСКИЕ РАБОТЫ
Перед началом работы изучают руководства и инструкции по применению рН-метра-иономера и используемых электродов. Краткие сведения о принципах управления прибором приведены в Приложении. Осуществляют внешний осмотр рабочего места и оборудования с целью проверки комплектности и выявления неисправностей. Включают прибор, согласно п. 2.2.1 Приложения и прогревают в течение 20 мин.
