
- •Раздел I
- •Аппаратура для физиологических исследований
- •Использование средств вычислительной техники для физиологических исследований и анализа результатов
- •Условия, обеспечивающие сохранение функции изолированных тканей
- •Раздел II
- •Раздел III
- •Раздел IV
- •1. Прибор требует прогревания в течение 1 ч.
- •2. Работа прибора с подключенным заборным мешком, у которого пережат резиновый шланг, категорически запрещается.
- •3. Работа прибора с подключенным заборным мешком, из которого отсосался весь воздух, категорически запрещается.
- •Раздел V
- •Корректурная таблица
- •Раздел I. Исследование физиологических функций организма ---------- 5
- •Раздел II. Общая физиология. Физиология возбудимых тканей.
- •Раздел III. Механизмы регуляции физиологических процессов ------------ 95
- •Раздел V. Взаимоотношение организма и окружающей среды. Будылииа с. М., Карцева о. М., Кованое к. В., Милютина л. А........................ --------- 228
Раздел IV
ВНУТРЕННЯЯ СРЕДА ОРГАНИЗМА. СИСТЕМЫ, ОРГАНЫ И ПРОЦЕССЫ, УЧАСТВУЮЩИЕ В ПОДДЕРЖАНИИ ЕЕ ПОСТОЯНСТВА
КРОВЬ
Работа 28. Получение крови для анализа
Получение крови из уха кролика (хронический эксперимент). Для решения ряда экспериментальных задач необходим регулярный забор крови у животных, например у иммунизированных кроликов, для получения иммунных сывороток. С этой целью кровь берут из краевой вены уха кролика.
Метод забора крови из краевой вены уха кролика не сложен.
Для работы необходимо: пинцет, бритва, стаканчик или пробирки, вата, кролик.
Ход работы. Забор крови производят без наркоза, на интактном животном. Кролика предварительно напоить.
Пинцетом выщипывают шерсть по краю уха кролика. Через кожу хорошо видна краевая вена. Бритвой делают надрез вдоль вены, собирают кровь в сосуд. После получения необходимого объема крови (не более 70—80 мл за один раз) область надреза зажимают ватным тампоном.
Рекомендации к оформлению работы. Зарисуйте топографию краевой вены уха кролика.
Получение крови из сонной артерии кролика (острый эксперимент). При выполнении ряда физиологических, биохимических, иммунологических и других работ необходим тотальный забор крови у животных. У кролика это производят непосредственно из сонной артерии.
Для работы необходимо: станок для фиксации кролика, пинцет, зажим, ножницы, стеклянные крючки, шприц, полиэтиленовая трубочка, стаканчик или пробирки, 2% раствор новокаина, нитки, бинты, кролик.
Ход работы. Кролика фиксируют за конечности брюшной стороной вверх. Подкожно в область шеи вводят 2 мл 2% раствора новокаина. Выстригают шерсть на шее. Спустя 5 мин после введения новокаина делают разрез на шее по средней линии.
Кожу отсепаровывают в стороны, вводят 2 мл 2% раствора новокаина внутримышечно в шейные мышцы. Кроме того, орошаются раствором новокаина мышцы. Их отсепаровывают в стороны, при необходимости подрезают. Сонную артерию, находящуюся между трахеей и веной, отсепаровывают на длину 2— 4 см и перевязывают ближе к голове, а ближе к сердцу подводят лигатуру и накладывают зажим. Надрезают артерию между перевязкой и зажимом и вставляют в нее полиэтиленовую трубочку, срезанную под углом. Закрепляют трубочку лигатурой. Свободный конец трубочки опускают в пробирку и снимают зажим. Заполняют несколько центрифужных пробирок. При кровопотере у кролика могут начаться судороги, поэтому его необходимо удерживать руками. Количество крови у млекопитающих составляет 1/1 часть массы тела. Поэтому у кролика весом около 2 кг содержится около 150 мл крови, но практически можно получить не более 100 мл.
Рекомендации к оформлению работы. Зарисуйте топографию сонной артерии.
Получение крови у человека. В клинической практике и при решении ряда экспериментальных задач необходим регулярный забор крови у человека. С этой целью кровь берут из пальца руки.
Для работы необходимо: скарификатор, вата, спирт, эфир, йод.
Ход работы. Дающий кровь садится боком к столу и кладет руку на стол ладонью кверху. Кожу концевой фаланги IV пальца тщательно протирают спиртом, а затем эфиром. Перед проколом кожа должна быть сухой. Сдавливают мякоть концевой фаланги с боков и быстрым резким движением стерильного скарификатора прокалывают кожу. Глубина прокола должна быть такой, чтобы кровь выступала без надавливания.
Первую каплю крови стирают, следующую используют для анализа.
Капля не должна растекаться по коже.
Рекомендации к оформлению работы. Обьяснитс преимущество IV пальца для взятия крови.
Работа 29. Получение плазмы и сыворотки крови
Получение плазмы. Ряд исследований как в клинике, так и в эксперименте проводится с плазмой крови. Например, изучается свертывающая система крови в тестах определения времени рекальцификации плазмы, толерантности плазмы к гепарину и т. д.
Для работы необходимо: стеклянный стаканчик, пробирки, весы для уравновешивания пробирок, центрифуга, пенициллиновые флаконы, стеклограф, цельная кровь; 3,8% раствор цитрата натрия.
Ход работы. Кровь кролика собирают в стеклянный стаканчик с 3,8% раствором цитрата натрия (соотношение консервант/кровь—1:9). Кровь разливают по центрифужным пробиркам и уравновешивают их. Центрифугируют при 1000 об/мин 20 мин. Надосадок (плазму) переносят в пенициллиновые флаконы и используют для дальнейших исследований.
Рекомендации к оформлению работы. Запишите основные константы плазмы крови.
Получение сыворотки. Сыворотка крови необходима при выполнении многих физиологических, биохимических, иммунологических и других исследований, например определения группы крови, получения иммуноглобулинов и т. д.
Для работы необходимо: пробирки, пастеровские пипетки, весы для уравновешивания пробирок, центрифуга, пенициллиновые флаконы, стеклограф, цельная кровь.
Ход работы. Кровь кролика собирают в несколько центрифужных пробирок и «обводят» пастеровской пипеткой, отслоив от стенки пробирки. Процедуру периодически повторяют. Ставят пробирки в холодильник при температуре 4° С на 60 мин. Уравновешивают пробирки и центрифугируют 20 мин при 1000 об/мин. Сыворотку крови переносят в пенициллиновые флаконы.
Рекомендации к оформлению работы. Объясните отличие сыворотки от цельной крови и плазмы крови.
Работа 30. Наблюдение буферных свойств сыворотки крови (опыт Фриденталя)
Кровь высших животных и человека отличается строгим постоянством активной реакции. Величина рН в среднем составляет 7,36 и колеблется в очень узких границах, не выходя за пределы 7,3—7,4, т. е. слабо щелочной реакции. Постоянство рН крови сохраняется, несмотря на непрерывное поступление в кровь кислых и щелочных продуктов обмена. Особенно много образуется в тканях кислых веществ (угольная кислота, молочная кислота и др.). Известно, что для того чтобы сделать реакцию сыворотки щелочной, к ней приходится прибавить в несколько десятков раз (40—70) больше едкого натра, чем к дистиллированной воде. Чтобы сделать реакцию кислой, к сыворотке надо прибавить в несколько сотен раз (300— 400) больше хлористоводородной кислоты, чем к дистиллированной воде. Точной мерой буферной емкости крови по Ван-Слайку является количество грамм-эквивалентов сильной щелочи или сильной кислоты, которое нужно прибавить к 10 мл крови для того, чтобы изменить ее рН на единицу. Постоянство рН крови обеспечивается целым рядом регуляторных механизмов и в первую очередь буферными системами крови.
Для работы необходимо: 2 бюретки, 2 пипетки на 5 мл, 4 стаканчика; 0,01 М раствор едкого кали; 0,1 н. раствор хлористоводородной кислоты, дистиллированная вода, индикаторы: метиловый оранжевый и фенолфталеин, сыворотка крови, разведенная в 10 раз.
Xод работы. Берут 2 чистых стаканчика и наливают в один 5 мл сыворотки, а в другой 5 мл воды, прибавляют в оба стаканчика по капле метилового оранжевого и считая капли, титруют 0,1 н. раствором хлористоводородной кислоты до появления не исчезающего при взбалтывании красного окрашивания. Титрование необходимо начинать с воды, которая не обладает буферными свойствами и используется для контроля. Для простоты отсчет титрования ведется в каплях, а не в миллилитрах титрованного раствора, как обычно.
Берут 2 стаканчика и наливают в один 5 мл сыворотки, а в другой 5 мл воды. Прибавляют в каждый стаканчик по капле фенолфталеина и, считая капли, титруют 0,01 М раствором едкого кали до неисчезающего в течение 1 мин слабого фиолетового окрашивания (для более точного сравнения надо поставить оба стаканчика рядом на белую бумагу).
Рекомендации к оформлению работы. Определите, сколько капель щелочи пошло на титрование воды и сколько капель на титрование сыворотки. Определите, сколько капель кислоты пошло на титрование воды и сколько на титрование сыворотки. Высчитайте во сколько раз больше надо прибавить едкого кали к сыворотке, чем к воде, чтобы сделать реакцию щелочной. Высчитайте, во сколько раз больше нужно прибавить хлористо-водородной кислоты к сыворотке, чем к воде, чтобы сделать реакцию кислой (учтите, что сыворотка разведена в 10 раз). Назовите буферные системы, которые имеются в крови. Напишите уравнения реакции нейтрализации в сыворотке крови хлористоводородной кислоты и едкого кали.
Кровь состоит из жидкой части — плазмы и взвешенных в ней форменных элементов: эритроцитов, лейкоцитов, тромбоцитов. Форменные элементы составляют около 45% объема крови, остальные 55% приходятся на долю плазмы. Количество форменных элементов принято выражать их числом в 1 мкл крови.
В крови содержится в среднем эритроцитов 4,5— 5*1012/л (4 500 000—5 000 000 в 1 мкл), лейкоцитов 4—9- 109/л (4000—9000 в 1 мкл), тромбоцитов 300- 109/л (300 000 в 1 мкл).
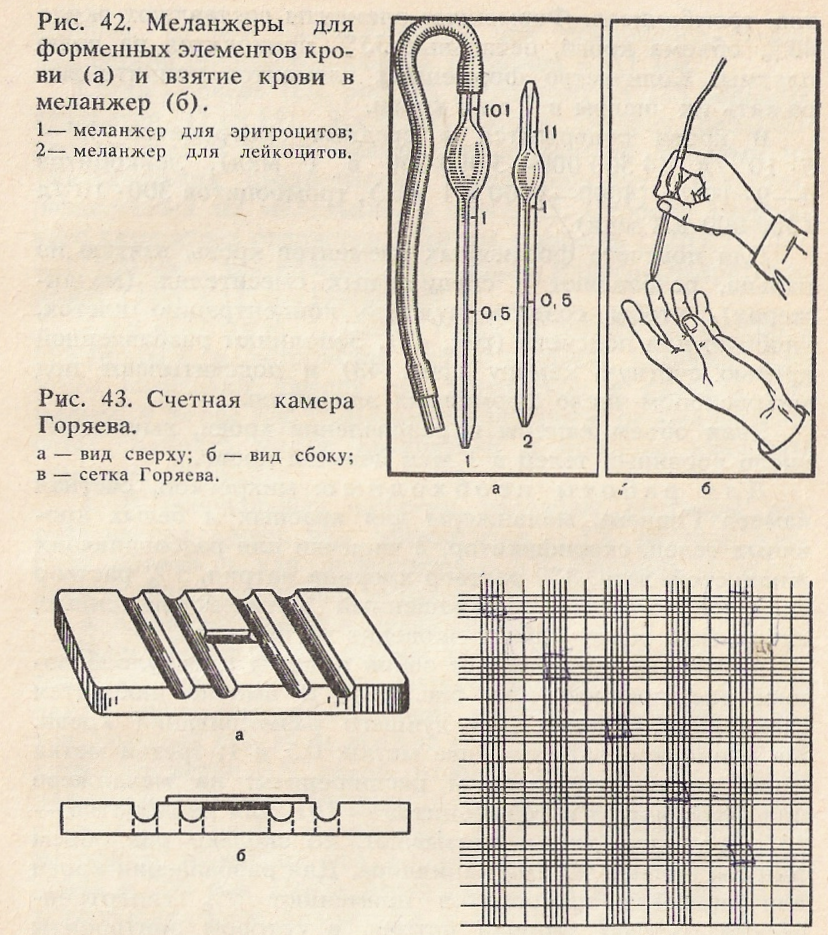
Для подсчета форменных элементов кровь, взятую из пальца, разбавляют в специальных смесителях (меланжерах), чтобы создать нужную концентрацию клеток, удобную для подсчета (рис. 42).
Заполняют разбавленной кровью счетную камеру (рис. 43) и подсчитывают под микроскопом число форменных элементов.
Зная объем камеры и разбавление крови, вычисляют число кровяных телец в 1 мкл цельной крови.
Работа 31. Подсчет форменных элементов крови в камере Горяева
Для работы необходимо: микроскоп, счетная камера Горяева, меланжеры для красных и белых кровяных телец, скарификатор, 2 чашечки для разбавляющих жидкостей, вата, 3% раствор хлорида натрия, 5% раствор уксусной кислоты, подкрашенный метиленовой синью, спирт, йод, эфир. Работу проводят на человеке.
Меланжер представляет собой пипетку с ампулообразным расширением (см. рис. 42). В ампуле находится стеклянная бусинка для лучшего размешивания крови. На капилляре нанесены две метки: 0,5 и 1; третья метка стоит за ампулообразным расширением: на меланжере для эритроцитов и тромбоцитов — 101, для лейкоцитов — 11.
Последние метки указывают, во сколько раз объем ампулы больше объема капилляра. Для разбавления крови для подсчета эритроцитов применяют 3% гипертонический раствор хлорида натрия, в котором эритроциты сморщиваются; для подсчета лейкоцитов применяют 5% раствор уксусной кислоты, подкрашенный метиленовой синью. Кислота разрушает оболочки форменных элементов, а краска окрашивает ядра белых клеток. При этом эритроциты становятся невидимыми и не мешают подсчету лейкоцитов.
Счетная камера (см. рис. 43) представляет собой толстое предметное стекло, в средней части которого имеются 4 желобка. Между ними образуются 3 узкие пластинки. Средняя пластинка ниже боковых на 0,1 мм и разделена пополам поперечным желобком. По обе стороны от желобка расположены сетки.
Так как высота боковых пластинок на 0,1 мм больше средней, то при наложении на них покровного стекла над сеткой образуется камера глубиной в 0,1 мм.
Сетка Горяева (см. рис. 43, в) состоит из 225 больших квадратов (15X15). Каждый третий квадрат разделен дополнительно поперечными и продольными линиями на 16 маленьких квадратиков. Таких больших квадратов, разделенных на маленькие, в сетке 25. Сторона маленького квадратика равняется 1/20 мм, площадь 1/20X1/20= = 1 /400 мм 2, так называемый «объем малого квадратика» равен 1/400X1/10=1/4000 мм3.
Ход работы. 1. Перед началом работы необходимо разобраться в устройстве сетки счетной камеры. Для этого помещают камеру под микроскоп и сначала под малым, а затем под большим увеличением рассматривают сетку, находят малые квадратики и большие квадраты (см. рис. 43, в).
2. В специальные чашечки наливают растворы для разбавления крови: для эритроцитов—3% раствор хлорида натрия и для лейкоцитов — 5% раствор уксусной кислоты, подкрашенный метиленовой синью.
3. Кровь набирают в меланжеры.
Кровь берут из IV пальца левой руки. Первую выступившую каплю стирают ватным тампоном. Во вторую каплю крови погружают кончик меланжера для эритроцитов, который при этом держат горизонтально, и набирают кровь до метки 0,5, следя, чтобы в капилляр не попали пузырьки воздуха. Быстро, пока кровь не свернулась, переносят кончик меланжера в 3% раствор хлорида натрия и набирают его до метки 101, т. е. разводят кровь в 200 раз. После этого смеситель переводят опять в горизонтальное положение и кладут на стол. Тем же способом набирают кровь в меланжер для лейкоцитов до метки 0,5 и уксусную кислоту до метки 11, т. е. разводят кровь в 20 раз.
Подсчет эритроцитов. Берут заполненный меланжер для эритроцитов и, зажав концы его III и I пальцами, в течение 1 мин встряхивают его.
Тотчас после тщательного перемешивания крови, выпустив предварительно наружу 1—2 капли, наносят небольшую капельку на сетку камеры, предварительно путем притирания плотно закрытую покровным стеклышком. Излишек раствора при этом стекает в желобки.
Если капля слишком велика, то жид-, кость может попасть на боковые пластинки камеры и высота слоя будет больше 0,1 мм. В этом случае камеру следует промыть дистиллированной водой, насухо вытереть марлей и заполнить снова. Разведенную кровь следует еще раз перемешать.
Заполнив камеру, ставят ее под микроскоп и, если форменные элементы расположены равномерно (что является показателем хорошего перемешивания крови), приступают к подсчету.
Считать эритроциты удобнее при большом увеличении (окуляр X 7, объектив X 40).
Чтобы получить удовлетворительные данные, необходимо подсчитать число эритроцитов в 5 больших квадратах, расположенных в разных местах сетки, например по диагонали. Рекомендуется вначале на листе бумаги нарисовать пять больших квадратов, разделить их на 16 маленьких и в каждый маленький квадратик вписать найденное число эритроцитов. Во избежание двукратного подсчета клеток, лежащих на границах между малыми квадратиками, руководствуются правилом Егорова: «Относящимися к данному квадратику считаются эритроциты, лежащие как внутри квадратика, так и на его левой и верхней границе.
Эритроциты, лежащие на правой и нижней границе в данном квадратике, не обсчитываются». Подсчитав таким образом число эритроцитов (А) в 5 больших квадратах (что составляет 80 маленьких), находят среднее арифметическое число эритроцитов в одном маленьком квадратике А/80. Зная, что объем части камеры над одним маленьким квадратиком равен 1/4000 мм1, умножают найденное число на 4000.
Получается число эритроцитов в 1 мкл разведенной крови. Умножив на разведение — 200, получают количество эритроцитов в 1 мкл цельной крови. Таким образом, формула для вычисления количества эритроцитов следующая:
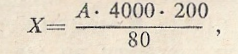
где X — искомое число эритроцитов, А — число эритроцитов в 80 маленьких квадратиках.
Подсчет лейкоцитов. Берут заполненный меланжер для лейкоцитов и, перемешав его содержимое так же, как это рекомендовалось при подсчете эритроцитов, заполняют счетную камеру. Для получения точных- результатов подсчет производят в 25 больших квадратах, что составляет 400 маленьких квадратиков. Лейкоциты удобнее считать при малом увеличении (окуляр Х15, объектив Х20).
Формула для вычисления количества лейкоцитов в 1 мкл крови:
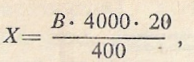
где X — искомое число лейкоцитов в 1 мкл крови; В — число лейкоцитов в 25 больших (400 маленьких) квадратах.
Рекомендации к оформлению работы Запишите количество эритроцитов и лейкоцитов, содержащихся в 1 мкл исследованной крови.
Объясните принцип работы со счетной камерой и формулы для расчета числа форменных элементов крови.
Подсчет тромбоцитов по способу Джавадяна. Тромбоциты играют большую роль в процессе свертывания крови, так как в них содержится профермент — протром-бокиназа. В норме в 1 мкл крови содержится 200 000— 300 000 тромбоцитов.
Для работы необходимо: микроскоп, счетная камера, смеситель для красной крови, скарификатор, спирт, йод, вата, раствор для разбавления крови.
Для приготовления раствора на 100 мл дистиллированной воды берут 3,8 г цитрата натрия, 0,57 г хлорида натрия, 0,15 г метиленовой сини. Раствор кипятят, охлаждают, фильтруют, затем в него добавляют 2—3 капли крепкого формалина.
Ход работы. Прокалывают скарификатором палец и набирают в меланжер для эритроцитов кровь до метки 0,5. Тотчас разбавляют ее раствором до метки 101 (в 200 раз). Тщательно перемешивают, встряхивая меланжер, концы которого при этом зажимают I и III пальцами правой руки. Откладывают меланжер на 10—15 мин для того, чтобы тромбоциты окрасились метиленовой синью.
После повторного перемешивания выпускают 2—3 капли раствора на ватку и одну каплю в счетную камеру под покровное стекло.
Подсчет тромбоцитов ведется под большим увеличением. При правильном соблюдении всех условий тромбоциты распределяются в камере равномерно между эритроцитами и имеют вид голубоватых глыбок. Подсчитывают их число в 25 больших квадратах и вычисляют количество тромбоцитов в 1 мм3 крови по формуле:
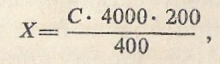 где
С — число тромбоцитов в 25 больших
квадратах, составляющих 400 маленьких
квадратиков.
где
С — число тромбоцитов в 25 больших
квадратах, составляющих 400 маленьких
квадратиков.
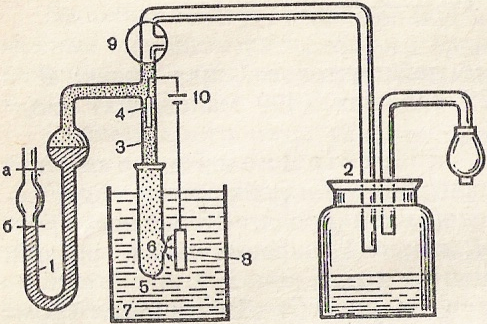
Рис. 44. Схема целлоскопа.
1— ртутный манометр; 2— вакуумная система; 3— стеклянная трубка; 4— электрод; 5— пробирка; 6— калиброванное отверстие — апертура; 7— стаканчик; 8 — второй электрод; 9— кран; 10— источник питания; а, б —уровни объема пробы крови.
Рекомендации к оформлению работы. Запишите количество тромбоцитов, содержащееся в 1 мкл крови. Перечислите основные функции тромбоцитов.
Работа 32. Автоматический подсчет форменных элементов
Для ускорения подсчета форменных элементов крови используют специальные приборы — целлоскопы. Эти приборы состоят из датчика, усилителя и обычно двух регистраторов — осциллоскопа и цифрового регистратора (рис. 44).
Подготовку прибора к работе, его эксплуатацию и приготовление растворов, необходимых для подсчета форменных элементов крови, осуществляют в соответствии с прилагаемой к прибору инструкцией.
Растворы готовят заранее и обязательно фильтруют, так как если в них будут находиться взвешенные частицы, то прибор будет считать их вместе с клетками крови. Приготовленные растворы обозначают цифрами, например I, II, III.
Для работы необходимо: электронный прибор для автоматического подсчета форменных элементов крови (целлоскоп), стерильный скарификатор, фильтровальная бумага, вата, заранее приготовленные растворы для разбавления крови, спирт, йод, эфир. Объект исследования — кровь человека.
Ход работы. Подсчет эритроцитов. Перед подсчетом эритроцитов заполняют датчик электролитом (одним из приготовленных растворов), который замыкает цепь между электродами (см. рис. 44), и устанавливают чувствительность прибора для подсчета частиц, соответствующих диаметру эритроцитов. При этом частицы меньшего диаметра (например, тромбоциты) целлоскопом не подсчитываются. С помощью крана соединяют ртутный манометр с вакуумной системой и перемещают ртуть в манометре ниже отметки «б».
Кровь берут из пальца обычным способом с помощью специального капилляра, имеющегося в комплексе целлоскопа. Капилляр наполняют до метки «кровь» и смешивают это количество крови с предварительно налитым в пробирку 4 мл раствора I. Тщательно перемешав смесь, берут из нее 0,55 мл и вливают в стакан с 20 мл раствора II. Стакан с пробой крови помещают в прибор.
Краном отсоединяют манометр от вакуумной системы. Под действием силы тяжести ртуть в манометре начинает перемещаться и засасывает пробу разбавленной крови через прибор. При прохождении эритроцитов через прибор изменяется сопротивление датчика и формируются электрические сигналы, наблюдаемые на экране осциллоскопа. Когда ртуть в манометре доходит до уровня «б», она замыкает контакты и тогда автоматически включается цифровой регистратор. Цифровой регистратор считает эритроциты в строго определенном объеме пробы крови, ограниченном уровнями «а» и «б». При достижении ртутью уровня «а» счетчик выключается. Для определения числа эритроцитов в 1 мм3 цельной крови обычно показания цифрового регистратора увеличивают в соответствующее число раз, что зависит от разбавления крови.
Подсчет лейкоцитов. Для подсчета лейкоцитов в пробирку, содержащую кровь, разбавленную в 4 мл раствора I, добавляют 0,1 мл раствора III, который гемолизирует эритроциты. Через 1—2 мин туда же добавляют 12 мл раствора II. В результате получается разведенная проба крови с гемолизированными эритроцитами. Стакан с пробой помещают в целлоскоп и производят подсчет лейкоцитов так же, как и эритроцитов. Чувствительность прибора устанавливают так, чтобы он не учитывал частицы с диаметром, меньшим, чем средний диаметр лейкоцитов. Для большей точности подсчета лейкоцитов из полученного значения вычитают число частиц, обнаруженных при исследовании контроля, состав которого — 4 мл раствора I, 12 мл раствора II и 0,1 мл раствора III.
Рекомендации к оформлению работы
Зарисуйте схему целлоскопа и объясните принцип его работы. Запишите результаты проведенных исследований.
Работа 33. Определение гематокритного числа
Отношение объема форменных элементов к объему цельной крови, выраженное в процентах, называется ге-матокритным числом. У взрослых в норме оно равно 40—45%, у новорожденных — 50—55%, в возрасте 5 лет — 35—40%.
Тематокритное число — одна из основных констант крови, изменение которой наблюдается при многих патологических состояниях организма.
Для работы необходимо: центрифуга Шкляра, гематокритныё капилляры, 5% раствор цитрата натрия, цельная кровь.
Ход работы. Кровь для анализа берут из пальца руки человека или проделывают данную работу с кровью кролика. Гематокритныё капилляры промывают раствором цитрата натрия и заполняют кровью.
Центрифугируют 30 мин при 3000 об/мин. При этом под действием центробежной силы форменные элементы смещаются в периферические части капилляров. Ближе к оси центрифуги остается столбик плазмы.
Рекомендации к оформлению работы. После центрифугирования определите длину столбика форменных элементов. Рассчитайте тематокритное число.
Работа 34. Определение количества гемоглобина в крови по способу Сали
Гемоглобин является главной составной частью эритроцитов. Это сложный хромопротеид, состоящий из белка — глобина и пигмента — гема, от которого зависит цвет крови. В состав гема входит один атом железа, который обусловливает способность гемоглобина вступать в соединение с кислородом.
Содержание гемоглобина в крови у здоровых женщин составляет 120—140 г/л, а у мужчин— 130—160 г/л.
Определение содержания гемоглобина в крови производится калориметрическими способами, один из которых (гематиновый метод Сали) основан на образовании устойчивого раствора коричневого цвета при взаимодействии гемоглобина с хлористоводородной кислотой.
Гемометр Сали (рис. 45) представляет собой штатив, задняя стенка которого сделана из белого матового стекла. В штатив вставлены три пробирки одинакового диаметра. Две крайние пробирки (а) запаяны и содержат стандартный раствор хлорида гематина; средняя (б) градуирована. Она предназначена для проведения исследований. К прибору прилагаются пипетка с меткой 20 мм3 и стеклянная палочка. Стандартный раствор хлорида гематина соответствует 167 г/л гемоглобина.
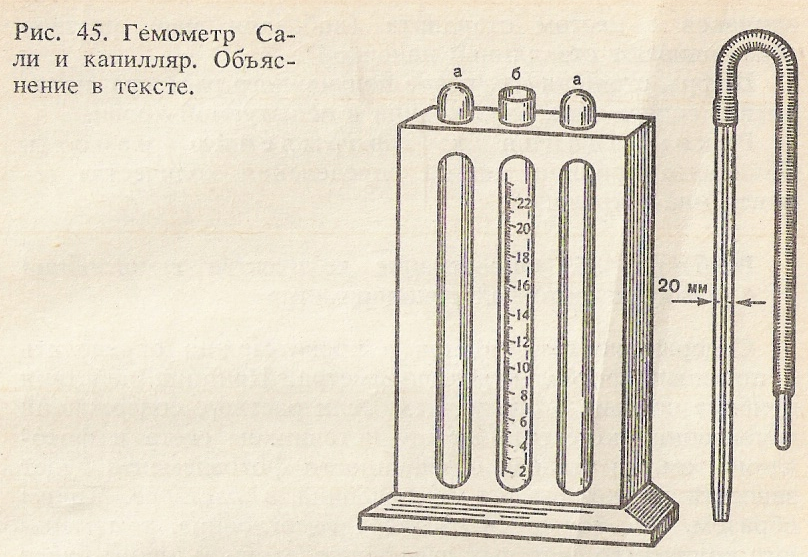
Для работы необходимо: гемометр Сали, пипетка, скарификатор, вата, 0,1 н раствор хлористоводородной кислоты, спирт, эфир, йод, дистиллированная вода. Работа проводится на человеке.
Ход работы. В среднюю пробирку наливают 0,1 н раствор хлористоводородной кислоты до метки. Пипеткой берут 20 мм3 крови из пальца и, обтерев кончик ее ватой, тотчас выдувают кровь на дно пробирки так, чтобы верхний слой кислоты оставался неокрашенным.
Не вынимая пипетку, споласкивают ее кислотой. После этого содержимое пробирки перемешивают, ударяя пальцем по дну пробирки, и ставят в штатив на 5—10 мин. Это время необходимо для полного превращения гемоглобина в солянокислый гематин. Затем к содержимому пробирки добавляют по каплям дистиллированную воду до тех пор, пока цвет полученного раствора не будет совершенно одинаков с цветом стандарта (добавляя воду, раствор перемешивают стеклянной палочкой).
Цифра, стоящая на уровне полученного раствора, показывает содержание гемоглобина в испытуемой крови.
Рекомендации к оформлению работы. Объясните принцип метода определения количества гемоглобина в крови.
Работа 35. Определение количества гемоглобина с помощью фотоэлектроколориметра
Содержание гемоглобина в крови можно определить с помощью фотоэлектроколориметра. Принцип действия прибора состоит в следующем: если раствор, содержащий гемоглобин, поместить между источником света и фотоэлементом, то степень освещенности фотоэлемента будет зависеть от количества гемоглобина в растворе. Таким образом, чем больше в растворе гемоглобина, тем меньшее количество световых лучей определенной длины будет попадать на фотоэлемент и тем меньший фототок будет
в нем возбуждаться.
Фотоэлектроколориметр (рис. 46) состоит из стабилизатора напряжения, стрелочного гальванометра, кюветы для проб с разбавленной и гемолизированной кровью
и потенциометра.
Для работы необходимо: фотоэлектроколориметр, стерильный скарификатор, фильтровальная бумага, вата, специальные растворы для разведения крови (те же, что и при работе с целлоскопом), спирт, эфир, йод. Объект исследования — кровь человека.
анализа (не считая времени взятия крови) занимает 1—2 мин.
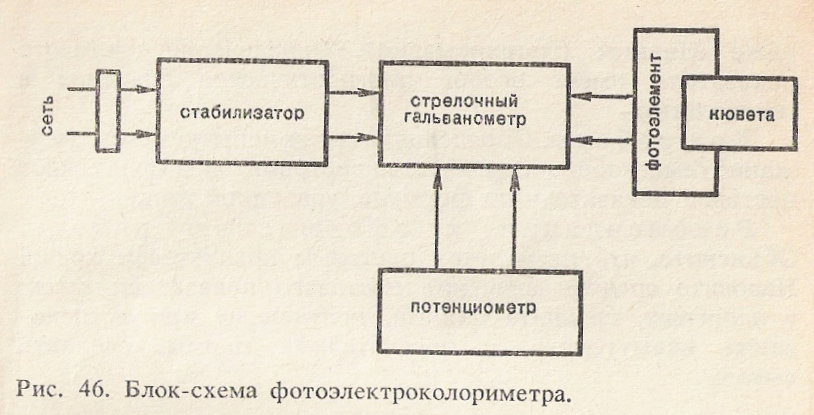
Ход работы. Для определения содержания гемоглобина кровь берут обычным способом из пальца до метки капилляра «кровь» и смешивают ее в пробирке с 4 мл раствора I. В эту пробирку добавляют 0,1 мл раствора III. Смесь переливают в кювету. Через 1—2 мин наблюдается гемолиз. Гальванометр соединяют со стабилизатором, последний включают в сеть. Далее проводят определение гемоглобина, управляя ручками на панели прибора в соответствии с инструкцией по эксплуатации. Отмечают положение стрелки гальванометра, которая показывает относительное содержание гемоглобина в цельной крови в процентах. На основании полученных данных рассчитывают абсолютное содержание гемоглобина в крови. Вся процедура
Рекомендации к оформлению работы: Запишите содержание гемоглобина в исследуемой крови. Охарактеризуйте преимущество данного метода.
Работа 36. Расчет цветового показателя крови
Соотношение между количеством гемоглобина крови и числом эритроцитов носит название цветового показателя. Цветовой показатель позволяет оценить степень насыщения эритроцитов гемоглобином.
В 1 мкл крови в норме содержится 166 * 10-6 г гемоглобина, следовательно содержание гемоглобина в одном эритроците равно:
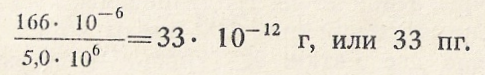
Величину 33 пг, составляющую норму содержания гемоглобина в одном эритроците, принимают за единицу и обозначают как цветовой показатель.
Практически цветовой показатель (ЦП) выполняют делением показателей концентрации гемоглобина, выраженной в г/л, на число из первых трех цифр количества эритроцитов в 1 мкл крови с последующим умножением полученного частного на 3.

При патологических состояниях цветовой показатель может быть больше единицы (гиперхромазия) или ниже единицы (гипохромазия). Определение цветового показателя имеет особое диагностическое значение в гематологии.
Ход работы. Определив в крови испытуемого содержание гемоглобина и количество эритроцитов, высчитывают цветовой показатель по формуле, указанной выше.
Рекомендации к оформлению работы. Объясните, что называется цветовым показателем крови. Назовите средние значения цветового показателя крови у здоровых, сравните данные, полученные при обследовании испытуемого, с показателями нормы, сделайте выводы.
Работа 37. Определение скорости оседания эритроцитов (СОЭ) по Панченкову
Кровь при движении — устойчивая суспензия. При помещении ее в стеклянный сосуд эритроциты в силу их тяжести оседают.
Скорость оседания эритроцитов зависит от состояния организма. При некоторых физиологических состояниях (например, беременность) и при целом ряде заболеваний (туберкулез, ревматизм и др.) оседание эритроцитов бывает значительно ускоренным.
Для определения СОЭ применяют прибор Панчен-кова, состоящий из деревянного штатива, в котором могут быть зажаты в вертикальном положении специальные капилляры. Капилляры градуированы в миллиметрах. Метка 0 стоит на расстоянии 100 мм от конца. На капилляре есть еще две метки: К (кровь) — на высоте нуля и метка Р (реактив) — на уровне 50 мм.
Для работы необходимо: прибор Панченкова, часовое стекло, стерильный скарификатор, вата, 5% раствор нитрат натрия, спирт, эфир, йод. Работу проводят на человеке.
Ход работы. Капилляр промывают 5% раствором цитрата натрия. Затем набирают цитрат натрия до метки Р на уровне 50 мл и выдувают его на часовое стекло. Затем в тот же капилляр двукратно набирают кровь из пальца человека до метки К.
Следует иметь в виду, что для успешного взятия крови прокол пальца должен быть довольно глубоким; капилляр следует держать горизонтально, погрузиз его кончик в каплю крови, при этом кровь сама наполняет капилляр.
Обе порции крови выпускают на часовое стекло, смешивая с имеющимся там цитратом натрия. Полученную таким образом на часовом стекле смесь крови с цитратом натрия в отношении 4:1 набирают в капилляр до метки 0 и ставят капилляр в штатив. Через час смотрят, какова высота в миллиметрах образовавшегося верхнего столбика плазмы в капилляре. Его величина и является мерой СОЭ. В норме СОЭ составляет от 4 до 10 мм/ч; показания от 10 до 15 мм/ч расцениваются как незначительное ускорение, 15—30 мм/ч — среднее ускорение, 30 мм/ч и выше — резкое ускорение.
Примечание: Для практической работы допустимо набирать половинное количество крови и цитрата натрия, т. е. цитрата — 25 мм, крови — 100 мм.
Рекомендации к оформлению работы. Сравните несколько полученных результатов определения СОЭ и дайте им оценку.
Работа 38. Определение вязкости крови
Вязкость крови зависит от количества и объема эритроцитов (понижается при анемии), количества гемоглобина, содержания в крови углекислоты, а также — белков, солей и т. д.
Определение вязкости основано на том, что скорость продвижения жидкостей в одинаковых капиллярах при одинаковой температуре и давлении зависит только от степени внутреннего трения жидкости, т. е. от ее вязкости. Вязкость крови определяется по отношению к вязкости дистиллированной воды, принятой за единицу.
Вязкость крови определяется с помощью вискозиметра, который состоит из двух совершенно одинаковых стеклянных капилляров с делениями от «0» до «10». Капилляры укреплены на штативе и соединены через стеклянный тройник с длинной резиновой трубкой. Левый капилляр предназначен для крови, правый — для воды, он снабжен прямоходовым краном.
Перед употреблением капилляры должны быть тщательно промыты водой, раствором аммиака со спиртом и высушены.
Для работы необходимо: вискозиметр, стерильный скарификатор, вата, раствор аммиака, спирт, йод, дистиллированная вода.
Кровь для исследования берется у человека.
Ход работы. Открыть кран капилляра (т. е. установить его параллельно капилляру). Опустить конец капилляра для воды в дистиллированную воду и набрать ее точно до метки «О», осторожно натягивая ртом через мундштук резиновой трубки. Закрыть кран.
Сделать глубокий укол в мягкие ткани пальца так, чтобы кровь свободно вытекала. Быстро набрать в другой капилляр кровь точно до метки «О». Следить, чтобы в столбиках жидкостей не было воздуха, во избежание свертывания крови. Установить уровень крови на метке «О», положить вискозиметр на стол, открыть кран правого капилляра и осторожно втягивать воздух через мундштук трубки, создавая таким образом вакуум в капиллярах. Довести уровень крови до метки «1» и прекратить втягивание. Отметить, на каком делении остановится уровень воды. Расстояния, пройденные двумя жидкостями в одинаковых условиях за одинаковое время, обратно пропорциональны их вязкости. Следовательно, вязкость крови равна величине расстояния, пройденного водой, деленного на величину расстояния, пройденного кровью. Если вязкость крови значительно выше нормы, следует набирать кровь до метки «1/2» или «3/4», а затем произвести соответствующий расчет.
Рекомендации к оформлению работы. Укажите, соответствует ли полученный результат норме. Объясните, от чего зависит вязкость крови, а также практическое значение определения вязкости крови.
Работа 39. Определение группы крови
Группы крови отличаются друг от друга содержанием агглютиногенов и агглютининов. Агглютиногены — вещества, способные склеиваться; содержатся в эритроцитах. Агглютинины — склеивающие вещества, находятся в плазме.
Имеются
2 вида основных агглютиногенов (А и В) и
соответственно два вида агглютининов
(а и
![]() ).
).
Реакция агглютинации наступает лишь при контакте одноименных агглютиногенов и агглютининов, например: А и а или В и Агглютинацию нельзя смешивать с процессом свертывания крови — выпадением фибрина в виде нерастворимых нитей.
Определение группы крови имеет практическое значение при переливании крови. Учитывают при этом лишь свойства эритроцитов донора и свойства плазмы реципиента, пренебрегая агглютинирующими свойствами плазмы донора, не имеющими практического значения, так как она вводится в малом количестве и, разводясь в крови реципиента, теряет свои агглютинирующие свойства.
Если эритроциты крови донора содержат агглютиногены, одноименные к агглютининам плазмы реципиента, то при переливании такой крови произойдет агглютинация, приводящая к развитию гемолиза и явлений гемотрансфузионного шока. Кровь донора, не имеющая агглютиногенов, одноименных агглютининам реципиента, пригодна для переливания (табл. 5).
Таблица 5. Определение совместимости крови разных групп
Агглютиногены донора |
Агглютинины реципиента |
|||
а (I) |
(И) |
а (III) |
0 (IV) |
|
0 (I) |
_ |
_ |
|
|
А (И) |
+ |
— |
|
_ |
В (III) |
|
+ |
— |
_ |
АВ (IV) |
+ |
+ |
+ |
— |
Примечание: знаком (+) обозначается реакция агглютинации; знаком ( —) —отсутствие таковой.
Группы крови определяют по свойствам эритроцитов, которые устанавливаются с помощью стандартных сывороток, содержащих известные агглютинины.
Для работы необходимо: Предметное стекло, стеклянные палочки, стерильный скарификатор, вата, спирт, эфир, йод, стандартные сыворотки I, II и III групп.
Ход работы. Предметное стекло помещают на белую бумагу и наносят (не смешивая!) по капле стандартной сыворотки I, II, III групп, содержащей соответственно агглютинины I — а и ; II — и III — а. Стеклянной палочкой переносят небольшое количество крови, полученной из пальца, в каплю сыворотки I группы, затем вторым, чистым концом палочки такое же количество крови переносят в сыворотку II группы. Третью каплю переносят в сыворотку III группы промытым и насухо вытертым концом палочки. Каждый раз тщательно размешивают кровь в капле сыворотки, пока смесь не примет равномерно розового цвета. Реакция агглютинации наступает через 1—5 мин. При наличии агглютинации капля становится прозрачной, а эритроциты склеиваются в виде комочков. Группа крови устанавливается в зависимости от наличия или отсутствия агглютинации.
1. Отсутствие агглютинации говорит об отсутствии агглютиногенов в исследуемой крови, что является свойством эритроцитов I группы. 2. Если агглютинация произошла с сывороткой I и III групп, содержащей соответственно агглютинины а, и а, то эритроциты исследуемой крови содержат А-агглютиноген, следовательно, эта кровь принадлежит ко II группе. 3. Если агглютинация произошла с сывороткой I и II групп, содержащей агглютинины а, и , это говорит о наличии В-агглю-тиногена в эритроцитах — III группа исследуемой крови. 4. При наличии агглютинации с сыворотками II, III групп эритроциты содержат А- и В-агглютиногены, что указывает на принадлежность исследуемой крови к IV группе.
Рекомендации к оформлению работы. Определите, к какой группе принадлежит исследованная кровь. Назовите состав ее агглютиногенов и агглютининов. Определите, каким реципиентам может быть перелита кровь Вашей группы и кровь какого донора можно перелить Вам.
Работа 40. Определение резус-фактора крови экспресс-методом
Rh -агглютиноген — один из наиболее широко распространенных агглютиногенов эритроцитов. Его содержание не зависит от наличия других агглютиногенов эритроцитов. Rh-агглютиноген (Rh-фактор) крови не имеет в плазме врожденных агглютининов, однако может являться причиной несовместимости крови при повторном ее переливании.
Методика определения резус-фактора достаточно сложна, однако в последнее время разработан экспресс-метод, облегчающий эту задачу.
Для работы необходимо: Стерильный скарификатор, вата, тарелка, стеклянная палочка, пипетки, физиологический раствор, спирт, йод, стандартная антирезус сыворотка и контрольная сыворотка (не содержащая антирезус антител). Объект исследования — кровь человека.
Ход работы. На тарелку наносят по одной капле контрольной сыворотки (справа — К) и стандартной антирезус сыворотки (слева— Rh). Рядом с каждой сывороткой помещают по одной капле исследуемой крови (размер капли крови должен быть вдвое меньше, чем капля сыворотки).
Последующие манипуляции должны начинаться с контрольной сыворотки, но не наоборот! (в противном случае пользоваться одним концом палочки нельзя). Стеклянной палочкой перемешивают каплю крови с каплей сыворотки (контрольной), образуя общую каплю размером с пятикопеечную монету. Затем подобным же образом перемешивают кровь с антирезус сывороткой. Покачивая тарелку, наблюдают за реакцией. Для лучшего выявления наличия или отсутствия агглютинации можно добавить в обе пробы по капле физиологического раствора.
Если исследуемая кровь резус-положительна, то в пробе со стандартной антирезус сывороткой будет агглютинация эритроцитов (в контроле ее быть не должно). Если кровь резус-отрицательная, агглютинация отсутствует в обеих пробах.
При возникновении агглютинации в пробе с контрольной сывороткой определение следует повторить, либо проводить другими методами.
Рекомендации к оформлению работы. Определите Rh-принадлежность испытуемой крови. Объясните значение Rh-фактора при переливании крови.
Работа 41. Определение совместимости крови с помощью микроцентрифуги Шкляра
Обычно, говоря о совместимости двух групп крови, принимают во внимание лишь эритроциты донора и плазму реципиента, так как плазма донора вводится в малом количестве, и, разбавляясь в крови реципиента, теряет свои агглютинирующие свойства. Однако при переливании значительного количества крови (или обменного) учитывают и агглютинины плазмы донора.
Для работы необходимо: микроцентрифуга Шкляра, стерильный скарификатор, 2 глазные пипетки, предметное стекло, 2 стеклянные палочки, вата, 5% раствор цитрата натрия, спирт, эфир, йод. Объект исследования — кровь человека.
Ход работы. Испытуемых должно быть двое: желательно, чтобы у первого была кровь I группы, у второго — любой другой группы. У обоих испытуемых получают из пальца по 2—3 капли крови. В две микропробирки вводят с помощью пипеток по капле 5% раствора цитрата натрия. Теми же пипетками раздельно набирают по 2 капли крови из пальцев двух участников опыта. Кровь вносят в две разные пробирки и перемешивают с цитратом натрия путем осторожного встряхивания. На пробирках восковым карандашом отмечают группы крови. Помещают пробирки в центрифугу и центрифугируют кровь 10—15 мин (скорость вращения ручки 60 об/мин).
После центрифугирования ставят две пробы на двух предметных стеклах. На первое наносят каплю эритроцитов из пробирки с кровью I группы (а, (3), смешивая с каплей плазмы, взятой из второй пробирки другой пипеткой. Каплю перемешивают стеклянной палочкой. На второе стекло наносят каплю сыворотки, взятой из пробирки с кровью I группы, и совмещают ее с каплей эритроцитов, взятой из второй пробирки. Перемешивают каплю стеклянной чистой палочкой. Наблюдают, есть ли агглютинация на первом и втором стеклах.
Рекомендации к оформлению работы. Отметьте наличие или отсутствие агглютинации. Сделайте заключение о совместимости различных групп крови.
Работа 42. Определение скорости свертывания крови
По Альтгаузену. Данный метод является одним из широко применяемых в клинической практике и основан на определении времени спонтанного появления первых нитей фибрина в цельной крови. Как и другие методы, он позволяет выявить лишь грубый дефицит факторов свертывания. Нормальные показатели скорости свертывания крови при использовании данного метода 5—6 мин при комнатной температуре.
Для работы необходимо: секундомер, стерильный скарификатор, часовое стекло, вата, кусочек марли, спирт, йод, эфир. Объект исследования — кровь человека.
Ход работы. Кровь берут из пальца руки человека. Тщательно промытое и сухое стекло согревают на ладони до температуры тела и наносят на него 2—3 капли крови. Через каждые полминуты проводят через кровь скарификатором пока за иглой не потянется первая нить фибрина. Стекло при этом либо держат на ладони, либо кладут на марлю. Время свертываемости крови зависит от используемого способа определения, поэтому в результатах всегда необходимо указывать метод.
Рекомендации к оформлению работы. Запишите результаты исследования, объясните роль фибриногена в процессе свертывания крови.
По Сухареву. Принцип данного метода также заключается в определении времени спонтанного свертывания цельной крови и позволяет выявить грубый дефицит факторов свертывания (фибриногена, антигемофи-лических глобулинов, протромбина).
Укорочение времени свертывания указывает на тенденцию к гиперкоагуляции. Нормальные показатели: начало свертывания по данному методу от 1/2 до 2 мин, конец свертывания от 3 до 5 мин.
Для работы необходимо: секундомер, капилляры типа Панченкова, стерильный скарификатор, вата, спирт, йод, эфир. Объект исследования — кровь человека.
Ход работы. Кровь для анализа берут из пальца руки человека. Набирают в капилляр столбик крови высотой 25—30 мм. Отмечают по секундомеру время. Наклоном капилляра переводят кровь на середину трубки. Держа капилляр двумя пальцами, покачивают его на 30—45° в обе стороны. Свободное смещение крови показывает, что свертывание еще не наступило.
Начало свертывания характеризуется замедлением движения крови при наклоне капилляра: на его внутренней стенке появляются небольшие сгустки.
Полное свертывание крови соответствует моменту полной остановки движения крови.
Рекомендации к оформлению работы. Запишите основные этапы процесса свертывания крови.
Одним из современных методов многостороннего изучения процесса свертывания крови является метод электрокоагулографии, который позволяет определить: а) начало свертывания; б) конец свертывания; в) скорость свертывания; г) соотношение между форменными элементами и жидкой частью крови; д) плотность кровяного сгустка; е) начало ретракции и фибрииолиза, ж) скорость ретракции и фиб-ринолиза.
КРОВООБРАЩЕНИЕ
Работа 43. Наблюдение и графическая регистрация сокращений сердца лягушки
Функция сердца проявляется в циклической деятельности. Предсердия и желудочки сокращаются и расслаб-' ляются в определенной последовательности. Период,
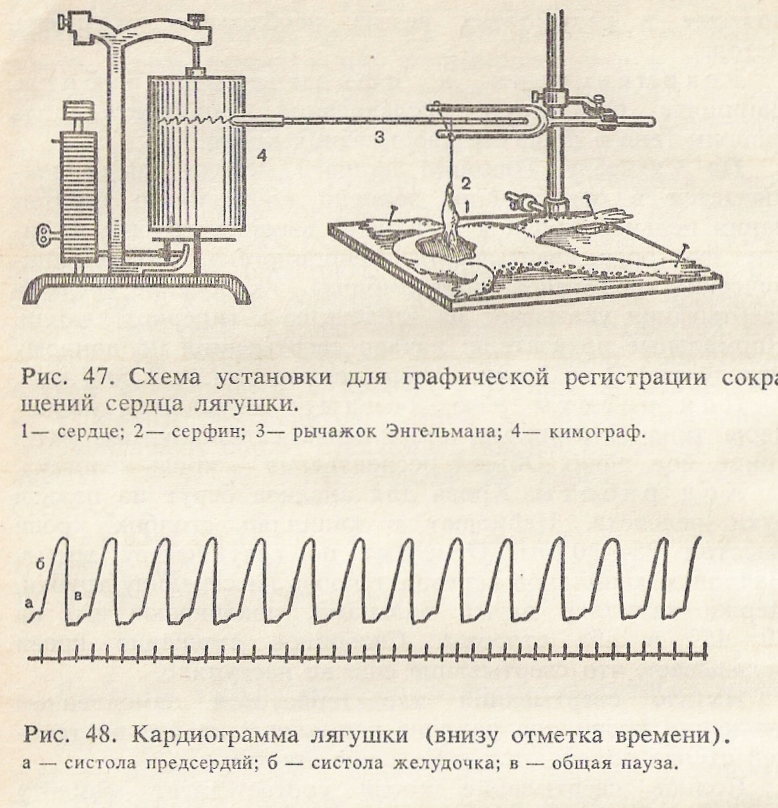
охватывающий одну систолу и одну диастолу предсердий и желудочков и следующую за ними общую паузу, обозначается как цикл сердечной деятельности. Для сердца человека, сокращающегося 75 раз В 1 мин, время сердечного цикла составляет 0,8 с.
Последовательность фаз сердечного цикла (систола желудочков начинается после окончания систолы предсердий) обеспечивает выполнение нагнетательной функции сердца, наличие клапанного аппарата способствует направленному движению крови. Графическую регистрацию сердечного цикла (кардиограмму) традиционно проводят на сердце лягушки (рис. 47).
На кардиограмме отчетливо выражены сокращения предсердий, желудочков и общая пауза (рис. 48). Легко измерить продолжительность этих фаз, а также оценить силу сокращений различных отделов сердца под влиянием положительных и отрицательных инотропных агентов.

Рис. 49. Виды канюль, используемых в опытах с изолированным сердцем лягушки.
а — канюля Штраубе; б — полиэтиленовая канюля.
Способ изготовления полиэтиленовых канюль. Канюли вытягиваются из исписанных полиэтиленовых стержней шариковых ручек, легко поддающихся термической обработке над пламенем свечи или горелки. С этой целью предварительно очищенные хлороформом или эфиром трубки обогреваются на ограниченном участке, а затем растягиваются до заданной длины шейки. После этого вытянутый сегмент стержня рассекается лезвием посредине, а острые края разреза оплавливаются путем кратковременного контакта их с источником пламени (рис. 40).
Для работы необходимо: кимограф, штатив, набор препаровальных инструментов, лоток, рычажок Энгельмаиа, серфин, полиэтиленовая канюля, раствор Рингера для холоднокровных животных, лягушка.
Ход работы. Обездвиживают лягушку. Фиксируют ее на препаровальной дощечке брюшком кверху. Кожу разрезают ножницами вдоль средней линии туловища, начиная от середины живота и кончая нижней челюстью. Края кожного лоскута растягивают в стороны с помощью пинцетов и фиксируют на препаровальной доске. Вскрывают грудную полость; обнажают сердце, с которого удаляют перикард.
Для успешного введения канюли в полость желудочка необходимо учитывать два фактора — малый диаметр аорты и большую крутизну ее дуги. Эти особенности определяют строгую последовательность приемов в процессе работы. Вначале производят перевязку дуг аорты, причем на левой дуге лигатуру затягивают возможно дис-тальнее от сердца с целью облегчить последующую перфорацию стенки сосуда и введение канюли. После этого надсекают стенку левой дуги аорты вблизи перевязочной лигатуры. В это мгновение первые порции крови со значительной силой вытекают из сосуда, поэтому сразу же необходимо осушить салфеткой стенку аорты и вводить канюлю, предварительно заполненную раствором Рингера. Канюля легко продвигается вдоль просвета аорты, одновременно заполняясь кровью, выбрасываемой желудочком.
Опускание канюли в желудочек достигается с помощью специального приема, суть которого состоит в «разгибании» дуги аорты. Для этого левой рукой необходимо фиксировать верхушку сердца серфином с целью управляемого смещения положения сердца в грудной полости, а именно: в момент вхождения канюли в желудочек верхушка сердца должна сместиться к правой лапке и слегка приподняться над уровнем горизонтальной плоскости. В это время ствол канюли производит встречное движение, поворачиваясь вправо к правой лапке. В таком положении производятся поступательные движения канюли с плавными поворотами ее вокруг продольной оси, в результате которых она проникает в полость желудочка, признаком чего являются колебания уровня жидкости, соответствующие периодам сердечного цикла. Если колебания отсутствуют, а кончик канюли располагается в желудочке, тогда необходимо промыть ее раствором Рингера и удалить тромб, замыкающий просвет шейки. Введенную канюлю фиксируют к стенке аорты лигатурой. Для выделения сердца из организма лягушки перевязочные лигатуры собирают в один пучок и удерживают их левой рукой в вертикальном положении так, чтобы основание сердца возвышалось над окружающими тканями. Правой рукой вначале пересекают левую дугу аорты дистальнее места перевязки, а затем — правую дугу. Последними препарируют полые вены и область синусного узла. Изолированное сердце фиксируют к стволу канюли с помощью только одной лигатуры, идущей от места введения ее в аорту; концы остальных лигатур отрезают.
По середине ствола канюлю охватывают куском резиновой трубки, концы которой зажимают в лапке штатива и налаживают контакт верхушки сердца с передним плечом рычажка Энгельмана, который фиксируют на том же штативе ниже уровня канюли с изолированным сердцем.
Важным условием хорошей работы препарата является процедура предварительного уравновешивания обоих плеч рычажка Энгельмана. С этой целью короткое плечо рычажка утяжеляют с помощью кусочков пластилина. Верхушку сердца зажимают металлическим серфином и соединяют с длинным плечом рычажка Энгельмана ниточным приводом.
Механокардиограмма на рис. 48 отражает основные фазы сердечного цикла у лягушки (кроме сокращений синусного узла): 1 — систола предсердий; 2 — систола желудочка; 3 — общая пауза.
Рекомендации к оформлению работ ы. Вклейте полученную кривую в тетрадь. Перечислите фазы сердечного цикла лягушки и обозначьте их на полученной кардиограмме.
Работа 44. Автоматизм сердца, ведущая роль сипусно-предсердного узла в автоматизме сердца лягушки (опыт Гаскелла)
Доказательством автоматизма сердца служит тот факт, что вырезанное из организма сердце продолжает ритмически сокращаться.
Сердце имеет несколько центров автоматизма, однако используя факт влияния температуры на скорость течения физиологических процессов, можно доказать ведущую роль сипусно-предсердного уза в автоматизме сердца.
Если нагревать или охлаждать различные отделы сердца лягушки, то выявляется изменение частоты его сокращений только при изменении температуры синуса, тогда как изменение температуры других отделов сердца (предсердий, желудочка) сказывается лишь на силе мышечных сокращений (рис. 50).

Эффект влияния температуры можно наблюдать и на •полированном, и на неизолированном сердце лягушки.
Для работы необходимо: кимограф, штатив, рычажок Энгельмана, операционный столик, препаро-
вальный набор, лоток, термод С воронкой, термометр водя ной, горячая вода (36— 37° С), лед, раствор Рин-гера, лягушка.
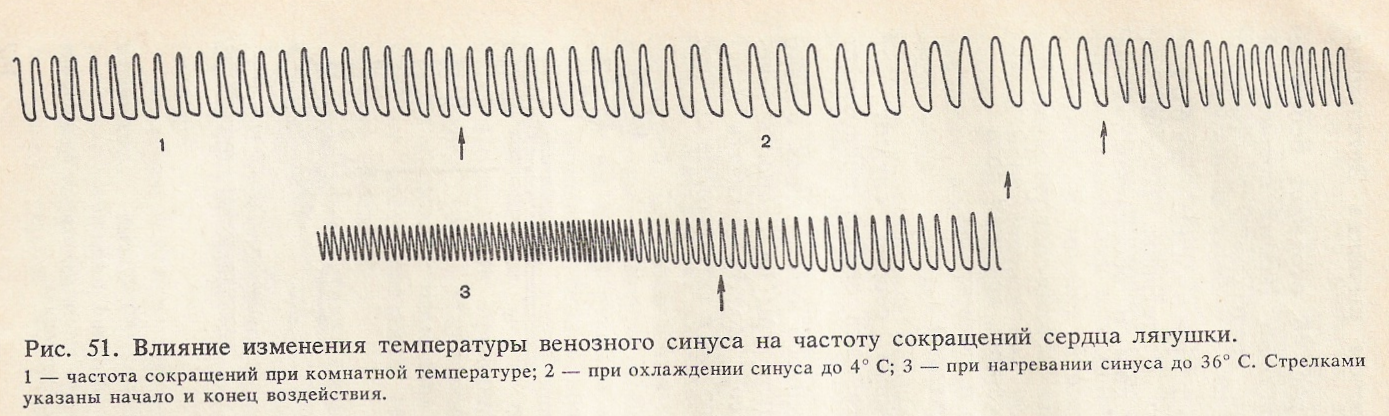
Ход работы. Обездвиживают лягушку, вскрывают грудную клетку и обнажают сердце. Освобождают сердце от перикарда. Укрепляют дощечку с лягушкой в штативе и записывают с помощью рычажка Энгельмана кривую сокращений сердца — кардиограмму. К основанию сердца, находящегося в вертикальном положении, подводят термод, по которому пропускают воду разной температуры (комнатной 4—8° С и 37° С) и продолжают запись (рис. 51).
Аналогичным образом проводят исследование влияния температуры на частоту сокращений сердца, перемещая термод к другим участкам сердца (желудочкам).После прекращения температурного воздействия изолируют сердце из организма, для чего предварительно перевязывают дуги аорты и перерезают их выше места перевязки. Перерезают полые вены, следя за тем, чтобы не повредить венозный синус. Если изоляция сделана правильно, то сердце, вырезанное из тела лягушки и помещенное в физиологический раствор, будет сокращаться продолжительное время.
Рекомендации к оформлению работы. Дайте определение автоматизма и зарисуйте схему расположения основных центров автоматизма. Вклейте полученные кардиограммы. Проведите их анализ.
Работа 45. Анализ проводящей системы сердца (опыт Станниуса)
Впервые ответы на вопросы о локализации центров автоматизма и значении различных отделов сердца в его автоматической деятельности были получены при последовательном наложении трех лигатур, разобщающих отделы сердца лягушки.
Система, проводящая возбуждение, представлена в сердце лягушки двумя образованиями: скоплением атипической мышечной ткани в венозном синусе и скоплением этой ткани, лежащим под эндокардом на границе предсердий и желудочка. Атипические волокна заканчиваются в двух верхних третях желудочка, верхушка которого автиматизмом не обладает.
Для работы необходимо: препаровальный набор, секундомер, раствор Рингера, лягушка.
Ход работы. Обездвиживают лягушку, избегая сильного кровотечения (предпочтителен бескровный метод обездвиживания). Обнажают сердце и перевязывают одной лигатурой обе дуги аорты, после чего перерезают их выше места перевязки. Подсчитывают число сокращений сердца в 1 мин. Запрокидывают сердце и находят границу синуса на его дорсальной стороне. Подводят лигатуру под венозный синус и на границе между синусом и предсердиями делают перевязку (I лигатура Станниуса). Частота сокращений венозного синуса при этом обычно не меняется, а предсердия и желудочек останавливаются. Подсчитывают число сокращений венозного синуса.
Если после наложения 1-й лигатуры сокращения предсердий и желудочка не восстанавливаются самостоятельно, то делают 2-ю перевязку (II лигатуру Станниуса) по атриовентрикулярной борозде, отделяющей предсердия от желудочка. Теперь будет сокращаться венозный синус и желудочек, частота сокращений которого будет более редкой по отношению к первоначальной. Затем делают 3-ю перевязку (III лигатуру Станниуса), отделяя от всего сердца нижнюю треть желудочка (верхушку сердца), ■которая перестает сокращаться (рис. 52).
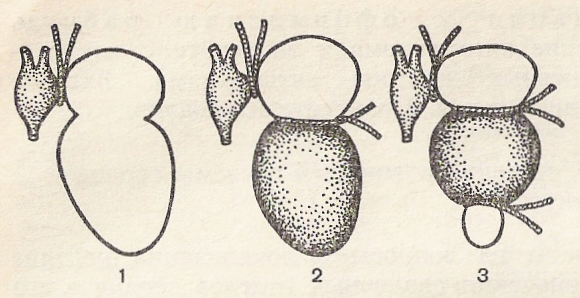
Рис. 52. Схема наложения лигатур по Станниусу.
1— первая лигатура; 2— первая и вторая лигатуры; 3— первая, вторая и третья лигатуры. Части сердца, сокращающиеся после наложения лигатур, затемнены.
Если отрезать верхушку сердца и поместить в каплю раствора Рингера, то, нанеся ей механическое раздражение (укол иглой), можно наблюдать ее способность сокращаться.
Рекомендации к оформлению работы. Нарисуйте схему наложения лигатур. Составьте таблицу изменения частоты сокращений венозного синуса, предсердий и желудочка сердца после наложения каждой лигатуры. Дайте объяснение наблюдаемым эффектам.
Работа 46. Рефрактерный период сердца и экстрасистола
Одной из важнейших физиологических особенностей сердечной мышцы является длительный рефрактерный период, который состоит из двух фаз: фазы абсолютной и фазы относительной рефрактерности. Абсолютная рефрактерная фаза по времени совпадает с систолой, относительная рефрактерная фаза — с диастолой. Если во время систолы желудочка искусственно его раздражать, то можно убедиться, что раздражение остается без ответа. Раздражение, нанесенное на желудочек во время диастолы, вызывает внеочередное сокращение, называемое экстрасистолой, амплитуда которого тем больше, чем ближе к концу диастолы наносится второе раздражение. За желудочковой экстрасистолой всегда следует более продолжительная чем обычно пауза, называемая компенсаторной паузой. Компенсаторная пауза возникает в силу того, что выпадает одно очередное сокращение желудочка, так как импульс, приходящий от водителя ритма сердца, совпадает с рефрактерным периодом желудочков, обусловленным экстрасистолой.
Традиционная запись экстрасистолы и анализ возбудимости миокарда, проводимые на сердце лягушки, сопряжены с рядом методических неудобств.
1. Применяющиеся с целью нанесения раздражения вил очковые электроды в виде жестких усиков затрудняют налаживание надежного контакта с органом, объем которого меняется в соответствии с фазами сердечного цикла.
2. Механическое давление электродов ограничивает амплитуду кардиограммы во время ее регистрации.
Запись экстрасистол на изолированном сердце лягушки лишена указанных недостатков в связи с исполь-зованием для раздражения сердца электродов-серфинов, обеспечивающих надежный контакт с миокардом, не производящих побочных механических раздражений и не ограничивающих амплитуду сокращений сердца.
Металлические серфины используются в учебном процессе с целью фиксации верхушки сердца к рычажку Энгельмаиа. Их легко закреплять также на соединительнотканных структурах, окружающих сердце в любых проекциях.
Связь электродов-серфинов с источником электрического раздражения налаживается с помощью гибкого одножильного провода (обмотка индукционной катушки).
Для работы необходимо: электростимулятор, кимограф, штатив, набор препаровальных инструментов, лоток, электроды-серфины, рычажок Энгельмана, полиэтиленовая канюля, раствор Рингера, лягушка.
Ход работы. Собирают установку для записи работы изолированного сердца лягушки: кимограф с удлинителем, штатив с лапками для фиксации изолированного сердца и рычажок Энгельмаиа, электростимулятор.
Обездвиживают лягушку, разрушая зондом головной и спинной мозг, и закрепляют ее на дощечке брюшком кверху. Затем вскрывают грудную клетку и изолируют сердце на полиэтиленовой канюле описанным ранее методом.
Канюля с изолированным сердцем закрепляется с помощью резиновой трубки в верхней лапке штатива. Связь изолированного сердца с передним плечом рычажка
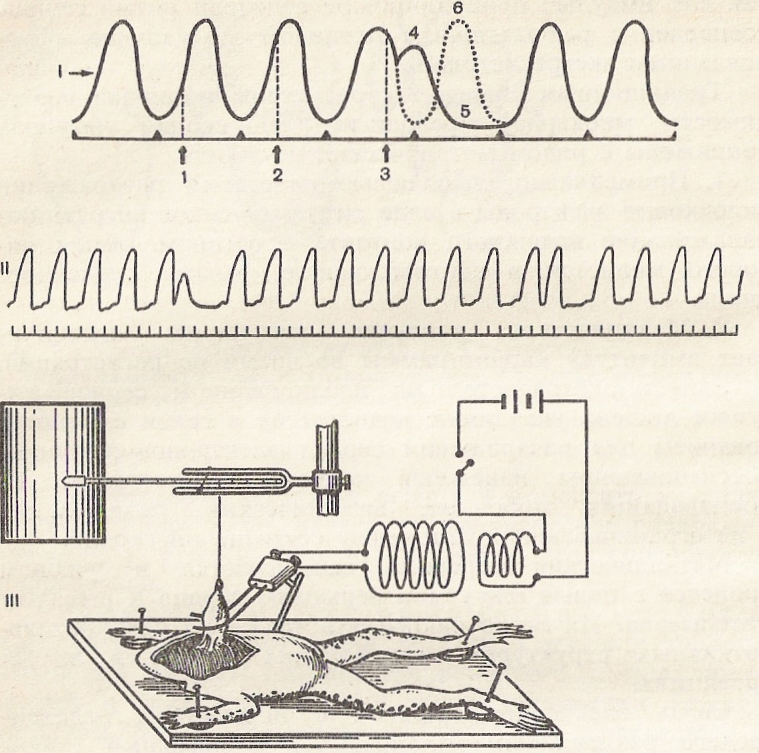
Рис. 53. Экстрасистола и компенсаторная пауза.
а — графическое изображение экстрасистолы и компенсаторной паузы; I — схема, поясняющая механизм возникновения экстрасистолы и компенсаторной паузы; 1, 2, 3— моменты нанесения экстрараздражений; 4— экстрасистола; 5— компенсаторная пауза; 6— очередное сокращение; II — кардиограмма лягушки с экстрасистолами; б — установка для регистрации экстрасистолы.
Энгельмана налаживается с помощью серфина, закрепленного на верхушке сердца, и нитки. Этот же серфин выполняет функцию электрода, обеспечивая проведение к сердцу импульса электрического раздражения от электростимулятора по одножильному гибкому проводнику. Второй электрод-серфин располагается обычно на тканях вблизи основания сердца.
1) Производят запись исходной кардиограммы при скорости движения бумаги, равной 3—4 мм/с. При таком режиме регистрации хорошо видны все периоды механической активности желудочка — период укорочения (восходящий сегмент кардиограммы), период расслабления (нисходящий сегмент кривой), общая пауза (интервал между двумя последующими сокращениями).
2) Прослеживают эффективность одиночных раздражений, наносимых на сердце в различные периоды механической активности желудочков одиночными импульсами постоянного тока при напряжении 1—2 В. Полученные результаты дифференцируются на 4 варианта: а) отсутствие видимого эффекта на раздражение; б) получение экстрасистолы, амплитуда которой меньше величины предшествующего сокращения; в) запись экстрасистолы, амплитуда которой равна высоте предшествующего сокращения; г) регистрация экстрасистолы, амплитуда которой превышает уровень предшествующего сокращения.
Первый эффект воспроизводится в случае нанесения электрического раздражения в период восходящего сегмента кривой, т. е. систолы (абсолютная рефрактерная фаза). Второй — на вершине систолы (относительная рефрактерная фаза). Получить экстрасистолу, амплитуда которой выше уровня предыдущего сокращения, удается при нанесении раздражения на нисходящем — диасто-лическом сегменте кривой кардиограммы (фаза экзальтации), а в период общей паузы воспроизводится экстрасистола, амплитуда которой соответствует уровню предшествующего сокращения — восстановление исходного уровня возбудимости (рис. 53).
Рекомендации к оформлению работы. Дайте определение рефрактерного периода и его фаз. Объясните значение длительной рефрактерной фазы для работы сердца. Дайте определение экстрасистолы. Объясните различную величину экстрасистол. Объясните происхождение и значение компенсаторной паузы.
Работа 47. Влияние раздражения вагосимпатического ствола на работу изолированного сердца лягушки
Сердце сокращается автоматически, но деятельность его должна быть согласована с деятельностью всего организма в целом, что достигается путем нервной и гуморальной регуляции его функций. Сердце связано с ЦНС посредством афферентных и эфферентных нервов. Эфферентные нервы происходят из двух отделов вегетативной нервной системы — парасимпатического и •симпатического, оказывающих в условиях эксперимента противоположные влияния на силу и частоту сердечных сокращений. У лягушки симпатические волокна присоединяются к блуждающему нерву тотчас при выходе его из полости черепа. Раздельная препаровка нервов представляет большие трудности, поэтому предлагается раздражать смешанный вагосимпатический нервный ствол (рис. 54).
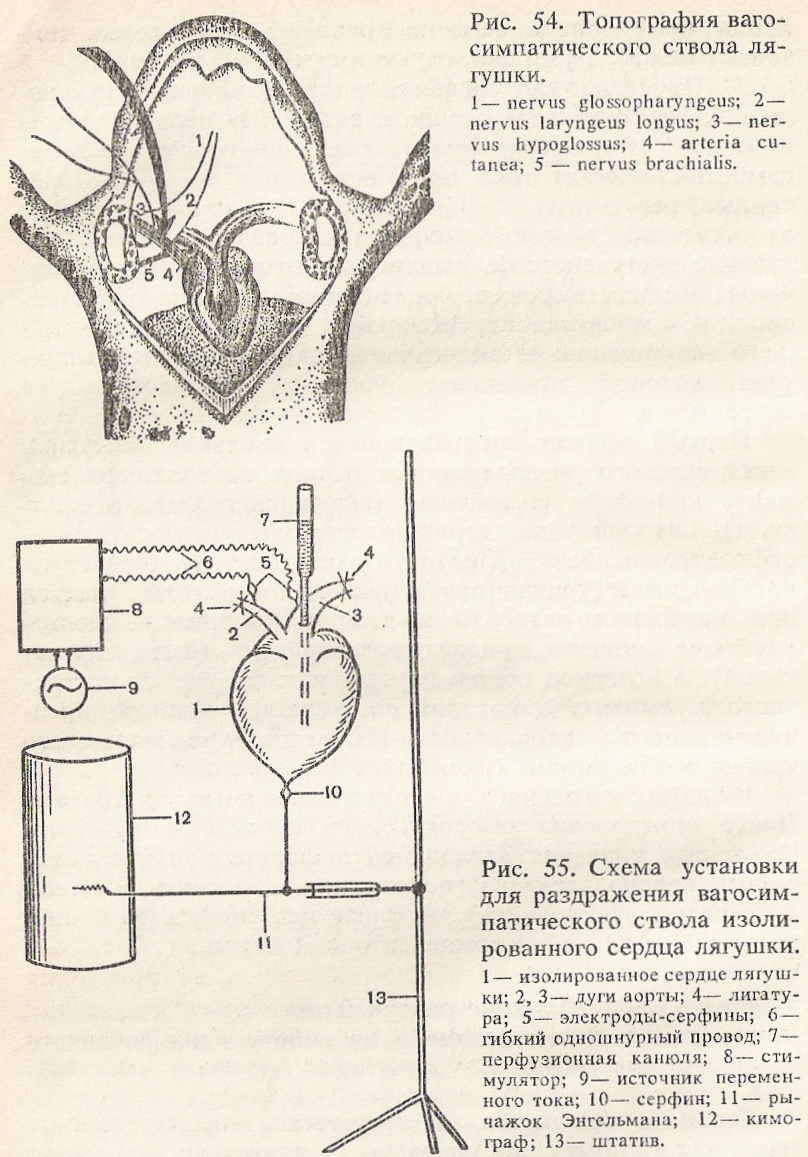
Однако при этом изменения работы сердца протекают разновременно.
При выполнении работы на изолированном сердце лягушки препарировать дистальный конец вагосимпати-ческого ствола нет необходимости, так как для раздражения его достаточно расположить электроды-серфины на уровне правой и левой дуг аорты (рис. 55). Электромагнитное поле, возникающее здесь при прохождении импульсов постоянного тока, достаточно для возбуждения дистального отдела перерезанных блуждающего и симпатического нервов и передачи их влияния на сердце.
Для работы необходимо: электростимулятор, кимограф, штатив, препаровальная дощечка, препаровальный набор инструментов, лоток, рычажок Энгельмана, электроды-серфины, полиэтиленовая канюля, раствор Рингера.
Ход работы. Лягушку обездвиживают и фиксируют на препаровальной дощечке брюшком кверху. Вскрытие грудной клетки и изоляция сердца на полиэтиленовой канюле производятся с помощью метода, описанного ранее.
Электроды-серфины фиксируют в области левой и правой дуг аорты и соединяются гибким одножильным проводом с электростимулятором (см. рис. 55).
На кимографе записывают исходную кардиограмму. Раздражают короткие веточки вагосимпатического ствола, оставшиеся связанными с изолированным сердцем, с помощью серфин-электродов, расположенных у левой и правой дуг аорты, прямоугольными импульсами постоянного тока при частоте 20—30 Гц и при напряжении 1—2 В в течение нескольких секунд до получения эффекта остановки сердца. После прекращения раздражения работа сердца начинает восстанавливаться и часто сопровождается симпатическим последействием (рис. 56).
Рекомендации к оформлению работы. Назовите эфферентные нервы сердца. Объясните превалирующее влияние парасимпатического нерва.
Работа 48. Влияние избытка различных ионов в перфузате на работу изолированного сердца лягушки
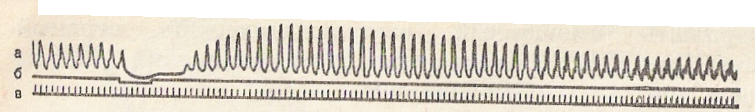
Рис. 56. Влияние раздражения вагосимпатического ствола лягушки на деятельность сердца.
а - кардиограмма; б - отметка раздражения; в - отметка времени.
Гуморальную регуляцию функций сердца можно иллюстрировать, наблюдая изменения работы изолированного сердца лягушки под влиянием увеличения концентрации ионов натрия, калия и кальция в перфузате.
Для работы необходимо: кимограф, штатив, операционный столик, набор препаровальных инструментов, лоток, рычажок Энгельмаиа, серфин, полиэтиленовая канюля, полиэтиленовая пипетка, раствор Рингера, 3% раствор хлорида натрия, 1 % раствор хлорида кальция, 1 % раствор хлорида калия, лягушка.
Ход р а б о ты. Обездвиживают лягушку, а затем фиксируют на операционном столике брюшком кверху. Вскрытие грудной клетки и изоляцию сердца выполняют методом, описанным ранее.
Канюлю с изолированным сердцем фиксируют с помощью резиновой трубки в верхней лапке штатива, а рычажок Энгельмаиа — на более низком уровне и соединяют с верхушкой сердца серфином и ниткой. Производят запись исходной кардиограммы на бумаге кимографа. Поочередно испытывают влияние на работу изолированного сердца 3% хлорида натрия, 1% раствора хлорида калия и 1% раствора хлорида кальция. Поскольку диаметр и емкость полиэтиленовой канюли меньше, чем канюли Штрауба, то раствор соответствующих ионов нужно прибавлять к перфузату не каплями, а на кончике (1 см) полиэтиленовой пипетки, внутренний диаметр которой равен 1 мм. После регистрации влияния каждого раствора на деятельность сердца раствор Рингера в перфузионной канюле многократно обновляется и после 5-минутной паузы можно испытывать влияние другого раствора. В случае передозировки воздействия и появления признаков альтерации или нарушения ритма восстановление работы изолированного сердца производят с помощью повторных растяжений полости желудочка в период диастолы полиэтиленовой пипеткой, заполненной раствором Рингера.
Рекомендации к оформлению работы. Объясните, в какой фазе сердечного цикла и почему останавливается сердце при повышении концентрации в перфузате ионов натрия, калия и кальция.
Работа 49. Влияние растяжения волокон миокарда сердца лягушки на силу его сокращений (закон Старлинга)
Зависимость силы сердечных сокращений от степени растяжения клеток миокарда в период диастолы (закон Старлинга) традиционно демонстрировалась на изолированном сердце с помощью канюли Штрауба. Однако изоляция сердца лягушки на канюле Штрауба не всегда позволяет воспроизвести и зарегистрировать зависимость между величиной исходного растяжения и силой последующего сокращения волокон миокарда.
Использование для этой цели полиэтиленовой канюли дает возможность выявить и четко записать указанную зависимость.
Изменение исходного растяжения стенок желудочка на изолированном сердце регулируют с помощью смещения уровня жидкости в перфузионной канюле. Увеличение этого уровня сопровождается усилением сокращений желудочка и ростом амплитуды кардиограммы. Однако этот способ демонстрации закона сердца не лишен недостатков, которые очевидны при сопоставлении его с условиями эксперимента, в котором этот закон выявлен Старлингом, а именно: на сердечно-легочном препарате изменялся (увеличивался) венозный приток к правому сердцу при неизменном уровне сопротивления оттоку на выходе левого желудочка. В условиях изолированного сердца увеличивается не только сила растяжения желудочка в период диастолы, но также и сопротивление оттоку в систолу, то есть создаются условия для активации гомеометрического механизма регуляции. Поэтому целесообразно использовать для воспроизведения закона сердца на изолированном сердце лягушки импульсоподобное растяжение волокон миокарда в период диастолы с помощью пастеровской полиэтиленовой пипетки, заполненной раствором Рингера.
Для работы необходимо: кимограф, штатив, операционный столик, препаровальный набор инструментов, лоток, рычажок Энгельмаиа, полиэтиленовая канюля, полиэтиленовая пипетка, раствор Рингера, лягушка.
Ход работы. Обездвиживают лягушку, фиксируют на операционном столике брюшком кверху. Вскрытие грудной клетки и изоляцию сердца выполняют методом, описанным ранее.
Канюлю с изолированным сердцем фиксируют с помощью резиновой трубки в верхней лапке штатива, а рычажок Энгельмана — на более низком уровне и соединяют с верхушкой сердца серфином и ниткой.
Производится запись исходной кардиограммы на бумаге кимографа. Уровень жидкости в канюле устанавливают на расстоянии 2 см от начала шейки. Желательно сохранить его в течение всего опыта. Импуль-соподобное растяжение миокарда желудочка моделируется в период диастолы с помощью полиэтиленовой пастеровской пипетки, заполненной раствором Рингера и опущенной в перфузионную канюлю до уровня шейки. Под визуальным контролем записи кардиограммы производят импульсоподобное давление на резиновый колпачок пастеровской пипетки в тот момент, когда рычажок Энгельмана совершает нисходящее колебание. Раствор Рингера под избыточным давлением переходит в полость желудочка и производит его растяжение — кривая кардиограммы начинает увеличиваться по амплитуде, а затем медленно возвращается к исходному уровню.
Рекомендации к оформлению работы. Вклейте в тетрадь полученную кривую и проведите ее анализ. Объясните значение закона Старлинга для функции сердечно-сосудистой системы.
Работа 50. Регистрация потенциалов действия в различных отделах сердца лягушки
Миокард — гетерогенная структура, поэтому форма, амплитуда и продолжительность потенциалов действия (ПД), регистрируемых в миокарде, значительно варьируют в зависимости от типа клеток.
Схематически виды потенциалов действия (ПД) клеток различных отделов сердца представлены на рис. 57.
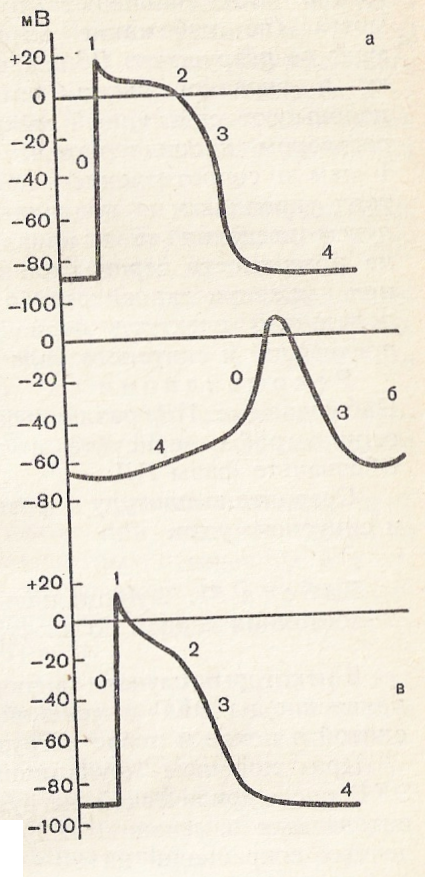
Рис. 57. Виды потенциалов действия клеток различных отделов сердца лягушки.
а — потенциал действия желудочков;
б — потенциал действия проводящей системы сердца;
в — потенциал действия предсердий.
Объяснение в тексте.
ПД клеток желудочков имеет следующие фазы: быстрый начальный подъем — быстрая деполяризация (фаза 0), фаза быстрой реполяризации (1), длительная медленная реполяризация (плато 2). Конечная быстрая реполяри-зация (3), период диастолы (4) —рис. 57, а.
ПД клеток предсердий примерно одинаков по амплитуде (рис. 57, в), а также имеет те же фазы, что и ПД клеток желудочков, однако продолжительность его значительно короче.
Синусный узел лягушки содержит волокна атипического миокарда, обладающие способностью к ритмическому автоматизму, и является водителем ритма для всего сердца. ПД этих клеток имеет ряд особенностей. Он характеризуется наличием во время диастолы (фазы 4) медленной деполяризации, которая постепенно достигает порогового значения, после чего она переходит в быструю деполяризацию, однако скорость ее нарастания довольно низка. Реполяризация также имеет ряд отличий — отсутствует фаза 1 (быстрая реполяризация), отсутствует плато (фаза 2). Амплитуда ПД клеток синусного узла значительно ниже, чем у ПД клеток миокарда предсердий и желудочков (рис. 57, б).
Для работы необходимо: установка для внутриклеточной регистрации ПД отдельных клеток миокарда, состоящая из осциллографа (С 19—Б); усилителя биологических потенциалов (УБП) и катодного повторителя; экранированной камеры; манипулятора для введения плавающего микроэлектрода; препаровальный набор, лоток, операционный столик, стеклянные микроэлектроды, заполненные ЗМ раствором хлорида калия; раствор Рингера; лягушка.
Ход работы. Для опыта берут крупную лягушку-
самца. Обездвиживают путем разрушения спинного мозга (во избежание мышечных наводок). Головной мозг не разрушают. Обнажают сердце. Помещают лягушку в экранированную камеру. Для регистрации ПД используют стеклянный микроэлектрод, заполненный ЗМ раствором хлорида калия, с диаметром канала менее 1 мкм и сопротивлением приблизительно 20 мОм. Электрод укрепляют на подвижной проволочке манипулятора путем введения ее в канал микроэлектрода. Опускают на поверхность сердца кончик микроэлектрода, который при движении тканей сердца проникает в клетку. Последовательно электрод подводят к миокарду желудочка, предсердий и синусного узла лягушки.
Рекомендации к оформлению работы. Наблюдаемые ПД различных клеток миокарда с экрана осциллографа зарисуйте в тетрадь протоколов опытов. Обозначьте фазы ПД.
Сравните амплитуду и фазы ПД желудочка, предсердий и синусного узла.
Работа 51. Функциональные пробы оценки состояния сердца по электрокардиограмме
В некоторых случаях физическая нагрузка провоцирует появление на ЭКГ изменений, не наблюдаемых на ЭКГ, снятой в покое и после нагрузки.
При хорошем функциональном состоянии сердца ЭКГ после физической нагрузки характеризуется незначительными изменениями: 1) увеличивается частота сердечных сокращений на 50—60% по сравнению с исходной и сохраняется синусовый ритм; 2) положение электрической оси не изменяется или несколько смещается вправо, изредка влево; 3) интервал Р — Q не изменяется или незначительно укорачивается; 4) длительность комплекса QRS не изменяется или укорачивается незначительно; 5) сегмент S — Т остается на уровне изоэлектри-ческой линии или смещается книзу не более чем на 0,5 мм; 6) наблюдается уплощение зубца Р в I отведении и увеличение его во II отведении не более чем до 3 мм; 7) несколько увеличивается амплитуда зубца Т во II, III и V2 -отведениях; 8) зубцы Q и S существенно не изменяются или слегка углубляются в I, V4 и V6 -отведениях; 9) восстановление всех исходных показателей заканчивается на 5-й минуте отдыха. Проба может быть также использована для оценки генеза удлинения Р — Q, атрииовентрикулярного ритма, экстрасистолической аритмии и других нарушений ритма. Иногда удлинение Р — Q является следствием повышения, тонуса блуждающего нерва. В этом случае после нагрузки длительность Р — Q нормализуется. Удлинение Р — Q после физической нагрузки указывает на органическую природу удлинения предсердно-желудочковой проводимости.
Для работы необходимо: элекрокардиограф, электроды, марля или фильтровальная бумага, 10% раствор хлорида натрия. Работа проводится на человеке.
Ход работы. Для сравнения результатов исследования в динамике используют одну из общепринятых функциональных проб, которую выбирают в зависимости от состояния испытуемого.
Наибольшее распространение имеют следующие пробы: 1) 20 приседаний; 2) быстрый 15 или 20-секундный бег на месте.
Для проведения указанных функциональных проб необходимо в состоянии покоя при обычном дыхании зарегистрировать ЭКГ в стандартных отведениях и в отведениях V2, V4 V6,. Затем записывают ЭКГ непосредственно после дозированной нагрузки, на 3-й и 6-й минутах после восстановительного периода.
Рекомендации к оформлению работ ы. Электрокардиограммы, зарегистрированные до и после функциональной пробы, вклейте в протокол опыта, обозначьте их зубцы и интервалы. Измерьте зубцы и интервалы ЭКГ и сделайте их сравнительный анализ.
По полученным данным сделайте вывод об изменениях в ЭКГ и о динамике их восстановления.
Работа 52. Определение физической выносливости у человека путем расчета кардиореспираторного индекса (в модификации Н. Н. Самко)
Функциональные системы кровообращения и дыхания относятся к наиболее интенсивно работающим в процессе физических и эмоциональных напряжений, поэтому многие показатели этих систем широко используются для тестирования физической выносливости и тренированности у человека (КРИС), который включает семь параметров и легко может быть проведен в лабораторных условиях.
Для работы необходимо: ртутный или мембранный сфигмоманометр, спирометр, секундомер, велоэргометр или ступенька для выполнения гарвардского степ-теста.
Ход работы. У испытуемого последовательно измеряют артериальное давление (систолическое и диасто-лическое) с помощью сфигмоманометра. Затем с помощью этого же прибора определяют максимальное давление выхода, для чего испытуемый берет в рот резиновую трубку сфигмоманометра и через нее делает максимальный выдох. С помощью спирометра определяют жизненную емкость легких, а с помощью секундомера подсчитывают частоту сердечных сокращений за 10 с и время максимальной задержки дыхания. Все измерения следует проводить быстро и четко. Далее КРИС рассчитывают по формуле:

где ЖЕЛ — жизненная емкость легких (за единицу измерения принимают 100 мл объема); МДВ — максимальное давление выдоха, мм рт. ст.; МЗД — максимальная задержка дыхания после спокойного вдоха, с; возраст — количество полных лет; СД — систолическое давление, в мм рт. ст.; ДД — диастолическое давление, мм рт. ст.; ЧСС — частота средечных сокращений в 1 мин.
КРИС можно определить на протяжении трех фаз физической деятельности: адинамической, динамической и восстановительной.
Адинамическая фаза соответствует 10-минутному отдыху, динамическая фаза — дозированной физической нагрузке величиной порядка 20 кДж, а восстановитльная фаза определяется временем, необходимым для возвращения КРИС в исходный уровень.
Обзор многих лабораторных и клинических работ и тестов показал, что у хорошо подготовленных атлетов величина КРИС в адинамической фазе от 1,000 и выше; у нетренированных, но практически здоровых людей — от 0,800 до 0,900; у больных с различными сердечно-сосудистыми и дыхательными расстройствами величина КРИС находится в пределах 0,300—0,400.
Измерения КРИС, проведенные во время динамической фазы, показали, что у хорошо тренированных атлетов наблюдается уменьшение величины КРИС до 5% исходной величины. У нетренированных, но практически здоровых людей наблюдается падение величины КРИС на 15—30%, а у больных с различными сердечно-сосудистыми и дыхательными расстройствами — на 35— 65%.
В восстановительной фазе у нетренированных, но здоровых людей восстановление исходных параметров происходит за 1—3 мин, а у больных с сердечно-сосудистыми и дыхательными расстройствами за 10 и более минут.
Рекомендации к оформлению работы. Рассчитайте величины КРИС у испытуемых в адинамической и динамической фазе, сделайте вывод об уровне физической выносливости данных испытуемых.
Работа 53. Измерение артериального давления у человека
Величина артериального давления является одной из важнейших констант организма.
Измерение артериального давления можно производить не только прямым, но и косвенным (бескровным) методом, что используется в клинической практике. Принято измерять две величины: наибольшее давление, которое возникает при поступлении крови из сердца в аорту, называемое систолическим, или максимальным давлением, и минимальное, или диастолическое давление, т. е. ту величину, до которой падает давление в артериях во время диастолы сердца. У здорового человека максимальное давление равняется 100—139 мм рт. ст., минимальное 65—89 мм рт. ст. Разница между ними составляет пульсовое давление, которое у здоровых равно примерно 45 мм рт. ст.
Прибор для измерения давления называется сфигмо-манометром.
Для работы необходимо: сфигмоманометр, фонендоскоп. Работа проводится на человеке.
Способ Рива-Роччи. Пальпаторным способом Рива-Роччи можно определить только систолическое давление. За величину систолического давления принимают то наименьшее внешнее давление, которое достаточно, чтобы преодолеть давление внутри артерии, пережать ее и прекратить пульсацию ее периферического конца.
Ход работы. Испытуемого сажают боком к столу. Руку кладут на стол. Накладывают манжетку на обнаженное плечо и закрепляют ее так, чтобы под ней свободно проходили два пальца. Винтовой клапан на груше плотно закрывают, чтобы предотвратить утечку воздуха из системы. Находят пульс на лучевой артерии, прижимая артерию тремя пальцами левой руки, и начинают нагнетать воздух в манжетку, все время следя за пульсом и давлением в манометре. Воздух нагнетают до тех пор, пока не исчезнет пульс. Тогда слегка открывают винтовой клапан и выпускают воздух, давая давлению в манжетке постепенно снижаться. Когда давление в манжетке станет чуть меньше систолического, появляется пульс. Отмечают давление в манометре в момент появления пульса и считают его соответствующим систолическому давлению.
Способ Короткова. Аускультативным способом Короткова можно определить не только систолическое, но и диастолическое давление.
Способ основан на выслушивании звуковых явлений (или сосудистых тонов), слышимых ниже места сдавления артерии, возникающих тогда, когда давление в манжетке ниже систолического, но выше диастолического. При этом во время систолы высокое давление крови внутри артерии преодолевает давление в манжетке, артерия открывается и пропускает кровь. Когда во время диастолы давление в сосуде падает, давление в манжетке становится выше артериального, сжимает артерию и ток крови прекращается. В период систолы кровь, преодолевая давление манжетки, с большой скоростью продвигается вдоль ранее сдавленного участка и, ударяя о стенки артерии ниже манжетки, вызывает появление топов.
Ход работы. Накладывают манжетку на обнаженное плечо. Находят в локтевом сгибе пульсирующую лучевую артерию и устанавливают над ней (не надавливая сильно) фонендоскоп. Создают давление в манжетке, превышающее максимальное, а затем, слегка открыв винтовой клапан, выпускают воздух, что приводит к постепенному снижению давления в манжетке. При определенном давлении раздаются первые слабые коротковские тоны. Давление в манжетке в этот момент принимается за систолическое артериальное давление. При дальнейшем снижении давления в манжетке тоны становятся громче, затем переходят в шумы, далее в очень громкие тоны и, наконец, резко заглушаются или исчезают. Давление воздуха в манжетке в этот момент принимается за диастолическое.
Время, в течение которого производится измерение давления по Короткову, не должно длиться более 1 мин. Если более продолжительное время удерживать давление в манжетке, то объем крови в дистальной части конечности постепенно нарастает, что значительно нарушает ее кровообращение.
Величину пульсового давления рассчитывают, вычитая из величины систолического давления величину диастолического.
Рекомендации к оформлению работы. Объясните происхождение систолического, диастолического и пульсового давления крови. Назовите нормальную величину артериального давления. Сравните ее с полученными цифрами.
Работа 54. Регистрация артериального давления в остром опыте
Помимо непрямого «бескровного» метода измерения артериального давления, применяемого преимущественно на человеке, существует также прямой «кровавый» метод, который используют в опытах на животных.
На кривой записи давления в остром эксперименте различают волны трех порядков (рис. 58). Волны первого порядка, или пульсовые, отражают колебания давления в результате деятельности сердца. Волны второго порядка, или дыхательные, связаны с увеличением притока крови в системе малого круга кровообращения во время вдоха и уменьшением давления в большом круге. Во время выдоха происходят обратные явления. Волны третьего порядка могут возникать при недостаточном кровоснабжении сосудодвигательного центра и изменениях его возбудимости.
Для работы необходимо: электронный измеритель давления с датчиком для регистрации кровяного давления, осциллограф, электрокардиограф, станок для фиксации животного, набор хирургических инструментов и материалов, лоток, шприцы на 5 и 20 мл, артериальная канюля, зажим Диффенбаха, лигатуры, 5% раствор цитрата натрия, гепарин, 20% раствор уретана (гексенала), кролик.
Ход работы. Монтируют установку, в состав которой входят электронный измеритель давления, осциллограф и чернильно-пищущий регистратор (можно использовать электрокардиограф, лучше с замедленной протяжкой бумажной ленты). В различных типах электронных измерителей давления применяются емкостные или те изометрические датчики. Установку включают в сеть и прогревают. На приборах, входящих в установку, устанавливают необходимые режимы работы.
В ушную вену кролика, следя за дыханием, медленно вводят 4—5 мл 20% раствора уретана (внутрибрюшинно 5 мл 20% раствора уретана). Укрепляют животное в станке в положении на спине. Шерсть в области шеи выстригают. Скальпелем разрезают кожу по средней линии шеи. С одной стороны от трахеи находят сонную артерию, отпрепаровывают и подводят под нее две лигатуры. Перевязывают артерию ближе к голове и накладывают на нее артериальный зажим ближе к сердцу. Приподнимают артерию за лигатуру, делают на ней небольшой надрез острыми ножницами, вводят канюлю, заполненную гепарином. Соединяют канюлю с датчиком электронного измерителя давления. Проверяют работу установки, при необходимости дополнительно производят регулировку режимов ее работы и выполняют регистрацию артериального давления. За артериальным давлением наблюдают на экране катодного осциллографа, запись осуществляют с помощью чернильно-пишущего регистратора.
Рекомендации к оформлению работы. Вклейте в тетрадь отрезок кривой давления, указав зарегистрированные в данном эксперименте волны (типичную кривую см. на рис. 58). Объясните, какие механизмы лежат в основе происхождения каждого типа волн.
Работа 55. Влияние раздражения блуждающего и аортального нервов на артериальное давление
Рефлекторная регуляция гемодинамики обеспечивает реакции сердечно-сосудистой системы в ответ на изменяющиеся условия внешней среды. Этот рефлекторный механизм регуляции осуществляется за счет «собственных» и «сопряженных» рефлексов сосудистой системы.
Начальное звено собственных сосудистых рефлексов расположено в стенке самих сосудов в виде барорецепторов, реагирующих на колебания кровяного давления. Собственные рефлекторные влияния, изменяющие уровень артериального давления, исходят из трех основных рефлексогенных зон: аортальной, синокаротидной и зоны, расположенной в устье полых вен. Кроме этих главных зон, во всех отделах сосудистого русла имеются барорецепторы, а также хеморецепторы, реагирующие на изменения химического состава крови. Сопряженные рефлексы берут свое начало в любом органе, имеющем механорецепторы, раздражение которых вызывает соответствующую реакцию сосудистой системы.
Гуморальная регуляция сосудистого тонуса осуществляется за счет тех химических агентов, которые циркулируют в кровеносном русле.
Для работы необходимо: электрокардиограф, стимулятор с раздражающими электродами, осциллограф, кимограф, станок для фиксации кролика, электронный измеритель давлений, набор хирургических инструментов и материалов, лоток, артериальная канюля, стеклянный тройник, зажим Диффенбаха, нитки, 2 шприца на 2 и 10 мл с иглами, гепарин, 20% раствор уретана, 5% раствор цитрата натрия, адреналин (1:1000), ацетилхолин (1 : 100 000), раствор Рингера, кролик.
Ход работы. Электронный измеритель давления подготавливают к работе в соответствии с инструкцией по его эксплуатации. Кролика укрепляют в станке брюшком вверх, наркотизируют 4—5 мл 20% раствора уретана, введенного внутрибрюшинно. Шерсть в области шеи выстригают. Делают разрез по средней линии шеи, тупым путем раздвигают мышцы и фасции шеи, находят с одной стороны от трахеи сосудисто-нервный пучок. Отпрепаровывают сонную артерию, подводят под нее две лигатуры и возможно ближе к голове перевязывают. На конец артерии, расположенной ближе к сердцу, накладывают зажим Диффенбаха. Делают клиновидный надрез сонной
артерии, в который вводят канюлю, заполненную гепарином. Снимают зажимы с резиновой трубки и сонной артерии и регистрируют колебания артериального давления одновременно на кимографе, электрокардиографе с помощью электронного измерителя давления и на экране осциллографа.
Отпрепаровывают блуждающий нерв (самый толстый нерв сосудисто-нервного пучка шеи), подводят под него лигатуру, перевязывают ближе к голове и перерезают, оставляя на лигатуре его периферический конец. Осторожно подводят лигатуру под депрессорный нерв (самый тонкий нерв), лежащий рядом с сонной артерией, перевязывают его как можно ближе к сердцу и перерезают. Чтобы нервы не подсыхали, их кладут на мышцы и прикрывают ватой, смоченной в теплом растворе Рингера. Записывают нормальную кривую артериального давления (перед записью давления писчиком на бумаге кимографа подчеркивают нулевую линию). Подводят под депрессорный нерв электроды и, пользуясь импульсным стимулятором, раздражают его в течение 10—15 с ритмическими импульсами частотой 40—50 Гц, силой тока 60—80 В. Отмечают постепенное снижение артериального давления, которое восстанавливается до исходного уровня после прекращения раздражения (см. рис. 58).
Подводят электроды под периферический конец блуждающего нерва и раздражают его ритмическими импульсами такой же амплитуды и частоты, как и при стимуляции депрессорного нерва. Наблюдают резкое падение артериального давления и быстрое его восстановление после прекращения раздражения (см. рис. 58).
Вводят в ушную вену 1 мл адреналина, отмечают учащение сердечных сокращений и постепенный подъем артериального давления. Через несколько минут давление возращается к исходному уровню вследствие быстрого разрушения адреналина и прекращения его действия.
В конце эксперимента в ушную вену вводят 2 мл ацетилхолина, наблюдают резкое замедление сердечных сокращений и снижение артериального давления. Передозировка ацетилхолина может привести к гибели животного.
Рекомендации к оформлению работы. Вклейте в протокол небольшой отрезок кривой артериального давления, отметив на ней типы волн.
Вырежьте отрезок кривой с падением давления после раздражения блуждающего и депрессорного нерва. На кривых измерьте длительность латентного периода, т. е. время от момента раздражения до начала падения артериального давления. На вырезанном отрезке кривой определите различия в характере и длительности действия введенных внутривенно адреналина и ацетилхолина. Анализируя полученные кривые, отметьте различия в характере снижения давления при раздражении блуждающего и депрессорного нервов. Объясните механизмы снижения давления в обоих случаях.
Работа 56. Наблюдение за капиллярами кожи
Капиллярная сосудистая сеть — одна из важнейших в сосудистом русле, изучение которой позволяет объяснить функцию всей сердечно-сосудистой системы в целом. Однако наблюдение капиллярного кровотока представляет известные методические трудности.
Петли капилляров в коже обычно располагаются под прямым углом к поверхности, так что в каждый данный момент в фокусе может находиться только часть каждой петли. Однако если не трогать кожицу ногтевого ложа, по крайней мере в течение недели, чтобы она наросла на ноготь, то петли будут лежать в ней наклонно, и нередко можно увидеть в фокусе одновременно всю петлю. Осветитель надо установить так, чтобы отражение света от поверхности кожи не мешало наблюдению.
Для работы необходимо: осветительная лампа, иммерсионное масло, пипетка, бинокулярная лупа. Работа проводится на человеке.
Ход работы. Этот опыт можно выполнить на собственном пальце. Руку кладут на стол ладонью вниз. Осветительную лампу с тепловым фильтром располагают так, чтобы пятно света было сфокусировано на коже, покрывающей основание одного из ногтей. На ноготь наносят каплю иммерсионного масла. Фокусируют бинокулярную лупу (Х20) на петлях капилляров.
Рекомендации к оформлению работы. Для длительного наблюдения выберите одну петлю. Постоянен ли ее диаметр? Происходит ли когда-либо ее полное закрытие? Можно ли различить отдельные эритроциты? Если да, то опишите, как происходит их перемещение. Наденьте на руку манжетку сфигмоманометра и повысьте давление до 50 мм рт. ст., чтобы сдавить вены. Опишите, что произойдет с капиллярами. Ненадолго понизьте давление, а затем установите его уровень примерно на 100 мм рт. ст. Как будут вести себя капилляры? Опустите на несколько минут давление до нуля, а затем быстро доведите его до 150 мм рт. ст., пережав артерии. Опишите, что произошло, и заметьте, через какое время прекратится ток крови. Ослабьте давление и снимите манжетку.
Работа 57. Сосудосуживающие нервы уха кролика (опыт Клода Бернара)
Симпатический нерв является главным вазоконстриктором, по которому из ЦНС постоянно идут импульсы, поддерживающие кровеносные сосуды в состоянии тонуса.
Если перерезать симпатический нерв, то сосуды резко расширяются вследствие падения сосудистого тонуса (раздражение симпатического нерва вызывает увеличение тонуса сосудов и сужение их просвета).
Для работы необходимо: станок для фиксации кролика, импульсный стимулятор, 2 медицинских электрических термометра, раздражающие электроды, набор препаровальных инструментов, лоток, 20% раствор уретана, кролик (лучше альбинос).
Принцип работы медицинского электрического термометра основан на способности терморезистора изменять свое сопротивление при изменении температуры окружающей среды, что приводит к колебаниям электрического потенциала, регистрируемого гальванометром.
Ход работы. Кролика укрепляют в станке брюшком вверх и наркотизируют путем внутрибрюшинного введения 5 мл 20% раствора уретана. Затем выстригают шерсть в области шеи и проводят продольный разрез кожи по средней линии. Тупым способом раздвигают мышцы и фасции и с одной стороны от трахеи находят сосудисто-нервный пучок, в котором проходят сонная артерия, блуждающий, симпатический и депрессорный нервы. Выделяют тонкий серовато-белого цвета симпатический нерв, берут его на лигатуру и перерезают, оставляя на лигатуре периферический конец нерва. Затем нерв укладывают обратно между мышцами и рану зашивают, оставляя снаружи только кончик лигатуры.
Через 30—60 мин сравнивают окраску и температуру кожи обоих ушей кролика и отмечают, что на стороне перерезки симпатического нерва ухо стало ярко-красным и его кровеносные сосуды резко расширились. Пользуясь электрическими термометрами (согласно инструкции по эксплуатации), измеряют температуру одного и другого уха одновременно. Температура уха кролика, на стороне которого перерезан симпатический нерв, оказывается на 8—10° С выше температуры уха, нерв которого не перерезан. Слегка подтягивают симпатический нерв за лигатуру, накладывают на него электроды и раздражают ритмическими импульсами с помощью импульсного стимулятора. При раздражении нерва электрическим током (частота 10-12 Гц, сила тока 20—30 В) наблюдают сужение сосудов уха на соответствующей стороне (ухо бледнеет).
Рекомендации к оформлению работы. Отметьте разницу в состоянии сосудов уха кролика на десимпатизированной стороне и контрольной. Измерьте и запишите температуру десимпатизированного и контрольного уха. Отметьте и объясните вазодилататорный эффект десимпатизации и вазоконстрикторный эффект после раздражения периферического конца перерезанного симпатического нерва.
Работа 58. Влияние раздражения седалищного нерва на сосуды плавательной перепонки лягушки (опыт Вальтера)
Доказать наличие нервных влияний на тонус сосудов можно на седалищном нерве, который является смешанным нервом, так как в его состав входят и сосудорасширяющие, и сосудосуживающие нервные волокна. Характер сосудосуживающих влияний выражен более значительно и определяет постоянный тонус сосудов. В связи с этим при перерезке седалищного нерва происходит расширение сосудов задних конечностей животного, так как исключается влияние сосудосуживающих нервных волокон, а последующее раздражение нерва приводит к сужению этих сосудов.
Для работы необходимо: стимулятор, электроды, микроскоп, препаровальный набор, лоток, операционный столик, булавки, нитки, раствор Рингера, лягушка.
Ход работы. Лягушку обездвиживают, осторожно разрушая спинной мозг. Помещают на операционный столик спинкой кверху. Над отверстием в дощечке растягивают плавательную перепонку задней конечности и закрепляют ее булавками. Под микроскопом наблюдают за кровообращением в сосудах плавательной перепонки. На задней поверхности бедра делают надрез кожи, раздвигают мышцы, обнажают седалищный нерв, берут его на лигатуру. Перерезают нерв и наблюдают, как расширяются сосуды и замедляется движение крови по ним. Затем под периферический конец нерва, который взят на лигатуру, подводят электроды и наносят раздражение. Продолжают наблюдение. Через некоторое время (латентный период — 20—30 с) отмечают ускорение тока крови по капиллярам. После окончания раздражения (через 30— 40 с) скорость движения крови восстанавливается, так как происходит расширение просвета сосудов.
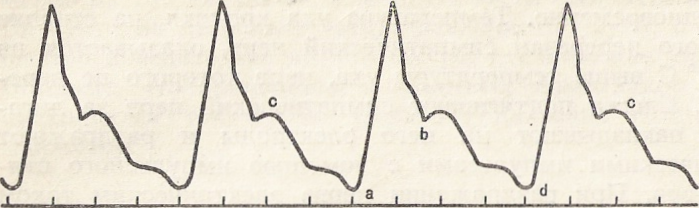
Рис. 59. Сфигмограмма.
ab—систола левого желудочка; bd — диастола; с — дикротический подъем.
Рекомендации к оформлению работы. Зарисуйте состояние сосудов плавательной перепонки в норме, а также после перерезки седалищного нерва и после его раздражения. Отметьте также состояние сосудов после прекращения раздражения. Опишите характер изменения сосудов после перерезки и раздражения седалищного нерва и объясните причину этих изменений.
Работа 59. Регистрация артериального пульса
Артериальным пульсом называют ритмические колебания стенки артерий, обусловленные колебаниями артериального давления. Артериальный пульс отражает работу сердца, состояние сосудов и высоту кровяного давления. Различают 4 основных свойства пульса: его частоту, силу, скорость и твердость.
Аппараты для записи пульса называют сфигмографами.
В кривой пульса — сфигмограмме (рис. 59) различают следующие части: восходящее колено — прямой, крутой, высокий подъем, соответствующий расширению артерии (анакрота); верхушку и нисходящее колено — пологое, медленное опускание кривой, соответствующее спадению артерии (катакрота).
Нисходящая часть кривой может прерываться несколькими небольшими подъемами, один из которых, называемый дикротическим подъемом, наблюдается постоянно на всех кривых. Его начало соответствует моменту захлопывания полулунных клапанов.
Пульсовая кривая может дать некоторые сведения о продолжительности фаз деятельности левого желудочка. От момента подъема кривой и до дикротического подъема продолжается фаза систолы. Дистола длится от дикротического подъема до начала нового подъема.
Для работы необходимо: сфигмограф, кимограф. Работу проводят на человеке.
Ход работы. Приложив четыре пальца по ходу лучевой артерии испытуемого, находят наиболее отчетливо пульсирующую точку.
Укрепляют на предплечье испытуемого сфигмограф так, чтобы он находился на отчетливо пульсирующем участке артерии. Записывают сфигмограмму.
Рекомендации к оформлению работы. Объясните происхождение артериального пульса и отдельных частей пульсовой кривой.
Работа 60. Измерение скорости пульсовой волны у человека
Как известно, скорость распространения пульсовой волны по артериям при прочих равных условиях зависит от эластичности артериальной стенки. При растяжимой (эластичной) артериальной стенке (например, у детей) скорость пульсовой волны невелика и равна 4—5 м/с. При уплотненной, трудно растяжимой артериальной стенке, потерявшей в значительной мере эластичность (что наблюдается, например, при атеросклерозе), скорость пульсовой волны возрастает и достигает 9—10 м/с (у здорового человека скорость пульсовой волны равняется 6—8 м/с). Измерение скорости пульсовой волны дает возможность судить о степени эластичности артериальной стенки, что имеет значение для клиники.
Для работы необходимо: многоканальный электрокардиограф, два пьезодатчика для записи пульса. Работу проводят на человеке.
Ход работы. Испытуемый сидит на стуле, положив одну руку на стол; на внутренней поверхности верхней трети плеча (вблизи подмышечной впадины), в месте наилучшей пальпации плечевой артерии, укрепляют один из датчиков для регистрации пульса. Другой датчик укрепляют на предплечье у лучезапястного сустава, в месте наилучшей пальпации лучевой артерии. Оба датчика присоединяют параллельно ко входу электрокардиографа.
При наличии двухканального или многоканального прибора каждый из датчиков лучше присоединить к отдельному каналу и, кроме того, одновременно регистрировать электрокардиограмму.
На кривой записи видно, что начало возникновения пульсовой волны на лучевой артерии отстает от начала пульсовой волны на плечевой артерии на одно деление отметчика (т. е. на '/20 с). Измерив расстояние между точками записи и разницу во времени прихода пульсовой волны в каждую из точек, определяют линейную скорость распространения пульсовой волны.
Рекомендации к оформлению работы. Запишите полученные результаты. Объясните, от чего зависит скорость распространения пульсовой волны по артериям.
Работа 61. Фазовый анализ деятельности сердца
Одновременная регистрация различных физиологических процессов, связанных с деятельностью сердца, позволяет путем сравнения изучить происхождение отдельных элементов регистрируемых кривых. Наряду с этим с помощью оценки и сравнения продолжительности определенных интервалов полиграммы можно определить длительность основных временных показателей сердечного цикла.
Для фазового анализа сердечного цикла по поликардиограмме определяют длительность следующих интервалов (рис. 60):
1) R — R (по ЭКГ); 2) I—II тон (по ФКГ); 3) с — е (по СФГ); 4) е —f (по СФГ); 5) 0—1 тон (по ЭКГ и ФКГ).
С помощью этих данных можно рассчитать длительность некоторых фаз сердечного цикла и величину межфазовых показателей по нижеприведенным формулам.
1. Длительность сердечного цикла (С) = R—R.
2. Частота сердечных сокращений в 1 мин (ЧСС) (60/С).
3. Длительность фазы асинхронного сокращения

Рис. 60. Поликардиограмма.
а — электрокардиограмма; б — фонокардиограмма; в — сфигмограмма.
(АС)=0—I тон (допустимые пределы колебаний длительности 0,04—0,07 с).
4. Длительность фазы изометрического сокращения (1С) = (I—II тон) — (с—е) (допустимые пределы колебаний 0,02—0,05 с).
5. Длительность периода напряжения (T)=AC-IC (допустимые пределы колебаний 0,06—0,11 с).
6. Длительность периода изгнания (Е) = с—е (допустимые пределы колебаний 0,21—0,31 с).
7. Длительность механической систолы (Sm) = 1С -f- Е (допустимые пределы колебаний 0,23—0,34 с).
8. Длительность общей систолы (S0)=T+E (допустимые пределы колебаний 0,24—0,35 с).
9. Длительность диастолы желудочков D=C—S0 (допустимые пределы колебаний 0,35—0,7 с).
10. Длительность протодиастолы (Р)=е—f (допустимые пределы колебаний 0,02—0,05 с).
11. Время изгнания минутного объема (ВИМО) = = Е* ЧСС (допустимые пределы колебаний 15—21 с).
Для работы необходимо: многоканальный
электрокардиограф, фонокардиографическая приставка, сфигмографическая приставка, марлевые салфетки, электроды, 10% раствор хлорида натрия. Работа проводится на человеке.
Ход работы. В соответствии с прилагаемой к приборам инструкцией подготавливают аппаратуру к работе. Испытуемому накладывают на конечности электроды для электрокардиографии (лучше во II отведении), над областью сердца укрепляют микрофон для фонокардиогра-фии и в области проекции сонной артерии фиксируют датчик для сфигмографии. Включают приборы и делают пробную запись. Для точности анализа фазовой структуры сердечного цикла необходимо на ЭКГ получить четкую запись зубца Q, на ФКГ — отчетливое начало высокочастотных колебаний I тона (что достигается лучше при среднечастотных характеристиках) и на СФГ — четкое прописывание ее высокочастотных компонентов — с, е, f. Запись полиграммы должна производиться при скорости движения лентопротяжного механизма 100 мм/с.
Рекомендации к оформлению работы. Полученную полиграмму вклейте в протокол опыта. Сделайте обозначения зубцов и интервалов кривых, произведите расчет длительности фаз сердечного цикла. Обсудите преимущества синхронной записи различных показателей деятельности сердца перед раздельной их регистрацией.
Работа 62. Вычисление работы сердца
Для вычисления работы сердца (левого и правого желудочков в отдельности) пользуются следующей формулой (дается в упрощенном виде): Р=МО « АД, где Р — работа сердца в 1 мин в килограммометрах (кгм); МО — минутный объем сердца; АД — артериальное давление, м вод. ст.
Для расчета работы за 1 ч и за сутки найденная величина умножается на 60 и на 1440.
Вычислите работу сердца в кДЖ за 1 ч и за сутки на основании следующих данных: систолический объем — 50 мл, частота сердцебиений — 70 в минуту, артериальное давление — 120 мм рт. ст.
Для перевода показателей ртутного столба в показатели водяного столба необходимо показатели ртутного столба умножить на 13,6. Величины минутного объема следует округлить при расчете до 0,1 л, а артериального давления — до 0,1 м вод. ст. Полученный результат
(работа сердца за сутки) рассчитать с точностью до 1000 кгм. Для перевода единиц измерения работы в Дж использовать соотношение 1 кгм=9,81 Дж.
Получите и сравните данные о работе сердца в покое и после физической нагрузки (быстрый бег на месте в течение 20 с).
Работа 63. Изучение перераспределения крови в организме человека методом плетизмографии
Характер перераспределения крови в организме зависит от доминирующей в данный момент физиологической реакции. Сосудистые реакции являются обязательным компонентом ориентировочного, оборонительного, пищевого и многих других безусловных рефлексов. Так, помимо поворота туловища, головы, глазных яблок и ушных раковин (у животных) в сторону необычного раздражителя при осуществлении ориентировочного рефлекса происходит рефлекторное перераспределение крови: отток ее к мозгу и как следствие уменьшение кровоснабжения мышц конечностей. Четкое и длительное рефлекторное сужение периферических сосудов возникает в ответ на болевое раздражение. В период пищеварения кровь оттекает к желудочно-кишечному тракту, а во время мышечной и умственной работы соответственно к работающим мышцам и мозгу.
У человека рефлекторное перераспределение крови наступает при изменении температуры окружающей среды, что наряду с другими механизмами обеспечивает поддержание температурного гомеостаза за счет изменения эффективности теплоотдачи. Четкие и стойкие сосудистые реакции возникают при холодовом воздействии на кожу (1—6° С). При этом независимо от места воздействия холода наблюдается сужение периферических сосудов. Оно наиболее выражено в верхних конечностях, слабее — в нижних, еще слабее — во внемозговых сосудах головы. Приложение тепла к коже (40—50° С) вызывает противоположный эффект — расширение кожных сосудов.
Возможные сосудистые реакции у человека обычно изучают с помощью плетизмографии. Плетизмография — метод непрерывной графической регистрации колебаний объема органа или части тела, обусловленных изменением их кровенаполнения. В зависимости от принципа работы плетизмографы подразделяются на механические и электрические (импедансные, диэлектрические и фотоэлектрические). Они предназначены для записи плетизмограмм различных органов и являются ручными, пальцевыми, ножными или внутриорганными.
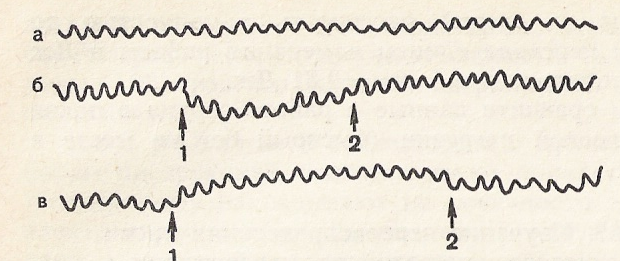
Рис. 61. Плетизмограмма (запись объемного пульса).
а — нормальная плетизмограмма; б — плетизмограмма при воздействии холода; в— плетизмограмма при воздействии тепла; 1— начало воздействия; 2— конец воздействия.
Плетизмография позволяет изучить влияние разнообразных факторов на характер периферического кровотока у человека.
Для работы необходимо: удобное мягкое кресло с удлиненными подлокотниками и упором для локтей, скамеечка для ног, электроплетизмограф с набором пальцевых датчиков, сфигмотонометр, бумага для записи пле-тизмограммы, специальные чернила с пипеткой, пузырь для льда, лед, грелка с водой температурой 50—60° С, лейкопластырь. Работу проводят на человеке.
Ход работы. Испытуемый садится в мягкое кресло с удлиненными подлокотниками, расположенными на уровне сердца, спиной к плетизмографу, ставит ноги на скамейку, расслабляет мускулатуру и адаптируется к обстановке в течение 10 мин. Это необходимо для получения устойчивой нулевой плетизмограммы. На плечо его левой руки накладывают манжетку от сфигмотонометра. На средние (или безымянные) пальцы обеих рук до проксимального сустава надевают пробирки с отростками, подобранные предварительно по размерам пальцев. Герметизируют пространство между стенкой пробирки и пальцем полоской лейкопластыря, после этого каждую из них резиновой трубкой соединяют с краном датчика на плетизмографе. Для записи дыхания на груди или на животе испытуемого (в зависимости от его пола) укрепляют пневмодатчик, который соединяют затем с краном плетизмографа.
Плетизмограф заземляют. Затем прогревают его в течение 5—10 мин. После этого все писчики прибора устанавливают в среднее положение с помощью ручек усиления и баланса. При записи используют скорость протяжки бумаги — 5 мм/с (рис. 61, а).
Характерной особенностью вазомоторных рефлексов у человека является их чрезвычайная подвижность и изменчивость, поэтому для получения удовлетворительного исходного фона необходимо по возможности исключить внешние раздражения.
Вначале открывают краны датчиков, записывают исходные пальцевые плетизмограммы в течение 2 мин и изучают их характер: на плетизмограммах различают два типа постоянных волн — волны первого и второго порядков. По своему происхождению волны первого порядка — пульсовые, волны второго порядка — дыхательные. Можно обнаружить и волны третьего порядка, к которым относятся все периодические и неритмические колебания.
Затем наблюдают сдвиги на плетизмограммах после искусственного сдавления вен и затруднения оттока венозной крови от конечности к сердцу. Для этого, не прекращая записи, нагнетают воздух в надетую на плечо левой руки манжетку и создают в ней давление в 40—50 мм рт. ст. Исходный уровень плетизмограммы смещается вверх в связи с увеличением кровенаполнения сосудов конечности. Затем открывают кран сфигмотонометра и восстанавливают исходное атмосферное давление в манжетке. При этом уровень плетизмограммы постепенно снижается до первоначального.
Для изучения влияния изменений давления в плевральной полости на характер периферического кровообращения, записав исходную кривую, просят испытуемого сделать глубокий вдох. Начало и конец вдоха отмечают под плетизмограммой, наблюдают понижение уровня плетизмограммы, что обусловлено ухудшением кровоснабжения конечности и уменьшением ее объема.
При изучении действия холода и тепла на характер периферического кровотока после записи фоновых плетизмограмм на предплечье правой руки накладывают пузырь со льдом на 30—60 с. Наблюдают понижение уровня плетизмограммы, что обусловлено рефлекторным сужением кожных сосудов и уменьшением степени их кровоснабжения. После восстановления исходного уровня плетизмограммы на предплечье той же руки и на тот же срок накладывают грелку с водой, имеющей температуру 40—50° С. Наблюдают смещение уровня плетизмограммы вверх, что связано с рефлекторным расширением кожных сосудов (рис. 61, б, в).
Продолжая запись плетизмограммы, просят испытуемого крепко сжать кулак правой руки (не двигаться).
Наблюдают за изменением кровообращения конечности при статической мышечной работе. Через 1 мин просят расслабить мышцы. Наблюдают смещение плетизмограммы вверх, что связано с повышением кровоснабжения конечностей. Начало и конец статической работы отмечают под плетизмограммами.
Рекомендации к оформлению работы. Вклейте полученные плетизмограммы в тетрадь. Обозначьте пульсовые и дыхательные волны.
Определите латентные периоды и продолжительность сосудистых реакций.
Работа 64. Последствия прекращения притока крови к конечности
Прекращение притока крови к конечности вызывает изменение цвета кожи и температуры, а также нарушения функций чувствительных и двигательных нервных волокон. Как экспериментатор, так и испытуемый должны заранее прочитать подробное описание этого опыта, чтобы иметь ясное представление о процедуре. Данный эксперимент дает как наблюдателю, так и испытуемому реальное представление о некоторых нарушениях периферического кровообращения.
Для работы необходимо: сфигмотонометр, эстезиометр, контактный термометр. Работу проводят на человеке.
Ход работы. В начале эксперимента руку испытуемого следует- согреть. Ее кладут на стол и держат в спокойном состоянии, расслабив мышцы, иначе мышечная боль появится еще до выполнения опыта. На предплечье накладывают манжетку сфигмотонометра, нагнетают воздух до 200 мм рт. ст. и поддерживают давление на этом уровне, подкачивая воздух по мере необходимости.
Происходящие явления обычно можно описать, разделив их на 4 периода.
В первые 5 мин температура конечности сразу начинает уменьшаться, и к концу этого периода пальцы пережатой руки становятся заметно холоднее. Наблюдатель должен установить это, прикасаясь к руке испытуемого. Кожа может принять фиолетовый оттенок. Иногда остается несколько розовых пятен, обусловленных сохранением кровотока в мелких сосудах, которые подходят к небольшим участкам кожи от" артерий, снабжающих кости.
За следующие 5 мин температура кожи продолжает понижаться и в некоторых местах на ней могут появиться белые пятна.
Спустя 13—15 мин отмечаются нарушения функции периферических нервов. В первую очередь нарушается тактильная чувствительность, исчезновение которой начинается от кончиков пальцев и распространяется вверх. Это можно продемонстрировать, пользуясь эстезиометром Фрея. На данном этапе болевая и температурная чувствительность еще сохраняется, но и они постепенно ослабевают в направлении снизу вверх. Пробу на потерю ощущения положения конечности проводят, изменив положение пальцев испытуемого и попросив его сказать, согнуты они или разогнуты. Нарушения в двигательных нервах, снабжающих мышцы возвышения большого пальца, возникают примерно через 20 мин; произвольные движения этих мышц прекращаются приблизительно к тому же времени, когда потеря тактильной чувствительности распространяется до запястья. При испытании двигательной активности мышечные движения не должны быть слишком энергичными, иначе могут наступить ишемические боли и эксперимент придется прекратить. Как правило, мышцы — разгибатели запястья и пальцев — парализуются примерно к 30-й минуте и приподняв предплечье над столом, можно продемонстрировать типичное явление «падения кисти». Прекратите эксперимент на 30-й минуте или сейчас же после появления симптома «падения кисти» (если он появится раньше).
После снятия манжеты восстановление кровообращения идет очень быстро. Вся конечность приобретает ярко-красный оттенок (реактивная гиперемия). Через 1 мин функция периферических нервов почти полностью восстанавливается, причем в последнюю очередь восстанавливается тактильная: чувствительность в кончиках пальцев. В течение нескольких минут в дистальной части конечности ощущается острое покалывание, но по мере нормализации состояния сосудов и нервов оно исчезает.
Нередко эксперимент приходится прерывать преждевременно вследствие ишемических болей в мышце, которые могут быть вызваны недостаточным расслаблением руки или слишком частой проверкой двигательной активности мышц. Опыт с остановкой кровообращения нельзя проводить на одном и том же испытуемом чаще чем один раз в день.
Рекомендации к оформлению работы. Отметьте время появления физических признаков и ощущений и кратко опишите их.
Если удастся, зафиксируйте потерю тактильной чувствительности (ощущения прикосновения), болевой (реакции на укол булавкой), потерю ощущения положения руки в пространстве (проприоцептивная чувствительность) и двигательных функций.
Работа 65. Определение объемной скорости кровотока
Объемная скорость кровотока — количество крови, проходящее через поперечное сечение сосуда за единицу времени. Для определения объемной скорости кровотока в исследуемом органе в клинических и экспериментальных условиях применяют метод окклюзионной плетизмографии. Объемный пульс (плетизмограмму) регистрируют в процессе пережатия сосудов конечности или отдельного пальца пневматической манжеткой, что позволяет полиостью прекратить венозный отток крови при сохранении артериального притока. Увеличение объема крови исследуемой конечности после пережатия проксимального участка ее вен прямо пропорционально величине артериального притока, а значит и объемной скорости кровотока.
Для работы необходимо: плетизмограф, пальцевой датчик, регистратор с усилителем постоянного тока, сфигмотонометр, секундомер, мерный сосуд с водой. Работу проводят на человеке.
Ход работы. Измеряют объем исследуемого пальца руки, помещая его в мерный сосуд с водой. По объему вытесненной жидкости определяют исходный объем пальца в кубических сантиметрах. Измеряют артериальное давление в плечевой артерии по методу Короткова. Затем в манжетке тонометра создают давление, равное диастолическому, при этом прекращается венозный отток крови, а артериальный приток сохраняется — увеличивается объем конечности и исследуемого пальца, что приводит к смещению изоэлектрического уровня плетизмограммы. Повышенное давление в манжетке сохраняется на время 4—5 сердечных циклов. Замечают время от начала окклюзии до восстановления исходного уровня плетизмограммы.
Рекомендации к оформлению работы. Используя полученные в работе плетизмограммы рассчитайте объемную скорость кровотока по формулам:
![]()
где
Rv
— объемная скорость кровотока, см3/100
см3
ткани;
![]() —
прирост объема органа, см3;
V0
—
исходный объем органа, см3;
t
—
время, в течение которого измеряется
прирост объема органа после окклюзии
вен, с; Н
—
смещение уровня записи, см; 60 и 100 —
коэффициенты, необходимые для подсчета
объемной скорости кровотока, см3/100
см3
ткани/мин; Су
— коэффициент чувствительности
прибора.
—
прирост объема органа, см3;
V0
—
исходный объем органа, см3;
t
—
время, в течение которого измеряется
прирост объема органа после окклюзии
вен, с; Н
—
смещение уровня записи, см; 60 и 100 —
коэффициенты, необходимые для подсчета
объемной скорости кровотока, см3/100
см3
ткани/мин; Су
— коэффициент чувствительности
прибора.
Работа 66. Функциональные пробы на реактивность сердечно-сосудистой системы
Синхронная регистрация различных внешних проявлений деятельности сердечно-сосудистой системы при проведении различных функциональных проб расширяет диагностические возможности в анализе этой важнейшей системы организма.
Для работы необходим сфигмотонометр. Работу проводят на человеке.
Ход работы. В опыте участвует не менее 4 человек: испытуемый, измеряющий артериальное давление, подсчитывающий пульс, ведущий протокол. Заготовив предварительно таблицу (см. ниже), усаживают испытуемого на кушетку, один из участников опыта измеряет у него систолическое и диастолическое давление, второй заполняет таблицу протокола, третий подсчитывает пульсовые удары и тоже протоколирует их. Определение артериального давления и пульса идет обязательно одновременно. Измерения проводят несколько раз, пока не будут получены 2 одинаковые (близкие) цифры показателей артериального давления и пульса. Разъединив манжетку и тонометр прибора (манжетка не снимается в течение всего опыта), предлагают испытуемому встать. Быстро соединяют манжетку с манометром и измеряют давление несколько раз подряд, называя вслух найденные показатели манометра. Одновременно за каждые 15 с сообщаются данные частоты пульса. Измерения производят до тех пор, пока показатели не вернутся к исходным величинам. Аналогичное наблюдение проводить после физической нагрузки (20 приседаний).
Рекомендации к оформлению работы. Внесите полученные данные в предлагаемую ниже таблицу.
Показатели функциональных проб на реактивность сердечнососудистой системы
Показатели |
Покой (сидя) |
Вставание |
После работы через 1 мин, 2 мин, 3 мин |
Пульс |
|
|
|
Артериальное давление, |
|
|
|
мм рт. ст. |
|
|
|
|
|
|
|
Оцените реактивность сердечно-сосудистой системы испытуемого.
Примечание: Как правило, у взрослого здорового человека гемодинамические показатели (частота пульса, артериальное давление) нормализуются в течение 3 мин по окончании работы.
ДЫХАНИЕ
Работа 67. Пневмография при различных физиологических состояниях у человека
Дыхательный цикл состоит из 2 фаз, следующих друг за другом без пауз: фазы вдоха и фазы выдоха. Регистрация дыхательных движений грудной клетки (пневмография) основана на принципе воздушной передачи дыхательных движений грудной клетки пишущему рычажку. Получаемая запись — пневмограмма позволяет судить о продолжительности фаз дыхания, частоте дыхания, глубине его и зависимости этих показателей от физиологического состояния организма (покоя, работы и т. д.).
Наиболее употребляемый пневмограф представляет собой продолговатую резиновую камеру, помещенную в матерчатый чехол, герметически соединенную с капсулой Марея (рис. 62).
Для работы необходимо: пневмограф, резиновые трубки, тройник, зажим, кимограф.
Рис. 62. Графическая регистрация дыхательных движений (пневмография).
1— капсула Марея; 2— пневмограф Марея; 3— тройник с зажимом; Л — принцип воздушной передачи.
Ход работы. Резиновую камеру в чехле (манжету) укрепляют на самой подвижной части грудной клетки испытуемого, предварительно заполнив всю систему воздухом через тройник. Устанавливают рычажок капсулы Марея по касательной к кимографу и записывают пневмограмму при следующих условиях: а) спокойное дыхание; б) глубокое дыхание; в) дыхание после физической нагрузки (10—12 приседаний); г) во время декламации (чтения); д) при кашле; е) задержке дыхания; ж) частом поверхностном дыхании.
Рекомендации к оформлению работы. Вклейте полученные пневмограммы в тетрадь и проведите их анализ. Объясните механизм изменения дыхания при каждом изменении условий эксперимента.
Работа 68. Значение герметичности плевральной полости в механизме дыхания
Герметичность плевральной полости является необходимым условием для осуществления внешнего дыхания. При нарушении герметичности плевральной полости давление в ней становится равным атмосферному, в связи с чем легкие под влиянием эластической тяги спадаются и не следуют за движениями грудной клетки.
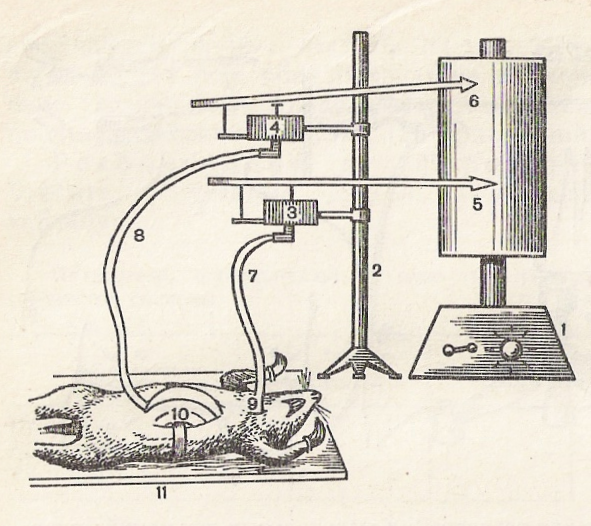
Рис. 63. Установка для исследования биомеханики легочной вентиляции.
I— кимограф; 2 — штатив; 3, 4— малые капсулы Марся; 5, 6— писчикн на рычажках Эпгельмана;7, 8— соединительные трубки; 9— канюля; 10— манжетка;
II— операционный столик.
Для работы необходимо: кимограф, штатив, 2 капсулы Марея с рычажками Энгельмаиа, манжетка, канюля, набор препаровальных инструментов, лоток, препаровальная доска, бинты, нитки, гексенал, крыса.
Ход работы. Собирают установку (рис. 63). Для этого на грудную полость наркотизированной, фиксированной на препаровальной доске крысы накладывают манжетку, соединенную с помощью резиновой трубки (8) с капсулой Марея (4). Производят графическую регистрацию дыхательных движений грудной клетки крысы (пневмографию). На фоне регистрации пневмо-граммы препарируют трахею и надрезают ее, затем вводят канюлю, соединенную резиновой трубкой (7) с внутренней полостью капсуль. Марeл ;3). Производят параллельную графическую регистрацию дыхательных движений грудной клетки и легких (в связи с тем, что крыса дышит газовой смесью, заполняющей герметическую полость капсулы Марея, регистрацию стараются производить быстро).
Производят разгерметизацию грудной полости, для чего разрезают кожу грудной клетки, рассекают межреберные мышцы и плевральную оболочку. Продолжают запись. Дыхательные движения грудной клетки крысы до пневмоторакса идут синхронно с движениями легких В момент нарушения герметичности плевральной полости легкие спадаются и писчик (6) регистрирует отсутствие движения легких, записывая прямую линию.
Рис. 64. Схема газоанализатора модели Холдена для количественной оценки содержания газов в исследуемом воздухе.
1—двухходовой кран для забора исследуемого воздуха; 2—трехходовой кран газометрической бюретки; 3—ампула измерительной бюретки (емкость 7 мл); 4— регуляторный винт; 5— двухходовой кран для связи измерительной бюретки с напорным сосудом; 6— напорный сосуд; 7— трехходовой кран термобарометра; 8— ампула бюретки термобарометра; 9— зажим термобарометра; 10— трехходовой кран пипетки для поглощения кислорода; 11 —напорный сосуд пипетки для поглощения кислорода; 12—трехходовой кран пипетки для поглощения углекислого газа; 13— емкостной резервуар пипетки для поглощения углекислого газа; 14, 15, 16—запирающая система; 17—напорный сосуд пипетки для поглощения углекислого газа.
Рис. 65. Схема модификации газоанализатора Холдена.
1— трехходовой кран измерительной бюретки; 2— ампула измерительной бюретки (емкость 7 мл); 3— шприц; 4— трехходовой кран, обеспечивающий параллельное подключение пипеток с поглотителями кислорода и углекислого газа; 5— емкостной резервуар пипетки для поглощения кислорода; 6— напорный сосуд пипетки для поглощения кислорода; 7— емкостной резервуар пипетки для поглощения углекислого газа; 8— напорный сосуд пипетки для поглощения углекислого газа.
(В то же время наблюдается увеличение амплитуды пневмограммы, что связано с рефлекторной попыткой компенсации утраченной возможности растяжения легких.)
Рекомендации к оформлению работы. Вклейте полученные кривые в тетрадь протоколов. Проведите их анализ. Объясните полученные результаты.
Работа 69. Количественный анализ газового состава воздуха (модифицированный метод Холдена)
Для количественного анализа воздуха в учебном процессе традиционно используются газоанализаторы Холдена (рис. 64) и Орса, принцип работы которых основан на химическом поглощении газов воздуха растворами пирогаллола и едкого натра (или кали). Оба аппарата отличаются сложностью конструкции и трудоемкостью в работе. С учетом указанных моментов разработана новая модель газоанализатора, прототипом которого является аппарат Холдена. Принцип количественного измерения исследуемых газов в обоих случаях один и тот же, но реализация его существенно облегчена.
Изменения, внесенные в конструкцию прототипа (аппарат Холдена). и их обоснования — рис. 65 (модификация Г. И. Косицкого, 1962).
1. Замена ртути водой. Целесообразность очевидна ввиду токсичности ртути.
2. Упразднение термобарометра — устройства, стабилизирующего температуру и давление во внутренней среде аппарата. Компенсация этой функции явилась следствием замены ртути водой, которая отличается малой теплопроводностью и большой теплоемкостью, что надежно стабилизирует температуру внутренней среды аппарата.
3. Существенное облегчение газоанализатора достигнуто в результате замены напорного сосуда для перекачивания ртути шприцем, состыкованным короткой металлической Г-образной трубкой с входным отверстием газометрической бюретки.
4. Пространственное расположение элементов аппарата уплотнено путем замены последовательной локализации сосудов с поглотителями на параллельную ориентацию, что позволило уменьшить вдвое вредное пространство газоанализатора и функцию двух кранов совместить в одном.
Последовательность работы:
I. Подготовка аппарата к забору исследуемой пробы воздуха.
1. Очистка и смазка кранов. Газоанализатор содержит 2 крана. Кран № 1 располагается на измерительной бюретке и предназначен для заполнения ее исследуемым воздухом и перемещения его
к поглотителям. Кран № 2 состыкован с капиллярами параллельно расположению сосудов с поглотителями и осуществляет коммутацию их просвета с измерительной бюреткой, заполненной исследуемым воздухом. Перед началом работы (1 раз в неделю) втулки кранов очищают спиртом и смазывают вазелиновым маслом, после чего втулки притираются к цилиндрическим поверхностям муфт.
2. Стыковка шприца с измерительной бюреткой и заполнение его водой с примесью азотной или серной кислот. Шприц емкостью 10 мл заполняется дистиллированной водой и с помощью резинового колпачка состыковывается с Г-образной трубкой, рсположенной на входе измерительной бюретки. Передвигая поршень шприца, заполняют водой измерительную бюретку до уровня расположения ее крана. На этом заканчивается предварительная подготовка газоанализатора к забору пробы исследуемого воздуха.
II. Забор пробы воздуха.
Забор воздуха для анализа производится в результате обратного хода поршня шприца при открытом «па атмосферу» кране измерительной бюретки. Если забор воздуха производится из мешка, необходимо предварительно соединить его с измерительной бюреткой, а затем перемешать воздух мешка с воздухом вредного пространства, которое остается на участке внешнего выхода бюретки или в свободном конце трубки мeшкa. Это достигается повторными подъемами уровня жидкости в ампулярной части измерительной бюретки, а затем уровень жидкости в ней плавно опускается до отметки 10 мл, точнее — на 2 мм ниже этого уровня, для компенсации объема мельчайших капель жидкости, которые прилипают к стенке бюретки. После этого трехходовой кран измерительной бюретки устанавливают в положение «закрыто». На этом заканчивается процедура взятия пробы воздуха.
Для работы необходимо: модифицированный газоанализатор Холдена, поглотители для кислорода и углекислого газа, шприц на 10 мл, мешок Дугласа. Работа проводится на человеке.
Ход работы. Проводят количественное определение содержания кислорода и углекислого газа в атмосферном и выдыхаемом воздухе.
Процедура газоанализа имеет следующую последовательность: а) перед началом адсорбции газов необходимо проверить расположение меток на капиллярах сосудов, содержащих растворы поглотителей. Метки должны совпадать с уровнем этих растворов (пирогаллола и едкого натра или кали) до и после поглощения кислорода и углекислоты; б) кран сосудов с поглотителями устанавливается на связь с измерительной бюреткой и поглотителем углекислого газа; в) кран измерительной бюретки из положения «закрыто» переводится на связь с краном поглотителей; г) перемещение пробы воздуха из емкости измерительной бюретки к сосуду С раствором едкого кали или натра производится в результате поступательного движения поршня шприца и смещения жидкости в измерительной бюретке в направлении ампулоподобного ее расширения. Повторные смещения уровня напорной жидкости в бюретке (качания) производятся в пределах ампулярной части бюретки. Для поглощения углекислого газа достаточно произвести 10 качаний, если раствор едкого натра или кали является насыщенным. Последнее качание отличается от предыдущих — уровень напорной жидкости в измерительной бюретке плавно опускается книзу до тех пор, пока раствор едкого натра или кали не совпадает с положением метки на капилляре этого поглотителя. В этот момент регистрируется положение нижнего мениска напорной жидкости в измерительной бюретке. Этот уровень должен повториться после 5 контрольных качаний. Если он перемещается, контрольные качания повторяют и заканчивают только тогда, когда произойдет стабилизация уровня напорной жидкости в измерительной бюретке при повторных качаниях. Лишь после этого результаты поглощения могут оцениваться достоверно; д) количественная оценка поглощенных газов. Расчет производится из разности исходного уровня жидкости в измерительной бюретке до и после поглощения того или другого газа. Например, после поглощения углекислого газа уровень жидкости в измерительной бюретке установился на отметке 9,65 мл, а исходный уровень был равен 10,0 мл. Отсюда 10,0 — 9,65=0,35 мл, а при пересчете на объем бюретки, равный 100,0 мл, получим 3,5 мл или 35 об. %. При последовательном поглощении кислорода за исходный уровень в измерительной бюретке принимается уже не 10,0 мл, а 9,65 мл, от которого необходимо вычесть показания бюретки после поглощения кислорода, предположим — 7,95 мл. Разность этих величин составит 9,65—7,95= = 1,7 мл, а после пересчета на емкость бюретки, равную 100,0 мл, получим 17,0 мл или 17 об.%. Количество качаний для поглощения кислорода при нормальной силе поглотителя равно 20. Контрольные качания производятся в одинаковом числе после адсорбции кислорода и углекислого газа (5 качаний). Химическая емкость поглотителей большая (около 100 анализов).
Рецепт приготовления растворов поглотителей.
1. Поглотитель кислорода (19,0 г едкого кали + 81 мл дистиллированной воды +12,0 г пирогаллола). Вначале к дистиллированной воде добавляется едкое кали, а после его растворения — пирогаллол. Раствор хранится в течение суток в сосуде из темного стекла с притертой пробкой в затемненном шкафу.
27 Поглотитель углекислого газа (60,0 едкого кали + 40,0 мл дистиллированной воды).
Заливка поглотителей в емкостные сосуды производится через цилиндрические стеклянные наконечники, сообщающиеся с емкостными сосудами прозрачными полиэтиленовыми трубками. Стеклянные наконечники после заливки поглотителей герметизируются слоем вазелинового масла толщиной 2—3 см и фиксируются на уровне капиллярных сосудов поглотителей, образуя систему сообщающихся трубок.
Рекомендации к оформлению работы. Полученные результаты выпишите в виде таблицы. Объясните их.
Работа 70. Определение содержания углекислого газа в выдыхаемом воздухе с помощью химического газоанализатора
Содержание углекислого газа в выдыхаемом воздухе может меняться в зависимости от различных факторов: физической нагрузки, искусственного дыхания, гипервентиляции, резких колебаний атмосферного давления и др.
С целью определения изменения содержания углекислого газа в выдыхаемом воздухе в покое и после физической нагрузки в последнее время используют промышленный газоанализатор типа АУХ-2.
Для работы необходимо: анализатор углекислого газа АУХ-2, мешок Дугласа, дыхательная маска или загубники, зажим для носа, зажим кровоостанавливающий, вата, спирт. Работа проводится на человеке.
Газоанализатор АУХ-2 предназначен для быстрого измерения содержания углекислого газа в пробах выдыхаемого воздуха.
Прибор состоит из измерительной камеры, манометра, увлажнительного и поглотительного сосудов. В измерительной камере имеется поршневое устройство для забора пробы анализируемой газовой смеси и прокачки ее через поглотительный сосуд, который заполнен химическим поглотителем — натронная известь. Манометр служит для замера разряжения в измерительной камере, возникающего в результате поглощения углекислого газа. Увлажнительный сосуд заполняется зернистой пемзой, смоченной водой. Концентрация углекислого газа в анализируемой смеси определяется путем замера разрежения, возникающего в измерительной камере после поглощения углекислого газа.
Ход работы. Собирают выдыхаемый воздух, для чего перекрывают зажимом резиновую трубку, идущую от дыхательного мешка. Нос испытуемого зажимают специальным зажимом. Загубник протирают спиртом и призводят 6—7 выдохов в мешок. Затем определяют содержание углекислого газа в выдыхаемом воздухе. С этой целью соединяют резиновую трубку дыхательного мешка с газоанализатором. Производят забор пробы анализируемого газа через увлажнитель в измерительную камеру. Прокачивают забранный воздух через поглотитель. При этом анализируемая смесь поступает из измерительной камеры в поглотительный сосуд, где поглощается углекислый газ, в результате чего в системе измерительная камера — поглотительный сосуд возникает разрежение, величина которого пропорциональна количеству поглощенного углекислого газа. С помощью манометра, стрелка которого отклоняется на величину создавшегося разрежения, определяют по шкале процентное содержание углекислого газа в исследуемом воздухе.
Измерения проводят дважды: в покое и после физической нагрузки (10, 20, 30 приседаний).
Рекомендации к оформлению работы. Занесите полученные данные в протокол. Вычертите кривую, отражающую зависимость содержания углекислого газа в выдыхаемом воздухе от интенсивности физической нагрузки.
Работа 71. Определение содержания кислорода в газовых смесях с помощью оксианализатора
Атмосферный воздух содержит 20,94% кислорода, 0,03 % углекислого газа и 79,03% азота.
Выдыхаемый воздух содержит в среднем 16,3% кислорода, 4% углекислого газа и 79,7% азота.
Альвеолярный воздух содержит 14,2% кислорода, 5,5% углекислого газа и 80% азота. Отличие выдыхаемого воздуха от альвеолярного воздуха объясняется тем, что он содержит воздух не только из альвеол, но также из мертвого пространства.
Все цифры приведены в перерасчете на сухой воздух, т. е. за вычетом паров воды, которыми всегда насыщен выдыхаемый воздух.
С целью исследования сравнительного содержания кислорода в атмосферном, выдыхаемом и альвеолярном воздухе используется промышленный парамагнитный оксианализатор ММГ-7.
Для работы необходимо: оксианализатор ММГ-7, мешок Дугласа, дыхательная маска или загубники, вата, спирт. Работа проводится на человеке.
Ход работы. В основу работы прибора ММГ-7 положен магнитомеханический метод измерения относительного содержания кислорода в газовых смесях.
Измерение относительного содержания кислорода в атмосферном воздухе происходит автоматически при засасывании в прибор воздуха из окружающей среды. Для измерения содержания кислорода в других газовых смесях их необходимо собрать в заборный мешок, снабженный специальным зажимом. Затем подсоединить резиновый шланг мешка к штуцеру «вход» на задней панели прибора. Засасывание воздуха из заборного мешка будет происходить автоматически. Отработанный воздух будет удаляться из прибора через штуцер с надписью «выход». При установлении стрелочного индикатора в устойчивое положение записывают показания прибора.
При работе с прибором необходимо учитывать следующие требования.
