
- •Методичні вказівки
- •6.040106 “Екологія і охорона навколишнього середовища”
- •1.1.2 Основні поняття про хімічний склад води
- •1.1.3 Види хімічних аналізів
- •1.1.4 Форми відображення результатів хімічних аналізів
- •Завдання для практичної роботи
- •1.2 Оцінка придатності води для зрошення
- •1.3 Визначення інтенсивності перетікання та витрат грунтових вод на випаровування
- •2.1.2 Вихідні дані та завдання роботи
- •2.1.3 Побудова карти загальної мінералізації ґрунтових вод
- •2.2 Побудова карт гідроізогіпс і глибин залягання ґрунтових вод
- •2.2.1 Теоретичні відомості
- •2.2.2 Грунтові води
- •2.2.3 Будування карт гідроізогіпс і глибин залягання ґрунтових вод
- •2.2.4 Аналіз карт гідроізогіпс
- •Завдання для розрахунково-графічної роботи № 1
- •Завдання для розрахунково-графічної роботи № 2
- •2.3 Визначення припливу води до водозабірних споруд
- •2.3.1 Загальні положення
- •Задача 1
- •Задача 2
- •Завдання
- •Перелік використаної літератури
1.1.4 Форми відображення результатів хімічних аналізів
Хімічний склад підземних вод установлюється за даними хімічних аналізів. Раніше результати усіх аналізів виражалися в окисно-ангідридній і сольовій формах. У першому випадку компоненти, які містяться у воді, виражаються таким чином: метали в окисній формі (Nа2O, K2О, CaО, MgО та ін.), а металоїди – в ангідридній (SO2, CO2, N2O5, N2O3 – ангідриди відповідних кисневих кислот). Сольова форма передбачала вираження результатів аналізу води у вигляді молекул солей, одержаних при комбінуванні катіонів та аніонів (Na2SO4, MgCl2, CaCO3 та ін.).
Головною формою існування більшості компонентів в підземних водах є іони, тому й перейшли до іонної форми виразу результатів хімічних аналізів.
При цьому вміст того або іншого іона виражають в прісних або слабомінералізованих водах у міліграмах на дециметр куб. (мг/дм3) або грамах на дециметр куб. (г/дм ). Для мінеральних і високомінералізованих підземних вод, питома вага котрих набагато більша одиниці, - в міліграмах або грамах на один кг води. Іонна форма виразу аналізу відповідає дійсному стану речовини у водних розчинах і відповідає дійсній можливості аналітично визначати саме іони, а не солі або окисли і ангідриди.
Проте лише перелік вмісту у воді іонів та їх вагової кількості ще не дають ясного уявлення про взаємозв'язок окремих іонів між собою. Відомо, що іони реагують один з одним у суворе визначених еквівалентних кількостях. Тому результати аналізу можна надавати і в еквівалентній формі, що дає можливість установити співвідношення між іонами. Для цього вагову іонну форму перераховують у еквівалентну. Цей перерахунок здійснюється шляхом ділення вагового вмісту іона в одному дециметрі куб. води на його еквівалентну вагу. Еквівалентна вага — це атомна вага елемента, поділена на його валентність. Атомна вага головних макрокомпонентів така: кальцій - 40,08; магній - 24,32; натрій - 22,997; хлор - 35,457; сірка - 32,066; кисень - 16,0.
Наприклад, 460 мг/дм3 натрію відповідає 460/(23:1) = 20 мг·екв.
Можна також вирахувати кількість іона у міліграмах - еквівалентах, помноживши його вагу в міліграмах на дм3 на коефіцієнт, протилежний еквівалентній вазі, тобто у даному прикладі будемо мати
460-(1:23) = 460-0,0435 = 20 мг·екв.
Для скорішого переходу до міліграмів-еквівалентів існують "Таблиці та номограми для рахування результатів гідрохімічних аналізів".
Тільки за вмістом будь-яких іонів (наприклад гідрокарбонату і кальцію), вираженому в міліграмах на дм3 (наприклад відповідно 554 і 181), не можна судити про те, який з них знаходиться у надлишку з точки зору утворення солі. Для цього треба перерахувати міліграми на дм в міліграм-еквіваленти. У даному прикладі 554 мг/дм3 гідрокарбонату відповідає 9,05 мг·екв (554:61 = 9,05) і 181 мг/дм" кальцію також дорівнює 9,05 мг·екв (181:20.04 = 9,05). Таким чином, іони гідрокарбонату і кальцію знаходяться у розчині в еквівалентних кількостях.
Для висновку про хімічний склад води і для порівняння води різної мінералізації, крім переліку іонів і виразу їх у ваговій і еквівалентній формах, необхідно мати уявлення про долю участі кожного з них у загальній кількості розчинених у воді речовин. З цією метою аналізи перераховуються у відсотково-еквівалентну (%-екв) форму. Тобто установлюють відносний вміст іонів, виражений у відсотках-еквівалентах від загальної суми іонів у даній воді.
Відомо, що б кожному водному розчині кількість еквівалентів катіонів дорівнює кількості еквівалентів аніонів, так як електроліти дисоціюють у водних розчинах на еквівалентну кількість тих і інших. Розчин при цьому є електронейтральним. Звичайно суму еквівалентів аніонів і суму еквівалентів катіонів приймають відповідно за сто відсотків і кількість знаходжуваного іона визначається із пропорції
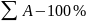
Ашук. – х% (1.1.1)
х
=
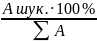
Для знаходжуваного катіона будемо мати
х
=
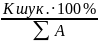 (1.1.2)
(1.1.2)
Еквівалентна форма виразу даних хімічного аналізу дозволяє вирішити цілий ряд практичних завдань.
1. Користуючись даними аналізу, вираженими в еквівалентній формі, можна визначити вміст недостатнього у цьому аналізі іона. Так, розрахунковим шляхом часто знаходять такі надто працемісткі для визначення компоненти, як натрій і калій.
Припустимо, що досліджувана вода має хімічний склад, наведений у таблиці.
У цьому випадку натрій і калій можна визначити за різницею сум еквівалентів аніонів і відшуканих катіонів, тобто кількість міліграм-еквівалентів натрію і калію буде рівнятися 9,76 – (4,42+2,01) = 3,33. Потім їх можна перерахувати в міліграмах на дм3 і відсотках-еквівалентах, що й зроблено при заповненні таблиці.
2. Еквівалентна форма вираження результатів аналізу має особливо важливе значення з точки зору його контролю. Сума міліграмів-еквівалентів аніонів повинна дорівнювати сумі міліграмів-еквівалентів катіонів. Якщо цього немає, то очевидно, що при аналізі не визначені якісь іони або припущені помилки в кількісному їх визначені.
Таблиця 1.1.1 – Хімічний склад підземних вод
Іони |
Вміст іонів |
||
мг/дм'3 |
мг·екв |
%-екв |
|
1 |
2 |
3 |
4 |
Катіони |
|
||
№+ + К+ Mg2+ Ca2+ |
76,6 24,4 88,6 |
3,33 2,01 4,42 |
34,1 20,6 45,3 |
Разом |
|
9,76 |
100 |
Аніони |
|
||
Cl- SO42- HCO3- |
124,5 83,0 276,3 |
3,51 1,73 4,52 |
36,0 17,7 46,3 |
Разом |
673,4 |
9,76 |
100 |
3. За допомогою еквівалентної форми виразу аналізу, перерахованої у відсотково-еквівалентну, класифікують підземні води, тобто визначають їх хімічний тип. При цьому назву воді дають за компонентами, які містяться у розчині у кількості більше 25%-екв.
Назву води починають з аніонів у завершують катіонами. Існують два способи назв хімічного типу води: старий та новий.
Старий – від більшого за вмістом іона до меншого. Стосовно до даного прикладу аналізу води будемо мати: вода гідрокарбонатно-хлорідно-кальцієво-натрієва.
Новий – від меншого за вмістом іона до більшого. У цьому випадку будемо мати: вода хлорідно-гідрокарбонатна натрієво-кальцієва.
Як бачимо, у першому випадку приводиться безперервний перелік катіонів і аніонів, у другому - аніони і катіони даються окремо.
Для наукового і короткого виразу хімічного складу води використовується формула Курлова. У ній кількісний вміст головних елементів виражено у відсотках-еквівалентах. Причому, головні аніони записуються у чисельнику, а головні катіони - у знаменнику. У цій формулі показано ті іони, вміст яких у воді більш 10%-екв. Літера "М" визначає мінералізацію в грамах на дм3 в лівій частині виразу. Приведений вище аналіз води може бути поданий як формула Курлова таким чином:
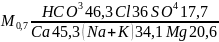 (1.1.3)
(1.1.3)
Рекомендується також показувати у формулі газовий склад та специфічні компоненти (залізо, бром, йод та ін.) ліворуч від мінералізації. Наприкінці формули можна вказати температуру води і дебіт свердловини або джерела.
4. За кількістю мг·екв аніонів (катіонів) можна приблизно судити про мінералізацію води у міліграмах на дм3. Виходячи з того, що 15,0 мг·екв аніонів або катіонів приблизно відповідає мінералізації 1000 мг/дм3, тобто 1 мг·екв аніонів (катіонів) відповідає мінералізації 70 мг/дм3. Звідки формула для визначення мінералізації води має такий вигляд:
ΣrА·70 = М, мг/дм3 (1.1.4)
або
ΣrК·70 = М, мг/дм3, (1.1.5)
де r – значок, який показує, що вміст аніонів (А) або катіонів (К) виражено у міліграмах - еквівалентах.
5. Еквівалентна форма дає можливість виражати жорсткість води у мг·екв (сучасна форма виразу жорсткості). Загальна жорсткість дорівнює кількості міліграмів-еквівалентів кальцію і магнію, які містяться в 1 дм3 води, тобто
загальна жорсткість = rСа + rМg. (1.1.6)
У даному прикладі загальна жорсткість дорівнює 6,43 мг·екв.
Одним із важливих властивостей води є її мінералізація, яка являє собою загальний вміст у воді мінеральних речовин, органічних сполук і колоїдів. Величину мінералізації звичайно визначають при хімічних аналізах води як суму всіх відшуканих твердих компонентів, які містяться у розчиненому стані у даній воді. Про величину мінералізації можна судити за сухим залишком, який отримують після випарювання води. При цьому слід пам'ятати, що величина сухого залишку може значно відрізнятися від мінералізації обчисленної за сумою іонів і молекул. Це розходження викликається звітрюванням двоокису вуглецю і води із гідрокарбонатів при випарюванні
12+32=44 2+16=18
Са(НСО3)2 = СаСО3↑ + СО2↑ + Н2О↑ (1.1.7)
(1 + 12+48)2=122 12+48=60 62
Із цієї схеми бачимо, що у сухому залишку знаходиться тільки половина, що містить у воді іонів НСО3-. У наведеному раніше прикладі аналізу води мінералізація складає 673,4мг/дм3, у той час як сухий залишок має бути рівним
76,6 + 24,4 + 88,6 + 12,45 + 83,0 + 276,3/2 = 535,2 мг/дм3
(тобто на 138,2 мг/дм3 менше).
