
- •Основные положения координационной теории
- •Получение комплексных солей
- •Классификация комплексных частиц
- •Содержит атомы не менее трех сортов (кроме водорода);
- •В качестве центрального атома выступает ион металла. Номенклатура комплексных соединений
- •Химическая связь в комплексных соединениях и их строение
- •Устойчивость комплексных соединений в растворе
- •Задания для отработки умения составлять уравнения реакций образования и разрушения гидроксокомплексов
Задания для отработки умения составлять уравнения реакций образования и разрушения гидроксокомплексов
1) Составьте уравнения четырех возможных реакций между растворами следующих соединений: гексагидроксохромат(III) калия, хлорид алюминия, сероводород, соляная кислота.
П р и м е р р е ш е н и я
а) K3[Cr(OH)6] + AlCl3 = Cr(OH)3 +Al(OH)3 + 3KCl;
б) K3[Cr(OH)6] + 3H2S = 3KHS + Cr(OH)3 + 3H2O;
в) K3[Cr(OH)6] + 6HCl (изб.) = 3KCl + CrCl3 + 6H2O;
г) K3[Cr(OH)6] + 3HCl (нед.) = 3KCl + Cr(OH)3 + 3H2O.
2) Даны водные растворы гексагидроксохромата(III) натрия, сернистого газа, бромида железа(III), гидроксида натрия.
Напишите уравнения четырех возможных реакций между ними.
3) Напишите уравнения четырех возможных реакций между растворами гексагидроксоалюмината калия, карбоната калия, угольной кислоты, хлорида хрома(III).
4) Осуществите превращения:
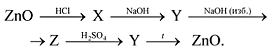
5) Осуществите превращения:

6). В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому классу комплексов относятся комплексные частицы, входящие в состав соединений и к какому классу химических веществ относится каждое из этих соединений:
а) [Zn(NH3)4](NO3)2; б) [Cr(CO)6]; в) K3[Co(NO3)6].H2O; г) Ca[Cr(NH3)2(NCS)4]2; д) [Cu(NH3)4]SO4.H2O; е) [K(H2O)6][Cr(H2O)6](SO4)2; ж) [H3O]3[FeCl6].H2O; и) K[Ag(CN)2]; к) Na3[FeF6]; л) Na[Sb(OH)6]; м) K2[HgI4]; н) [Cr(H2O)6]Cl3; п) [Cr(H2O)4Cl2]Cl.2H2O; р) Cs[ICl4]; с) H[AuCl4]; т) K[I(I)2]; у) Li[AlH4]; ф) [Cu(NH3)4](OH)2; х) [N(CH3)4]Cl; ц) [P(C6H5)4][B(C6H5)4]; ?) [H3O][AuBr4].4H2O; o) [PCl4][PCl6].
7). Составьте формулы следующих комплексных соединений: гексахлоропалладат(IV) аммония; дихлороаргентат(I) цезия; гидроксотрихлороаурат(III) оксония; гексабромоиридат(III) калия; сульфат дихлоротетраамминкобальта(III); тетрагидридоборат цезия; гексакарбонилхром.
8). Осуществите следующие превращения:
а)
CuSO4
![]() CuI
CuI
![]() Na3[Cu(S2O3)2]
Na3[Cu(S2O3)2]![]() Cu2S;
б) Cu2O
Cu2S;
б) Cu2O![]() [Cu(NH3)2]OH
[Cu(NH3)2]OH
![]() H[CuCl2];
в)
CuSO4
(CuOH)2SO4
[Cu(NH3)4]SO4
H[CuCl2];
в)
CuSO4
(CuOH)2SO4
[Cu(NH3)4]SO4
![]() CuSO4;
г)
AgNO3
CuSO4;
г)
AgNO3
![]() AgCl
[Ag(NH3)2]Cl
AgI
Na3[Ag(S2O3)2]
Ag2S;
д) FeCl3
AgCl
[Ag(NH3)2]Cl
AgI
Na3[Ag(S2O3)2]
Ag2S;
д) FeCl3
![]() Na3[Fe(H2O)4(NCS)2]
Na3[Fe(H2O)4(NCS)2]
![]() Na3[FeF6];
е)
CoCl2
[Co(NH3)6]
Na3[FeF6];
е)
CoCl2
[Co(NH3)6]
![]() [Co(NH3)6]Cl2(OH);
ж)
Hg(NO3)2
HgI2
[HgI4]2
HgS.
[Co(NH3)6]Cl2(OH);
ж)
Hg(NO3)2
HgI2
[HgI4]2
HgS.
Опыт 1. Образование аквакомплекса. 1 микрошпатель безводного сульфата меди поместить в пробирку и по каплям добавить воду. Наблюдать происходящие изменения. Составить химические уравнения протекающих процессов.
Опыт 2. разрушение аквакомплекса. 1 микрошпатель гептагидрата сульфата никеля поместить в пробирку. Пробирку закрепить в штативе и сначала осторожно, а затем интенсивно нагреть на открытом пламени. Отметить изменения цвета соли. Зная, что на первом этапе удаляется одна молекула воды, а на втором шесть, составить, структурную формулу исходного соединения.
Опыт 3. Образование аммиакатов. К раствору сульфата меди, полученному в первом опыте, добавить 5 - 6 капель раствора аммиака. Наблюдать изменение окраски. То же проделать с раствором сульфата никеля. Составить ионные уравнения реакции.
Опыт 4. Разрушение аммиаката. К раствору, содержащему аммиакат меди, полученный в предыдущем опыте, добавить несколько капель разбавленной серной кислоты до изменения окраски раствора. Составить уравнения реакций и объяснить происходящие изменения.
Опыт 5. Образование и разрушение гидроксокомплекса. K раствору хлорида алюминия и щелочи (3-4 капли) добавить по каплям концентрированный раствор щелочи. Наблюдать образование и дальнейшее растворение осадка. Затем в полученный раствор по каплям добавить соляную кислоту до растворения первоначально выпадающего осадка. Составит уравнения реакций и объяснить происходящие изменения.
Опыт 6. Получение ацидокомплексов. К 2-3 каплям раствора хлорида железа(III) добавить (роданида) аммония. Затем добавить раствор фторида натрия до обесцвечивания. Составить уравнения реакций и объяснить изменение цвета раствора.
Опыт 7. Получение полигалогенида. 2-3 кристаллика йода поместить в пробирку и добавить в нее 2 капли воды. Что происходит? Добавить в пробирку 5-6 капель раствора йодида калия и перемешать. Наблюдать происходящие изменения, составить уравнение реакции.
