
- •3. Формула Релея-Джинса.
- •17.Соотношение неопределенностей Гейзенберга и волновые свойства микрочастиц. Наборы одновременно измеримых величин.
- •18.Временное уравнение Шредингера. Стационарное уравнение Шредингера. Стационарные состояния.
- •Адиабата Пуассона
- •Основное уравнение мкт
- •Закон о суммарном давлении смеси газов
- •Закон о растворимости компонентов газовой смеси
- •Виды теплообмена
18.Временное уравнение Шредингера. Стационарное уравнение Шредингера. Стационарные состояния.
Для понимания уравнения Шредингера рассмотрим свободно движущуюся микрочастицу, обладающую волновыми свойствами. Для этого используем уравнение плоской монохроматичной волны в комплексном виде.
 (1),
где
(1),
где
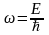 ;
;

 (2)
– волновая функция для свободной
микрочастицы, движущейся в направлении
x.
(2)
– волновая функция для свободной
микрочастицы, движущейся в направлении
x.
 (4)
– нестационарное временное уравнение
Шредингера для свободно движущейся
микрочастицы.
(4)
– нестационарное временное уравнение
Шредингера для свободно движущейся
микрочастицы.
Если
эта частица движется в силовом поле,
то
 (5) – нестационарное временное уравнение
Шредингера для свободно движущейся
микрочастицы в силовом поле, где U
– потенциальная энергия.
(5) – нестационарное временное уравнение
Шредингера для свободно движущейся
микрочастицы в силовом поле, где U
– потенциальная энергия.
 -
стационарное безвременной уравнение
Шредингера для свободно движущейся
частицы(уравнение стоячей волны).
-
стационарное безвременной уравнение
Шредингера для свободно движущейся
частицы(уравнение стоячей волны).
 -
стационарное безвременной уравнение
Шредингера для свободно движущейся
частицы в силовом поле, где E
– полная энергия частицы, U
– потенциальная энергия.
-
стационарное безвременной уравнение
Шредингера для свободно движущейся
частицы в силовом поле, где E
– полная энергия частицы, U
– потенциальная энергия.
Для решения уравнения Шредингера должны быть выполнены 2 условия:
1. Функция непрерывна, конечна и однозначна.
2. Значение энергии тоже должно быть собственным.
 -
собственная волновая функция.
-
собственная волновая функция.
 -
собственное значение энергии электрона,
находящемся на n-ом
энергетическом уровне в одномерной
потенциальной яме с бесконечно высокими
стенками.
-
собственное значение энергии электрона,
находящемся на n-ом
энергетическом уровне в одномерной
потенциальной яме с бесконечно высокими
стенками.
Туннельный
эффект (туннелирование)
— прохождение частицы (или системы)
сквозь область пространства, пребывание
в которой запрещено классической
механикой. Наиболее известный пример
такого процесса – прохождение частицы
сквозь потенциальный барьер, когда её
энергия Е меньше высоты барьера U0.
В классической физике частица не может
оказаться в области такого барьера и
тем более пройти сквозь неё, так как
это нарушает закон сохранения энергии.
Однако в квантовой физике ситуация
принципиально другая. Квантовая частица
не движется по какой-либо определенной
траектории. Поэтому можно лишь говорить
о вероятности нахождения частицы в
определенной области пространства ![]() р
х >
р
х > ![]() . При
этом ни потенциальная, ни кинетическая
энергии не имеют определенных значений
в соответствии с принципом неопределенности.
Допускается отклонение от классической
энергии Е на величину
Е в
течение интервалов времени
t, даваемых
соотношением неопределённостей
Е
t >
(
=
h/2
. При
этом ни потенциальная, ни кинетическая
энергии не имеют определенных значений
в соответствии с принципом неопределенности.
Допускается отклонение от классической
энергии Е на величину
Е в
течение интервалов времени
t, даваемых
соотношением неопределённостей
Е
t >
(
=
h/2![]() , где
h – п
, где
h – п остоянная
Планка).
остоянная
Планка).
Возможность прохождения частицы сквозь потенциальный барьер обусловлена требованием непрерывной волновой функции на стенках потенциального барьера. Вероятность обнаружения частицы справа и слева связаны между собой соотношением, зависящим от разности E - U(x) в области потенциального барьера и от ширины барьера x1 - x2 при данной энергии.

С увеличением высоты и ширины барьера вероятность туннельного эффекта экспоненциально спадает. Вероятность туннельного эффекта также быстро убывает с увеличением массы частицы. Проникновение сквозь барьер носит вероятностный характер. Частица с Е < U0, натолкнувшись на барьер, может либо пройти сквозь него, либо отразиться. Суммарная вероятность этих двух возможностей равна 1. Если на барьер падает поток частиц с Е < U0, то часть этого потока будет просачиваться сквозь барьер, а часть – отражаться. Туннельное прохождение частицы через потенциальный барьер лежит в основе многих явлений ядерной и атомной физики: альфа-распад, холодная эмиссия электронов из металлов, явления в контактном слое двух полупроводников и т.д.
19.Молекулярная физика и термодинамика. Методы:
Статистический ( молекулярнокинетический) – основан на исп.1й теории вероятности и физич.моделей изучаемых систем
Термодинамический – основан на анализе условий и колличественных соотношений при различных превращ.энергии, происходящих в системе
Система – любая совокупность тел и частиц
Параметры состояния системы – хар-ет систему. Параметры: P,V,T,n – явл. Макроскопическими и имеют смысл средних значений ф-ций, хар-ющих динамическое сост.системы, такое состояние определяется координатами и скоростями всех молекул и атомов в опред. Сист.
Если сост.системы хар-ется при постоянных внешних воздействиях неизвестностью во времени параметров и отсутствием в системе потоков инергии или в-ва –то оно РАВНОВЕСНОЕ. В таком состоянии система может находиться долго.
Примеры термодинамич систем – газ в сосуде,жидкость и нах.в ней в равновесии пар, тв.тела
Молекулярная физика – это раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Основные положения теории –
Молекулы, атомы, ионы в-ва нах в непрерывном хаотическом движении
Между частицами любого тела действуют силы притяжения и отталкивания
Все тела состоят из отдельных обособленных частиц
Основные понятия мкт:атом, молекула, ион
Идеальным газом наз газ, у которого:
Молекулы явл материальными точками,т.е.их размеры бесконечно малы
На расстояние между молекулами не действуют силы притяжения или отталкивания
Столкновения между молекулами происх по законам абсолютно упругих ударов
Билет 20
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
 —
давление,
—
давление, —
молярный
объём,
—
молярный
объём, —
универсальная
газовая постоянная
—
универсальная
газовая постоянная —
абсолютная
температура,К.
—
абсолютная
температура,К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества,
а
—
количество
вещества,
а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса,
уравнение состояния можно записать:
—
молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
![]()
Так
как в одном киломоле содержится
![]() молекул,
то внутренняя энергия одного киломоля
газа будет
молекул,
то внутренняя энергия одного киломоля
газа будет
![]() Учитывая,
что
Учитывая,
что
![]() ,
получим
,
получим
![]()
Для
любой массы m газа, т.е. для любого числа
киломолей
![]() внутренняя
энергия
внутренняя
энергия
|
(10.12) |
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
Средняя кинетическая энергия молекулы идеального газа
|
![]()
Энергия (одной молекулы), размерность в СИ - |
Дж |
![]()
Постоянная
Больцмана
|
|
![]()
Температура, размерность в СИ - |
К |
Среднеквадратичная скорость молекул
Mr — молярная масса газа
![]()
Наиболее вероятная скорость молекул
![]() .
.
Билет 21
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс)
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (P = const)
![]()
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном объёме (V = const). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
![]()
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const)(PV = const). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.

![]()
Графики изопроцессов в различных системах координат
Адиабати́ческий или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии
Адиабатический процесс является частным случаем политропного процесса. Адиабатические процессы обратимы, только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только квазистатические адиабатические процессы[2]
