
- •Вопросы по дисплине общая химия
- •Постулаты эйнштейна
- •Получение
- •Оксиды Классификация
- •Получение
- •Кислоты
- •Классификация
- •Получение
- •1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
- •Химические свойства
- •Классификация
- •Средние соли Получение
- •Химические свойства
- •Строение
- •Получение
Постулаты эйнштейна
– основные принципы специальной (или частной) теории относительности, созданной А. Эйнштейном.
Первый постулат Эйнштейна: законы физики во всех инерциальных системах отсчета имеют один и тот же вид (принцип относительности Эйнштейна).
Второй постулат Эйнштейна: скорость света в вакууме во всех инерциальных системах отсчета имеет одно и то же значение (принцип существования инвариантной конечной скорости).
закон постоянного состава( Дальтониды, Бертоллиды )
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
Дальтониды и бертоллиды, термины, введённые Н. С. Курнаковым в 1912—14 для обозначения химических соединений постоянного состава (дальтониды) и переменного состава (бертоллиды). Термин "дальтониды" предложен в память Дж. Дальтона, а термин "бертоллиды" — в память К. Л. Бертолле. Большинство обычных химических соединений является дальтонидами; их состав удовлетворяет законам постоянства состава и кратных отношений. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди окислов, сульфидов, карбидов, гидридов и др
понятие эквивалента .
Химически эквивалентом – называется такое его количество , которое соединяет с 1 моль атомы водорода или замещает то же количество атомов водорода в химических реакциях.
Закон эквивалентов(Рихтер)
Простые вещества реагируют между собой или замещают друг друга в химических соединениях в количествах пропорциональных их эквивалентам.
mA/mB=ЭА/ЭВ
где mA , mB – массы реагирующих веществ, ЭА,ЭВ-их химические эквиваленты.
Методика расчета эквивалентов.
Между молекулярной массой М, молярной массой эквивалента Э и валентностью В элемента А существует соотношение
ЭА =МА/В
Экислоты = молекулярная масса/основность кислоты
Эоснования= молекулярная масса/кислотность основания
Эсоли= молекулярная масса/валентность металла(число атомов металла в молекула соли)
Закон кратных отношении (Дальтон).
Если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого , которые относятся между собой как простые целые вещества
Закон Авогадро.
В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул. Молекулы простых газов двухатомны (H2,O2,N2)
1 моль – 22,4 л – 6,023 * 1023 молекул (NA – число Авогадро) при нормальных условиях (273,15 К, 101,325 кПа)
Следствие из закона Авогадро.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
![]() .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d — удельный вес его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар без разложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного веса воздуха, принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу удельный вес водорода. Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С, мы из формулы имеем с другой стороны m = dC. Так как удельный вес пара определяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела.
Уравнение Клаперона – Менделеева
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
 — давление,
— давление,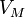 — молярный
объём,
— молярный
объём,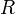 — универсальная
газовая постоянная
— универсальная
газовая постоянная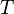 — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как ![]() ,
где
,
где ![]() — количество
вещества,
а
— количество
вещества,
а ![]() ,
где
,
где ![]() —
масса,
—
масса, ![]() — молярная
масса,
уравнение состояния можно записать:
— молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Основные классы неорганических соединений Оксиды, основания ( гидроксиды ), кислоты соли. Их классификация.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Неорганические вещества |
|
Простые |
Металлы |
Неметаллы |
|
Сложные |
Оксиды |
Основания |
|
Кислоты |
|
Соли |
|
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например кислород O2 и озон O3
2) образованием различных кристаллических форм, например алмаз и графит.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
