Энергия ковалентной связи
Химическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r0) эта энергия минимальна.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
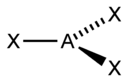
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с ихсобственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s-связью. -Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
sp2 |
3 |
Треугольная |
|
BF3, NO3–, CO32– |
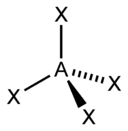
sp3 |
4 |
Тетраэдрическая |
|
CH4, ClO4–, SO42–, NH4+ |
dsp2 |
4 |
Плоскоквадратная |
|
Ni(CO)4, XeF4 |
sp3d |
5 |
Гексаэдрическая |
|
PCl5, AsF5 |
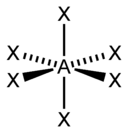
sp3d2 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63–, CoF63– |
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной. Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
Ненаправленность и ненасыщаемость В ионном соединении каждый ион притягивает к себе независимо от направления неограниченное число противоположно заряженных ионов из-за сил электростатического взаимодействия Взаимное отталкивание противоионов ограничивает их число в окружении каждого иона.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.