
1.Ме і метал.сплави – кристалічні тіла, атоми яких розташ. закономірно. Ме(добуті звичайним способом) – полікристалічні тіла, які склад.з вел. числа мілких, орієнтованих в різних напрямках кристалів.Fe і сплави на його основі – чорні Ме,а інші – кольорові(мало використ.).Властивості: висока теплопровідність і ел.провідність;метал. блиск; пластичність; додатній температурний коефіцієнт ел.опору(з підв.Т ел.опір чистихМе зростає); підвищена здатність до пластичної деформації; термоелект- ронною емісією(здатність випускати е-ни при нагріванні).Ці властивості характеризують металічний стан речовин.Ме високого ступ.чистоти (сумарна к-сть основного і всіх легуючих компон) не відповідають потрібним властивостям, тому викор.сплави(отримуються сплавленням або с спіканням порошків2-х і більшеМе або не Ме).Вони відповідають Ме властивостям. Компонентом ми будемо називати хім.. елемент який входить до складу контрукц. Матеріалу(КМ) .Осн. компонент – хім.елемент,масова частка якого в КМ найбільша.Легуючий комп.- комп.,який навмисно вводиться для отримання певних властивос- тей.Домішок – комп.,який навмисно не вводиться і наявність якого не погіршує властивостіКМ.Забрудн.-комп.,який існує в певному матеріалі і погірш.власт.КМ.(Сu2O-електролітична мідь:О2 не вплив.на електропровідн.-домішок;в НВЧ Cu2О+H2=(t)H2O+Cu –воднева хвороба міді:забр.) Фаза-гомог. част. в гетерог. системі що має поверхню розділу Сукупність фаз, які знах.в стані рівноваги, наз.сисмою. Структура – форма, розмір і хар-тер взаємного розміщення відповідних фаз в Ме чи сплавах.Сліди – наявність домішок або забр., яка може бути визначена якісним аналізом(скільки не вистачає чутливості в апараті).
2![]() .ТС-
будь-яка сукупність тіл або часток, в
якій відбув.теплообмін або дифузія.Класиф.:по
взаємодії з навколишнім
середовищем:ізольовані,неіз;за
станом:рівнов.(стан може зберігатись
достатньо довго),нерівн.; за
структурою:гомогенні(немає окремих
частин з різними властив.або
станом),гетерог.Закон
збер. енерг:ΔE=Q-W
(ΔE
– зміна повної енергії)-різні види
енергії можуть переходити одна в
одну.ІІз-н:не існує процеса, єдиним
результатом якого був би перехід від
хол. тіла до нагрітого (експеримент:тепло
завжди переходить від нагрітого тіла
до холодного).
Пост.Клаузіуса
.ТС-
будь-яка сукупність тіл або часток, в
якій відбув.теплообмін або дифузія.Класиф.:по
взаємодії з навколишнім
середовищем:ізольовані,неіз;за
станом:рівнов.(стан може зберігатись
достатньо довго),нерівн.; за
структурою:гомогенні(немає окремих
частин з різними властив.або
станом),гетерог.Закон
збер. енерг:ΔE=Q-W
(ΔE
– зміна повної енергії)-різні види
енергії можуть переходити одна в
одну.ІІз-н:не існує процеса, єдиним
результатом якого був би перехід від
хол. тіла до нагрітого (експеримент:тепло
завжди переходить від нагрітого тіла
до холодного).
Пост.Клаузіуса
2 металеві кусочки з’єднані проволкою і поміщ.в ідеальний ізолятор.1+2-ізольованаТС,окремо-неізольована .Т1>Т2:перехід тепла 12-необернений(нерівн.стан).нехай |Т1-Т2|0. Напрям переходу тепла можна змінити на зворотній нескінченно малою зміною Т тіл-обернений перехід, а стан-рівноважний.-Q=+Q(к-сть відданого тепла=к-сті придбаного). Він визначив зміну ентропії термодинамічної системи при оборотному процесі як відношення зміни загальної кількості тепла ΔQ до величини абсолютної температури T:
ΔS>Qr/T (Qr-обернений перехід тепла, що хар-є рівноважний стан)-неізол.сис-ма. Нехай S1↓:-Q1/T1, S2↑ΔS=Q2/T2-Q1/T1=Q(T1-T2)/ T1T2>0.В рівноважному стані ентропія ізол.ТС максимальна ΔS>=0.ентропія-хар-є ступінь невпорядкованості сис-ми.
3![]() .Вільна
енергіяТС.
ТС взаємодіє з термостатом(величезне
тіло зТ):неізол.сис-ма. ΔE=Q-W,
ΔS>=0.Нехай
ТС при P,V,T=const,тоді:
ΔS=Qr/T(Qr-обернений
перехід тепла, що хар-є рівноважний
стан)-неізол.сис-ма. ΔS>=Q/TQ<=TΔS.
W=Q-ΔE
W<=TΔS-ΔE—максим.робота,
яка може бути виконана ТС за Т=конст.
0<= TΔS-
ΔE-нова
ф-я стану під назвою вільна енергія
Гельмгольца
(ТД потенціал) F:
F=E-TΔS,
диференц.це р-ня: ΔF=
ΔE-
TΔS
.Вільна
енергіяТС.
ТС взаємодіє з термостатом(величезне
тіло зТ):неізол.сис-ма. ΔE=Q-W,
ΔS>=0.Нехай
ТС при P,V,T=const,тоді:
ΔS=Qr/T(Qr-обернений
перехід тепла, що хар-є рівноважний
стан)-неізол.сис-ма. ΔS>=Q/TQ<=TΔS.
W=Q-ΔE
W<=TΔS-ΔE—максим.робота,
яка може бути виконана ТС за Т=конст.
0<= TΔS-
ΔE-нова
ф-я стану під назвою вільна енергія
Гельмгольца
(ТД потенціал) F:
F=E-TΔS,
диференц.це р-ня: ΔF=
ΔE-
TΔS
0<=(-ΔF) ΔF<=0.В рівноважному стані вільна енергія ТС мінімальна. Цю теор.продовжив Гіббс ΔG<=0.Енергія Гіббса – частина енергії сис-ми, яка може бути використана на виконання корисної роботи.
4. Різновиди звязкуМе зв’язок. Умовою виникнення хім.зв. є зменш.потенц.енергії сис-ми взаємодіючих атомів.Види: гетерополярний(іонний, йон може притягувати до себе будь-яку к-сть протилежно заряджених йонів і в будь-якому напрямку. Тому для йон.зв. характерно:ненасиченість і ненапрямленість,результат-кристали),гомеополярний(ковалентний, ков.хім.зв’язок утв-ся 2-ма протил. направл.спінами, при чому ця пара належить двом атомам,рез.-молекули і кристали), Ван-дер-Ваальса(за рахунок зміщення в просторі, сили міжмолекулярної взаємодії, які виникають без передачі атомами е, обусловлюють притягання молекул, агрегацію речовини, перетворення газоподібної речовини в рідкий і навіть в твердий стан, а також явище адсорбції),металічний(Ме склад.з додатньо заряджених іонів, які омиваються „газом” з вільних колективізованих е-в.Зв’язок відбув.за рах. електрост.сил.Між іонами і колективізрваними е-ми провідності виникають електрост.сили притягання, які стягують іони. Атоми розміщуються на такій відстані один від одного, при якому енергія взаємодії мінімальна (а0).Сили зв’язку визначаються силами відштовх.і притягування.1-енергія відштовх.,2-притяг.,3-сумарна ен.взаємодії.Зближення атомів на відстань<чи>а0 виконується при виконанні роботи проти сил відштовхування чи притягування.тому в Ме атоми розміщуються закономірно, утв-чи правильну гратку, що відповідає мін.енергії взаємодії атомів.).
5.Кристалічна гратка – порядок у просторі, уявні площини та лінії, які проходять через центри атомів чи іонів.цей порядок має відстань l>>a(мін.відстань між атомами).Крист.гратка ще наз.далеким порядком.В кристалічній структурі виділяється min V, який характерезує цю структуру, яка називається елементарною коміркою. яка має певну геом.форму
Елем комірку яку можна отримати за допомогою трансляції –градкою Браве. Існує 14 граток , кутами і періодами).а,в,с-періоди(мін.однакова відстань між найближчими сусідами в напрямку кристалограф.осей)Базис-кільк атом на одну елементарну комірку..елементарні чарунки: 1.ОЦК(об’ємноцентрований куб),на 1-ну елемент.чарунку приходиться 2атоми:1в центрі куба і 1вносять атоми в вершинах куба-базис=2.К8-координ.число(показує,скільки найближчих сусідів має кожний атом, залізо). 2.ГЦК(гранецентр.),К12,на елем.чарункуприход.4атоми(8/8+6/2=4)Сu,Ni,Au.3.ГЩС(гексогональнащільноспаков.),К12,базис=3+12/6+2/2=6.Коефіцієнт компактності (відносна щільність упаковки) хар-є величину вільногоV.4/3πR3базис/а3.
6.Дефекти крист.будови.Спотворення крист.решітки Об’ємні, поверхневі, лінійні, точкові.
1)Об’ємні – дефекти що мають значну протяжність у всих напрямках. Відносять: газові раковини, тріщини.
2) Поверхневі-.деф. що виник на поверхня розділу між окремими зернами в полікрист.Ме.Полікристал склад.з великого числа зерен, в сусідніх зернах крист.гратки орієнтовані порізному.Кожне зерно Ме склад-ся з субзерен, які скл-ть субструктуру(різна орієнтація відносно 1одного).Границя розділу скл-ся з гратки одногокристала,який має певну кристалограф.орієнтацію і
переходить в гратку ін.кристала з ін.орієнтацією
![]()
3)Точкові.Головна причина виникнення-тепловий рух атомів(вони коливаються і можуть зірватися з місця). Найбільше впливають на н/п-ві матеріали. а)вакансія (дефект Шотткі)-віфдсутність атома у вузлі крист.гратки(нерівнов.стан).утв-ся в результаті переходу атома з вузла гратки на поверхню або повного зникнення з поверхні кристалу( і рідше-в результаті їх перходу у міжвузля).В крист.завжди є атоми у яких кінет.енергія↑, тому такі атоми можуть вийти у міжвузля, а їх місце займуть інші атоми,вузли яких залишаться вільними – теплові вакансії, але вони не є непорушними, час життя невеликий, шв.руху і густина вак.залежить відТ.Виникають в результаті нагрівання, пласт.деформації, рекристалізації. б)Дислокований атом-перехід атома з вузла у міжвузля.(атом може бути своїм і чужим)
.Шв.і густина зал.відТ.
в)Заміщений атом(чужий).Залежить від розміру заміщ.атома.Точкові деф.виникають і як результат існування домішок вМе(вони заміщують атоми основного Ме в крист.решітці або стають у міжвузлі).Наявність вакансій може призвести до дифузії (переміщ.атомів на відстані>мін). Найбільше точкові деф.впливають на н/п матеріали, на фазові перетворення в Ме і сплавах.
7.Дислокації.3)Лінійні Дислок.-лінія, яка розділяє досконалі частини крист.гратки. а)Крайова дислок.- локалізоване викривлення крист.гратки, викликане зайвим атомними напівплощин. Є позит. (вгору) і негат.дислокації. навкруги лінії дислокації існує обл., де атоми зсунуті,тому це нерівн.стан.,а крист.гратка намагається перейти в рівн.стан, тому дислок.має рухатися. Терепластування – рух зайвої площини(при звич.умовах дисл.непорушні,бо атоми утримують дислок) відбув.за Т↑ Ковзання -.мех.напруження τ=сила зсуву/перетин гратки. Якщо негативна дислокація, то її напрям протилежний напряму зсуву. Ідеал.крист.гратка має високу твердість і міцність., але такі гратки неможливо було б обробляти. Контуром Бюргерса – довільний контур в кристалі який проходить від атома то атом так що всередині зявляеться дислокація. Вектор необхідний що б замкнути контур- в Б. (-вектор трансляції градки). б)Гвинтова. (негативна) і права. Дислокація рух.вперед і залишає за собою ідеальну гратку—пластування.Пласт.і ковзання відбув.в одному напрямі, а Вектор Бюргерса лежить в площині ковзання.
8.Походж.дислокацій Дислокації можуть виникнути в процесі кристалізації Уявимо що в процесі зростання двух кристалів А і В на зустріч один одному в момент їх формування в одному з них зявилася площина СD яка не отримала розвитку через увесь кристал . В результаті формується новий кристал з неповністю заповненою атомною плоскістю – екстраплоскість Викривлення з обох боків від краю екстра плоскості малі, але вздовж краю екстра плоскості ці викрив йдуть через весь тристал (тисячі періодів крист.градки) Саме розмірні ознаки і формують лінійний дефект .Обумовлена недосконалістю процесу кристалізації р-тв.Щоб не було дислок., треба провести крист.з пару.Зростання гратки відбув.під невеликим кутом. Важливою хар-кою дислок.структури є густина дислокацій=сума довжини дислокації/одиниця об’єму. Чим менший кут,тим більший Δ.
9![]() .Анізотропія.Неоднаковість
властивостей по різним кристалографічним
напрямам.Фізична причина – неоднакова
відстань між атомами в гратці.Власт.зал.від
напрямку.Зародки вже не є елементарною
чарункою.
Внаслідок
Броунівського руху зародки безперервно
рухаються.Зародки зростають і утворюються
новіконтактзовн.форма
спотворюється
кристаліти(аніз.є)
полікристалічна будова(немає залежності
властивостей від напрямку,
квазіізотропія-ізотропія
що містить велику кількість структурних
елементів орієнтованих у всіх
напрямках).Текстура
– закономірна орієнтація кристалів,
тобто штучно зроблена залежність
властивостей від напрямку. Є текстура
деформації(чим↑ступінь деформ.,тим↑частина
крист.зерен отримує певну орієнтацію,
залежить від природи Ме і виду текстури,
анізотропія механ.та фіз.властивостей)
та текст.рекристалізації(характер
текстури виз-ся умовами проведення
відпалу,видом попередньої обробки, при
низьких Т відпалу Ме ГЦК – як і
текс.деформації,при виникненні цієї
текстури Ме хар-ся анізотропними
властивостями).
.Анізотропія.Неоднаковість
властивостей по різним кристалографічним
напрямам.Фізична причина – неоднакова
відстань між атомами в гратці.Власт.зал.від
напрямку.Зародки вже не є елементарною
чарункою.
Внаслідок
Броунівського руху зародки безперервно
рухаються.Зародки зростають і утворюються
новіконтактзовн.форма
спотворюється
кристаліти(аніз.є)
полікристалічна будова(немає залежності
властивостей від напрямку,
квазіізотропія-ізотропія
що містить велику кількість структурних
елементів орієнтованих у всіх
напрямках).Текстура
– закономірна орієнтація кристалів,
тобто штучно зроблена залежність
властивостей від напрямку. Є текстура
деформації(чим↑ступінь деформ.,тим↑частина
крист.зерен отримує певну орієнтацію,
залежить від природи Ме і виду текстури,
анізотропія механ.та фіз.властивостей)
та текст.рекристалізації(характер
текстури виз-ся умовами проведення
відпалу,видом попередньої обробки, при
низьких Т відпалу Ме ГЦК – як і
текс.деформації,при виникненні цієї
текстури Ме хар-ся анізотропними
властивостями).
1![]() 0.Крист.простої
речовини.
0.Крист.простої
речовини.
Кристалізація- перехід речовини з рідкого стану в твердий(первинна), вторинна-перехід речовини з одної форми в ін.в твердому стані.кристалізація протікає в умовах,коли сис-ма переходить до термодин.більш стійкого стану з меншою енергієюГіббса(Gр>Gкрист).G=E-TΔS.1-вільна енергія твердого стану.вище tі більш
устойч.рідкийМе(з меншим запасом вільної енергії).При tі ен.Г.рівні-рівноважнаТ кристалізації(2 фази існують одночасно).процес
кристалізації почин.,коли виникаєрізницяG(Gр>Gтв).процес крист.протікає при переохолодженніМе нище ti.Ступінь переохолодження: Δt=ti-t1.На руйнув.крист.гратки витрач.прихована енергія.чим швидше охол.,тим більша ступінь переохолодження.
1![]() 1.Спонтанне
ут-ня зародків кристалізації.
В рідкому Ме атоми не розташовані
хаотично,як у газі,але і не так правильно,як
у крист.тіла,де атоми зберігають
постійність міжатомних відстаней і
кутових відношень на вел.відстанях(дальній
порядок).тут лише ближній порядок
(впорядкованість не на вел. відстанях)
.завдяки інтенсивному тепловому рухові
атомів ближн. порядок не стійкий.Фактори
ближн.порядку:к-сть атомів рідини в
макрооб’ємі дуже велика,всі атоми
рухаються.Є ймовірність миттєвого
розташування атомів в порядку.кожна
поверхня має енергію розділу,всередині
фази всі сили врівноважені,а на поверхні
– ні.Ближній порядок повинен перетвор.в
зародок, якщоΔFv<ΔFповерхнева.Здатними
до утв-ня є великі зародки.Чим менший
критичний зародок, тим є більша ймовірність
подальшого утв-ня і росту зародків, бо
витрач.менше енергії і роботи. При
збільшенні швидкості крит.радіус
зменшується. ΔFпов/ΔFv=S/V=6b2/b3=6/b
1.Спонтанне
ут-ня зародків кристалізації.
В рідкому Ме атоми не розташовані
хаотично,як у газі,але і не так правильно,як
у крист.тіла,де атоми зберігають
постійність міжатомних відстаней і
кутових відношень на вел.відстанях(дальній
порядок).тут лише ближній порядок
(впорядкованість не на вел. відстанях)
.завдяки інтенсивному тепловому рухові
атомів ближн. порядок не стійкий.Фактори
ближн.порядку:к-сть атомів рідини в
макрооб’ємі дуже велика,всі атоми
рухаються.Є ймовірність миттєвого
розташування атомів в порядку.кожна
поверхня має енергію розділу,всередині
фази всі сили врівноважені,а на поверхні
– ні.Ближній порядок повинен перетвор.в
зародок, якщоΔFv<ΔFповерхнева.Здатними
до утв-ня є великі зародки.Чим менший
критичний зародок, тим є більша ймовірність
подальшого утв-ня і росту зародків, бо
витрач.менше енергії і роботи. При
збільшенні швидкості крит.радіус
зменшується. ΔFпов/ΔFv=S/V=6b2/b3=6/b
1 2.Критичний розмір зародка кристалізації.
V![]() -шв.зростання
зародка,N-шв.утв-ня
зародка.Величина зерна залежить від
степені переохолодження,від різниці
вільних енергій Гіббса,температура
нагрівання і розливу рідкогоМе, його
хім.склад і присутність домішок,а також
є функцією від критичного радіусу (чим
він менший, тим дисперсніші будуть
зерна).Коли ступені переох.досить
великі,то Ткристалізації знижується
гальмується дифузійний рух,який
залеж.відТ.Після хвилястої лінії
кристалізації не буде взагалі(рідина
твердіє як аморфний стан→квазіаморфна
структура:мех.власт.малі,магн.проникл.
висока,збільшують динам.діапазон
апарата).
ΔFпов/ΔFv=S/V=6b2/b3=6/b
-шв.зростання
зародка,N-шв.утв-ня
зародка.Величина зерна залежить від
степені переохолодження,від різниці
вільних енергій Гіббса,температура
нагрівання і розливу рідкогоМе, його
хім.склад і присутність домішок,а також
є функцією від критичного радіусу (чим
він менший, тим дисперсніші будуть
зерна).Коли ступені переох.досить
великі,то Ткристалізації знижується
гальмується дифузійний рух,який
залеж.відТ.Після хвилястої лінії
кристалізації не буде взагалі(рідина
твердіє як аморфний стан→квазіаморфна
структура:мех.власт.малі,магн.проникл.
висока,збільшують динам.діапазон
апарата).
ΔFпов/ΔFv=S/V=6b2/b3=6/b
Здатними до зростання і перетворення в кристал є більші зародки.
(На мал. Не указ критичний радіус r, критичний розмір зародка b)
1![]()
![]() 3.Критичний
радіус зародка кристалізації—це
мінімальний радіус зародку, здатного
до зростання при певних температурних
умовах.Якщо зародок досягає цього
радіусу, то це свідчить про те,що цей
зародок буде зростати і не розчиниться
у рідкомуМе. Справа від Rк
– при зростанні зародка енергія Гіббса
зменшується,а це є рушійною силою до
зростання зародка.Із↑степені
переохолодження ΔFv↑,
а ΔFs
змінюється незначно .тому при ↑Δt розмір
критичного зародку зменшується і буде
меншою робота, необхідна для його
утворення.,тому чим більше ступінь
переох.,(коли можуть зростати все менші
зародки,)то сильно зростає їх к-сть і
швидкість утв-ня цих зародків. Ближній
порядок повинен перетвор.в зародок,
якщоΔFv<ΔFповерхнева.
щоб зробити розрахунки,реал.зародок
замінюється сферою, який пропорційний
йому за об’ємом.ΔF=−ΔFv+ΔFповерхні=
3.Критичний
радіус зародка кристалізації—це
мінімальний радіус зародку, здатного
до зростання при певних температурних
умовах.Якщо зародок досягає цього
радіусу, то це свідчить про те,що цей
зародок буде зростати і не розчиниться
у рідкомуМе. Справа від Rк
– при зростанні зародка енергія Гіббса
зменшується,а це є рушійною силою до
зростання зародка.Із↑степені
переохолодження ΔFv↑,
а ΔFs
змінюється незначно .тому при ↑Δt розмір
критичного зародку зменшується і буде
меншою робота, необхідна для його
утворення.,тому чим більше ступінь
переох.,(коли можуть зростати все менші
зародки,)то сильно зростає їх к-сть і
швидкість утв-ня цих зародків. Ближній
порядок повинен перетвор.в зародок,
якщоΔFv<ΔFповерхнева.
щоб зробити розрахунки,реал.зародок
замінюється сферою, який пропорційний
йому за об’ємом.ΔF=−ΔFv+ΔFповерхні=
=− α(t) πR34/3+ β(t) 4πR2 – формула для приросту енергії
d(ΔF)/dR=− α(t)4πR2+ β(t)8πR=0
Rкрит=2 β(t)/ α(t).–Критичний радіус
14.Модифікування.це спеціальне введення в рідкий Ме компонента.(модифікаторів)з метою прискорення кристалізації .Принцип:щоб здійснювалося спонтанне утв-ня зародків, треба високочистий Ме і високі степені переохолодження.Якщо ввести модифікатори, у яких кристалічна гратка така,як і в основному Ме,то вони грають роль готових центрів кристалізації..Структурна схожість між поверхнями спряження зародку і частинки модифікатора призводить до зменшення розміру критичного радіусу зародка,роботи його утв-ня і затвердіння рідини почин.при менших переохолодженнях.Чим більше модифікаторів, тим більш дисперсна сис-ма.Модифікатори майже не змінюють хімічного складу сплава.Є ізоморфне модифікування(по вище описаному механізму) і ПАР(поверхнево активні речовини,які зменшують поверхневу енергію, тоді кристалізація прискорюється і критичний зародок зменшується).ПІнактивніР(збільшують поверхневу енергію)
1![]() 6.Алотропія.Вторинна
кристал.
Алотропія-
явище,коли кристалічна будова змінюється
в залежності відТ. Виникає в результаті
того,що при утв-ні нової модифікації
зменшується енергія Гіббса.При умові
рівноваги(крит.точка) поліморфне
перетвор.протікає при постійній Т з
виділенням прихованого тепла.Втор
крист.не
відрізняється від первинної.Потрібне
деяке переохолодження для різниці
енергійГ. між вихідною і новою
модифікаціями.Але тут часто ця різниця
більша,тому кристалізація йтиме
швидше.Зародки утв-ся на межах зерен,які
зростають завдяки хаотичним,взаємнозв’язаним
переходам атомів через границю зерен.Це
перетворення супроводжується
скачкоподібним зміненням всіх властивостей
Ме і сплава(теплоємкості,V,магн.власт,мех,хім...).
6.Алотропія.Вторинна
кристал.
Алотропія-
явище,коли кристалічна будова змінюється
в залежності відТ. Виникає в результаті
того,що при утв-ні нової модифікації
зменшується енергія Гіббса.При умові
рівноваги(крит.точка) поліморфне
перетвор.протікає при постійній Т з
виділенням прихованого тепла.Втор
крист.не
відрізняється від первинної.Потрібне
деяке переохолодження для різниці
енергійГ. між вихідною і новою
модифікаціями.Але тут часто ця різниця
більша,тому кристалізація йтиме
швидше.Зародки утв-ся на межах зерен,які
зростають завдяки хаотичним,взаємнозв’язаним
переходам атомів через границю зерен.Це
перетворення супроводжується
скачкоподібним зміненням всіх властивостей
Ме і сплава(теплоємкості,V,магн.власт,мех,хім...).
17.Принцип тонкост.Обробка відливок.Товщина стінки литої деталі повинна бути мін.можливою для даного методу лиття.Це одне з правил, коли мається на увазі конструювання деталей для лиття. 1)З-лиття в землю(наповнювач - земля: зв’язуючи матеріал пісок+глина,форми разові,номенклатура необмежена,мін.товщина стінки 5мм),
2)О-лиття в оболонки(наповнювач-високодисперсний пісок,пластмаса;форми разові,номенклатура необмежена,конфіг.середня,мін=4мм,
3)К-лиття в кокіль(із сталі, безліч відливок, постійна форма,номенкл.обмежена: лише сплави кол.Ме,форми дуже прості,мін=3),4)Прецізійне лиття(дуже точне): лиття по моделях,що виплавляються з воску або парафіну(тонкий шар вогнетривкого матеріалу(SiO2)→в гарячій воді витравляють парафін→залишають вогнетривкий шар→форми разові,номенклатура необмежена,найскладніші конфігурації,мін=1) і лиття під тиском (спеціальні машини,форми складні і міцні,які виробл.із спец.сталі,форма постійна, складна,масивна,номенкл. дуже обмежена(Ме з низькою Т),мін=0,3мм).Якщо взяти стіночку і умовно розшарувати її,прикласти до тепловідводу, то всі шари знаходяться в різних умовах охолодження(зовнішні шари екранують внутрішні).
1-ий шар має найвищу шв.охолодження
(за умов великої шв.утв-ня зародків і малої швидкості їх зростання) →дисперсна структура (найв. мех. властивості) →фіз. зміст принципу тонкостінності: збільшення товщини стінки не веде до адекватного збільшення міцності конструкції.напр., якщо в сірому чавуні мін.=10 збільшити до 100мм,то міцність зменш.в4рази.Обробка різанням-віливом:не дає високої якості і точності,шорстка поверхня,самий якісний шар знищується,технологія шкідлива.
18.Фази складних речовин.Структура метал.сплаву залежить від взаємодії компонентів, які входять у складі сплаву.В залежності від характеру взаємодії компонентів розрізняють сплави: ), тверді розчини
(це тверда фаза, що має велику кількість компонентів і один тип кристалічної градки.(градка розчинника)
За структурою поділяються- 1)Тв заміщення (точковий дефект) 2)Тв занурення (атом розчин речовини попав у вузол розчинника Н С В N).За розчинність з обмеженою і не обмеженою розчинністю Необхідні умови т.в необмеженої розчинності Юм-Розері
1)крист.гратки всіх компонентів мають бути ізоморфні, 2)різниця в розмірах атомів не має перевищ.15%,компоненти мають належати до одної групи в табл.Мєндєлєєва,
хімічні сполуки(утв-ся між елементами,які відрізняються за будовою і властивостями,якщо сила взаємодії між різнорідними атомами більша, ніж між однорідними.Крист.гратки всіх компон.руйнуються і утв-ся нова гратка хім.сполуки з новими індивідульними властивостями,Власт- постійність Ткристалізації,,
механічні суміші утв-ся,коли компоненти не здатні до взаємного розчинення в твердому стані і не вступають в хімічну реакцію з утворенням з’єднання.
Проміжкові фаза Фаза змінного складу, немає постійної температури плавління.
20.ПравилоГіббса.(Діаграми фазової рівноваги хар-ють кінцевий або граничний стан складів,який залежить від зовн.умов і хар-ся числом і концентрацією утворених фаз).ПравилоГ. показує число ступенів свободи С(к-сть параметрів ТС,які можна вільно змінювати,не виводячи ТС з рівноваги,не змінюючи к-сті фаз).1)Зн. Кількість незалежних змінних: Хк=mk/∑(i=1,k)mi - концентрація k-го компоненту,тоді ∑Xk=∑mi/∑mi=1,тому загальна к-сть незалежних концентрацій=к-1 у одній фазі.Нехай к-сть фаз –φ,тоді загальна кількість незалежних концент в усіх ТС: (к-1)φ..2)Зн.загальну к-сть рів-нь,які поєднують незалежні змінні:N-к-сть компонента.В рівнов.стані: –dN1=dN2 (якщо фронт кристалізації рух.ліворуч).dF-зміна вільної енергії, μ=dF/dN-хім.потенціал. Отже, Якщо процес кристалізації має місце, то dNi(1)≠0,тоді μi(1)=μi(2). В умовах рівноваги хім.потенціал компонента в різних фазах однаковий. μ1(1)=μ1загальна к-сть рівнянь= (φ-1)к.
3) Зн.к-сть ступенів свободи С=(к—1)φ+n—(φ—1)к=к+n—φ. С=0-нонваріантна сис-ма, С=1-моноваріантна(можна змінювати 1 фактор,не виводячи сис-му з рівноваги).Ізотермічна кристалізація простої речовини пояснюється кількісно правиломГ.,а фізично-виділення прих.теплоти.
2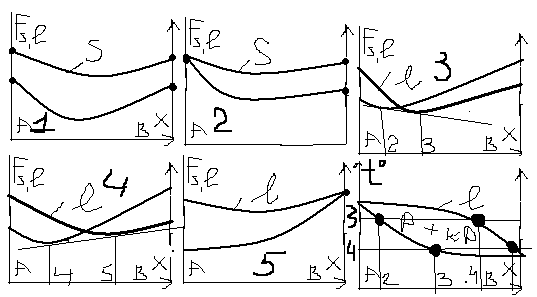 1.Аналітичні
методи побудови фазових діаграм.
Температуру робимо постійною,,фіксуємо
концентрацію, розраховуємо Fl
і Fs
знаходимо
точки і будуємо діаграму. 1-незалежно
від х за Т1 вільна енергія рідкого
стану<Fs:сис-ма
знах.в рідкому стані. 2-||-виход.з однієї
точки-це критична т.за 100%компонента А.
3-є точка перетину,в якій стан рідкий і
твердий водночас (хім.потенціали
рівні,при цьому проводиться загальна
дотична до 2-х різних ф-ій).6-сис-ма знах.в
рідкому стані вище ліквідус незалежно
від концентрації х. Нище солідус-кристали,а
між ними-двофазний
стан.
1.Аналітичні
методи побудови фазових діаграм.
Температуру робимо постійною,,фіксуємо
концентрацію, розраховуємо Fl
і Fs
знаходимо
точки і будуємо діаграму. 1-незалежно
від х за Т1 вільна енергія рідкого
стану<Fs:сис-ма
знах.в рідкому стані. 2-||-виход.з однієї
точки-це критична т.за 100%компонента А.
3-є точка перетину,в якій стан рідкий і
твердий водночас (хім.потенціали
рівні,при цьому проводиться загальна
дотична до 2-х різних ф-ій).6-сис-ма знах.в
рідкому стані вище ліквідус незалежно
від концентрації х. Нище солідус-кристали,а
між ними-двофазний
стан.
2![]() 2.Принцип
Курнакова.
1)Принц.Безперервності: коли зовн.фактори
змінюються безперервно і плавно,властивості
ТС змінюються також безперервно і
плавно, якщо існує фазова рівновага(не
змін.к-сть фаз).при порушенні фаз.
рівноваги виникає стрибок властивостей,
по якому можна знайти критичну
точку.2)Принц Відповідності: Будь-якій
фазовій рівновазі на фазовій діаграмі
відповідний геом.образ(Намал. фазове
поле:вище лік.і нище солідус, і між
ними).Експер.методи.1)термічний
аналіз(в 23),
2)Дилатонометричний
метод(викор.для
втор.кристалізації, стрибок похідної
дає критичну точку.при нагріванні Ме і
сплавів відбув.зміна об’ємів і
лін.розмірів-теплове розширення,Якщо
зміни обумовлені лише ↑енергії коливань
атомів.то при охолодженні розміри
повертаються до вихідних.Метод дозволяє
визначити критичні точки сплавів,температурні
інтервали існування фаз,вивчити процеси
розпаду тв.розчинів),3)диференційний
терм.аналіз(термопари
ввімкнено зустрічно.різниця Т-р=0 поки
не дійдемо до критичної точки.чутливий
метод,викор.для первинної і
втор.кристалізації),4)рентгеноструктурний
аналіз(24),5)Метод Лауе і Дебая(25,26).
2.Принцип
Курнакова.
1)Принц.Безперервності: коли зовн.фактори
змінюються безперервно і плавно,властивості
ТС змінюються також безперервно і
плавно, якщо існує фазова рівновага(не
змін.к-сть фаз).при порушенні фаз.
рівноваги виникає стрибок властивостей,
по якому можна знайти критичну
точку.2)Принц Відповідності: Будь-якій
фазовій рівновазі на фазовій діаграмі
відповідний геом.образ(Намал. фазове
поле:вище лік.і нище солідус, і між
ними).Експер.методи.1)термічний
аналіз(в 23),
2)Дилатонометричний
метод(викор.для
втор.кристалізації, стрибок похідної
дає критичну точку.при нагріванні Ме і
сплавів відбув.зміна об’ємів і
лін.розмірів-теплове розширення,Якщо
зміни обумовлені лише ↑енергії коливань
атомів.то при охолодженні розміри
повертаються до вихідних.Метод дозволяє
визначити критичні точки сплавів,температурні
інтервали існування фаз,вивчити процеси
розпаду тв.розчинів),3)диференційний
терм.аналіз(термопари
ввімкнено зустрічно.різниця Т-р=0 поки
не дійдемо до критичної точки.чутливий
метод,викор.для первинної і
втор.кристалізації),4)рентгеноструктурний
аналіз(24),5)Метод Лауе і Дебая(25,26).
23.Термічний аналіз. Базується на явищі теплового ефекту.Фазові перетворення в сплавах супроводжуються теплов.ефектом,в результаті на кривих охолодження сплавів при Т фазових перетворень спостерігаються точки перегину або Т-ні зупинки.Метод дозволяє визначити критичні точки. Вогнетривкий сосуд роб.із інертного матеріалу (не взаємодіє з аналізуючою речовиною),він нагрів.ел.нагрівачами,Т яких підтримується пристроєм програмного нагрівання.Ці процеси нагр.і охолодження роблять дуже повільно (будемо ближче до рівноважного стану,точніші точки).Виникає термоЕРС при нагріванні термопари – ефект Пельт’є.Для Т>12000 викор.пірометр (оптична трубка,де від джерела живлення і реостата нагр. вольфрамова проволока.Фіз.ефект: спектр випромінювання залежить відТ,чим більша Т, тим спектр зміщується до більшвисоких частот(коротких хвиль).Змін.реостат,щоб не було видно нитки: Т-ри однакові-спектри співпадають,похибки немає).
