
- •Часть 2. Теплота и молекулярная физика
- •Термодинамика и молекулярная физика Литература
- •Глава 1. Термодинамика §1. Основные понятия. Первый закон термодинамики
- •§2. Термодинамическая модель идеального газа. Теплоемкость
- •§3. Равновесные процессы
- •§4. Круговые процессы (циклы). Кпд цикла Карно
- •§5. Тепловые и холодильные машины. Энтропия. Второй закон термодинамики
- •§7. Основное уравнение кинетической теории газов
- •§8. Классическая теория теплоемкости газов
- •§9. Распределение молекул газа по скоростям. Функция распределения Максвелла
- •§10. Газ в поле силы тяжести. Распределение Больцмана. Газовые оболочки небесных тел
- •§11. Средняя длина свободного пробега молекул газа. Явления переноса
- •§12. Статистический смысл второго закона термодинамики.
- •Глава 3. Реальные газы §13. Уравнение Ван-дер-Ваальса
- •§14. Исследование уравнения Ван-дер-Ваальса. Критическое состояние в-ва
- •§15. Эффект Джоуля-Томсона.
- •Глава 4. Жидкости §16. Объемные свойства жидкостей
- •§ 17. Поверхностные свойства жидкостей
- •§18. Давление Лапласа. Капиллярные явления
- •§19. Жидкие растворы
- •Глава 5. Твердые тела §20. Кристаллическая структура твердых тел
- •§21. Тепловые свойства кристаллов
- •§22. Твердые полимеры
- •Глава 6. Фазовые переходы §23. Агрегатные состояния и фазы. Уравнение Клапейрона-Клаузиуса
- •§24. Испарение и конденсация
- •§25. Давление насыщенных паров над искривленной поверхностью жидкости
- •§26. Плавление и отвердевание
- •§27. Фазовые переходы в растворах
- •Оглавление
§2. Термодинамическая модель идеального газа. Теплоемкость
1. Законы разреженных газов. Из трех агрегатных состояний, в которых может находиться вещество, самым простым является газообразное. Первым газом, который люди стали воспринимать как особое состояние вещества, был атмосферный воздух. С воздухом проводились первые физические эксперименты, которые привели к открытию первых опытных газовых законов.
PVT=const=const. Роберт Бойль, 1662, Эдм Мариотт, 1676 (2.1)
Vp=const=V0(1 + t). Жозеф Гей-Люссак, 1802 (2.2)
pV=const=p0(1 + t). Жак Шарль, 1787 (2.3)
Здесь и - коэффициенты пропорциональности, V0 и p0 – объем и давление газа при t = 0C.
Позднее,
когда удалось получить “чистые” газы
кислород O2,
азот N2
и более сложные CO2,
CH4 и так далее, выяснилось, что
этим законам подчиняются практически
все газы при низких давлениях (менее
1 атмосферы). Поэтому перечисленные
законы называют законами разреженных
газов. В 1834 г. Бенуа Клапейрон
объединил эти три эмпирических закона
в одно уравнение.
![]() . Бенуа
Клапейрон, 1834 (2.4)
. Бенуа
Клапейрон, 1834 (2.4)
Позднее выяснилось, что значение константы пропорционально массе газа m и обратно пропорционально его молярной массе M. В 1874 г. Дмитрий Менделеев предложил представлять константу в виде произведения Rm/M, где R – постоянный для всех газов коэффициент, его называют универсальной газовой постоянной, R = 8,31 Дж/МольК. Отношение m/М = называют количеством вещества, его измеряют в молях.
![]() ,
или pV = RT. Уравнение
Клапейрона-Менделеева (2.5)
,
или pV = RT. Уравнение
Клапейрона-Менделеева (2.5)
2. Идеальный газ. С увеличением давления и с понижением температуры уравнение Клапейрона-Менделеева все хуже описывает свойства реальных газов. Поэтому тот воображаемый газ, который удовлетворяет уравнению Клапейрона-Менделеева на всем множестве положительных значений параметров p, V и T, договорились называть идеальным газом, а уравнение Клапейрона-Менделеева – уравнением состояния идеального газа.
Здесь не строится никаких гипотез относительно внутренней структуры идеального газа. Он рассматривается как термодинамическая система с известным количеством вещества в ней и обладающая такими свойствами, которые в макропараметрах p, V и T описываются уравнением (2.5).
3. Уравнение состояния смеси идеальных газов. Идеальные газы не взаимодействуют друг с другом. Поэтому если в сосуде имеется смесь идеальных газов, то каждый из них ведет себя так, как будто других газов в сосуде нет. Каждый идеальный газ занимает весь объем сосуда. Поэтому для каждого из газов можно записать уравнение состояния.
![]() (2.6)
(2.6)
Все газы в смеси находятся в термодинамическом равновесии, поэтому их температура T одна и та же.
Давления p1, p2, …, pi,…, pn создаваемые каждым газом в отдельности, называются парциальными (от лат. рars - часть).
Просуммировав уравнения получаем:
![]() . Уравнение
состояния смеси идеальных газов
(2.7)
. Уравнение
состояния смеси идеальных газов
(2.7)
В 1801 г. Джон Дальтон эмпирически установил, что сумма парциальных давлений газов равняется давлению смеси идеальных газов, измеряемому манометром.
![]() . Закон
Дальтона парциальных давлений смеси
газов (2.8)
. Закон
Дальтона парциальных давлений смеси
газов (2.8)
4. Изопроцессы (от греч. isos – равный, одинаковый) – это процессы, протекающие при постоянстве какого-либо параметра. В уравнение состояния входят три параметра p, V и T. Поэтому можно выделить 3 изопроцесса.
а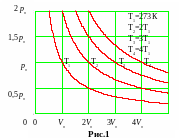 . Изотермический,
T = const.
Процесс совершается при постоянной
температуре. Уравнение состояния
упрощается и переходит в закон
Бойля-Мариотта, pV = RT = const.
. Изотермический,
T = const.
Процесс совершается при постоянной
температуре. Уравнение состояния
упрощается и переходит в закон
Бойля-Мариотта, pV = RT = const.
Кривые, иллюстрирующие изотермический процесс, называют изотермами. В системе координат p, V изотермы представляют собой гиперболы вида p = const/V. Чем выше температура газа T, тем выше на графике соответствующая ей изотерма (рис.1).
Способность
газа изменять свой объем V с изменением
давления p при постоянной температуре
T характеризуется изотермическим
коэффициентом сжимаемости .
Все коэффициенты относятся к единичному
объему, поэтому
![]() .
(2.9)
.
(2.9)
Знак ”T ” в формуле, используемый как индекс, означает постоянство этого параметра при вычислении производной.
Для
идеального газа V = const p.
Отсюда
![]() .
(2.10)
.
(2.10)
Сжимаемость идеального газа обратно пропорциональна давлению, под которым он находится. Знак “минус” показывает, что увеличение давления приводит к уменьшению объема и наоборот.
б . Изобарический,
p = const.
Процесс совершается при постоянном
давлении. Уравнение состояния переходит
в закон Гей-Люссака, V T = R/p = const,
или V = constT.
. Изобарический,
p = const.
Процесс совершается при постоянном
давлении. Уравнение состояния переходит
в закон Гей-Люссака, V T = R/p = const,
или V = constT.
Графики изобарических процессов называют изобарами. В системе координат V и T изобары – прямые линии, проходящие через начало координат. Чем выше давление, тем ниже соответствующая прямая (рис.2).
Способность газа изменять свой объем с изменением температуры при постоянном давлении характеризуется коэффициентом теплового расширения .
![]() .
(2.11)
.
(2.11)
Для
идеального газа V = constT.
Отсюда
![]() .
(2.12)
.
(2.12)
Обычно коэффициент теплового расширения выражается в точке плавления льда, где T = 273,15 K. Тогда = 1/273,15 K = 3,66103 K1 для всех идеальных газов.
в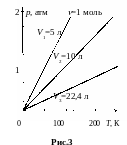 . Изохорический
(от греч. isos и chora – занимаемое место),
V = const.
Процесс совершается при постоянном
объеме. Уравнение состояния переходит
в закон Шарля, p/T = R/V = const,
или p = constT.
. Изохорический
(от греч. isos и chora – занимаемое место),
V = const.
Процесс совершается при постоянном
объеме. Уравнение состояния переходит
в закон Шарля, p/T = R/V = const,
или p = constT.
Графики изохорических процессов называют изохорами. В системе координат p, V изохоры – прямые линии, проходящие через начало координат. Чем больше объем, занимаемый газом, тем ниже соответствующая изохора (рис.3).
С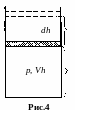 пособность
газа изменять свое давление с изменением
температуры при постоянном объеме
характеризуется термическим
коэффициентом давления
пособность
газа изменять свое давление с изменением
температуры при постоянном объеме
характеризуется термическим
коэффициентом давления
![]() .
(2.13)
.
(2.13)
В
идеальных газах
![]() .
(2.14)
.
(2.14)
5. Работа идеального газа при изобарическом расширении. Пусть газ заключен в цилиндре с подвижным поршнем (рис.4). Если газ нагревать, он расширяется. Пусть в процессе расширения газа поршень площадью S переместился на расстояние dh под действием силы F= pS. Работа перемещения поршня dA = Fdh = pSdh = pdV. (2.15)
Работа конечного
расширения газа
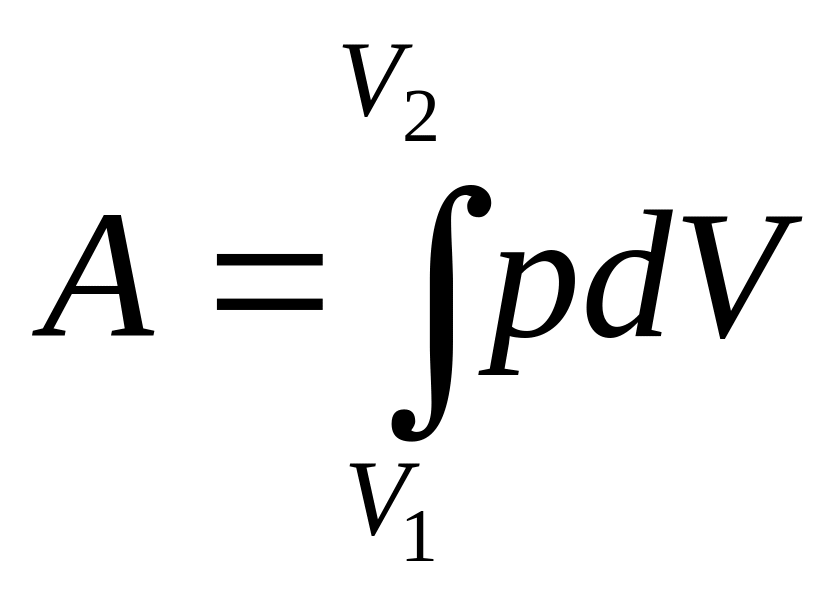 .
(2.16)
.
(2.16)
Здесь p есть функция объема V. При p = const A = p(V2 V1). (2.17)
С учетом формулы (2.15) первый закон термодинамики: dQ = dU + pdV. (2.18)
6. Теплоемкость
идеальных газов. Теплоемкостью тела
называют величину C, численно
равную количеству тепла, которое нужно
подвести к телу или отнять от него для
изменения его температуры на 1 К.
![]() .
(2.19)
.
(2.19)
Различают ещё молярную теплоемкость C = С и удельную теплоемкость с = С m, где и m – количество вещества в теле и его масса. Еденица измерения молярной теплоемкости – Дж (мольК), единица измерения удельной теплоемкости – Дж (кгК). Если M – молярная масса вещества, между ними такая связь: C = cM, (2.20)
Поскольку нагревание тел и особенно газов можно проводить как при постоянном объеме, так и при постоянном давлении, то различают изохорную и изобарную теплоемкости. Символы изохорной теплоемкости помечаются буквой V: Cv, Cv , cv, изобарной – буквой p: Cp, Cp, cp. Найдем теплоемкости Сv и Сp и связь между ними для идеального газа.
Изохорная
теплоемкость газа
![]() .
(2.21)
.
(2.21)
Изобарная
теплоемкость газа
![]() .
(2.22)
.
(2.22)
Изохорная теплоемкость тела (системы) определяется лишь изменением его внутренней энергии, Cv = dU dT. Изобарная больше на величину работы расширения тела. Для вычисления этой работы в случае идеального газа выразим объем газа V из уравнения Клапейрона-Менделеева, V = RT p. Продифференцируем по температуре.
![]() .
(2.23)
.
(2.23)
Подставив в (2.22) получаем Cp = Cv+R. (2.24)
Разделив уравнение на число молей , получаем связь между молярными теплоемкостями идеального газа. Cp = Cv+R. Юлиус Майер, 1842 (2.25)
Универсальная газовая постоянная R численно равна работе изобарного расширения одного моля идеального газа при нагревании на 1 К.
Измерения, выполненные с одноатомными разреженными газами (Ne, Ar, Kr, пары металлов), показали, что для них Cv = 12,5 Дж/(мольК) 0 3R/2, C p = 21 Дж/(мольК) 5R/2. Это хорошо согласуется с уравнением Майера. Несколько хуже обстоит дело с двухатомными разреженными газами (O2, N2, HCl). Хотя и для них уравнение Майера выполняется с точностью до 2-х знаков. Cv = 21 Дж/(мольК) 5R/2, C p = 30 Дж/(мольК) 7R/2.
В термодинамике широко применяется величина, равная отношению теплоемкостей
![]() (2.26)
(2.26)
и называемая показателем адиабаты. Ее опытное значение составляет с точностью до 2-х знаков для одноатомных газов = 1,7, для двухатомных газов = 1,4, для многоатомных газов = 1,3. Это хорошо согласуется с уравнением Майера.
