
- •1) Внутренняя энергия – функция состояния системы. 1 закон термодинамики.
- •2. Связь с термодинамическими параметрами
- •3) Энтальпия
- •4) Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процесс).
- •5) Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процесс).
- •6) Теплоемкость и ее зависимость от температуры
- •7) Закон Гесса – основной закон термохимии.
- •8) Уравнение Кирхгоффа в дифференциальной форме.
- •9) Уравнение Кирхгоффа в интегральной форме.
- •11. Работа обратимого и необратимого процессов
- •12.Цикл Карно
- •13. Энтропия обратимых процессов.
- •14. Энтропия не обратимых процессов.
- •15. Статический смысл энтропии.
- •16. Вычисление изменения энтропии в различных термодинамических процессах
- •17. Свободная энергия Геймгольца
- •18.Свободная энергая Гиббса
- •19 Уравнение Гибса-Гельмгольца
- •20 Понятие о химическом потенциале
- •21. Химический потенциал идеального и реального газов. Летучесть
- •22 Закон действующих масс. Константа равновесия
- •23 Изотерма химической реакции Ван Гоффа.
- •24 Уравнение изобары Вант Гоффа
- •25 Уравнение изохоры Вант Гоффа
- •26 Теорема Нернста 3 закон термодинамики
- •27 Постулат Планка
3) Энтальпия
Пусть термодинамическая система участвует в процессе при p=const где совершается механическая работа расширения газов.




Энтальпия так же как и внутренняя энергия является функцией состояния системы, следовательно, энтальпия является полным дифференциалом функции.
Энтальпия – это максимальное количество тепла, которое может выделиться в термодинамическом процессе при p=const. Абсолютное значение энтальпии определить невозможно.
Для определения изменения энтальпии необходимо найти взаимосвязь с термодинамическими параметрами.


Решим совместно уравнения 7 и 6

полученное уравнение 8 позволяет определять энтальпию по экспериментальным значениям термодинамических параметров.
4) Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процесс).
1. Изохорный V=const
dV=0

Решим совместно 1 и 2


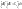

Вывод: сообщенная системе теплота идет на увеличение внутренней энергии системы, при отсутствии всех видов работ.
2. Изобарный p=const dp=0
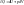


Воспользуемся уравнением Менделеева-Клайперона при n=1моль

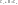 -
Уравнение Майера
-
Уравнение Майера

5) Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процесс).
1. Изотермический T=const dT=0
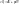
 (1’)
(1’)


Воспользуемся уравнением состояния идеального газа (уравнение Менделеева-Клайперона) при n=1моль


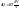


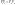
 для
1 моль газа
для
1 моль газа

Вывод: Вся теплота сообщенная системе идет на совершение системой работы.
2. Адиабатический процесс Q=0
 из
(1’)
из
(1’)

Воспользуемся уравнением Менделеева-Клайперона при n=1моль идеального газа.
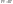
 разделим
на T
разделим
на T
 через
уравнение Майера
через
уравнение Майера
 разделим
на CV
разделим
на CV

 -
адиабатический коэффициент
-
адиабатический коэффициент
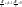



 (5)
(5)
полученные уравнения (уравнения Пуассона) описывают равновесную аддиабату, т.е. процесс протекает так быстро, что тепловая изоляция не нарушается и так медленно, что давление , температура и объем являются одинаковыми по всему объему системы.
6) Теплоемкость и ее зависимость от температуры
Установим связь между количеством тепла и термодинамическим параметром, разность величины которого будет отрицать передачу энергии в виде теплоты. это позволяет сделать нулевой запас термодинамики (принцип термического равновесия).
Если
система 1 находится в состоянии
термического равновесия с системами
2 и 3 то эти две последние системы тоже
находятся в состоянии термического
равновесия. Если 2 система находится в
состоянии термического равновесия,
следовательно, существует интенсивный
термодинамический параметр системы
T,
разность величин которого обуславливает
переход энергии в виде теплоты между
частями системы до тех пор пока не
установится термическое равновесие.
Передача энергии в виде тепла обуславливает
разность температур.
 ,
где С – теплоемкость.
,
где С – теплоемкость.

Теплоемкость – это количество тепла, которое необходимо сообщить телу, чтобы его температура повысилась на 1 градус. Различают Cуд - удельную теплоемкость (Дж/к) – это количество тепла необходимое для повышения температуры на 1 градус единицы массы вещества. Сn - молярная теплоемкость (Дж/к) – это количество тепла которое необходимо для нагревания на 1 градус 1 моль вещества.
Истинная и средняя теплоемкость.
CU
-
это отношение бесконечно малого
количество тепла к бесконечно малому
изменению температуры.

 -
это отношение конечного количества
тепла к конечному изменению температуры.
Наиболее в данном термодинамическом
процессе.
-
это отношение конечного количества
тепла к конечному изменению температуры.
Наиболее в данном термодинамическом
процессе.
 -
в данном термодинамическом процессе.
-
в данном термодинамическом процессе.

а) С≠f(T)
б) С=a+BT+dT2, где a, B и d – величина табличная имеет определенное значение, для какого-то конкретного вещества.
10. 2-й закон термодинамики. Понятия и определения
Первый закон термоди-ки устанавливает эквивалентность перехода различных форм энергии из одной части системы в другую, но первый закон термоди-ки не отвечает на следующие вопросы:
1В каком направлении будет протекать процесс
2В какой момент установится химическое равновесие ( о саотношении реагентов)
3Как будут влиять термодинамические параметры на установление химического равновесия
Процессы бывают:
4Самопроизвольные
Данные процессы протекают без затраты энергии из вне( например: процесс диффузии)
5Несамопроизвольные
Данные процессы совершаются только с затратами энергии из вне( например: выделение продуктов в процессе электролиза)
Процессы обратимые и необратимые
Необратимые-процессы после протекания которого систему и окружающую среду одновременно нельзя вернуть в исходное состояние.
Обратимые- процесс когда и систему и окружающую среду можно вернуть в исходное состояние.
2-й закон термодинамики: невозможно создать вечного двигателя второго рода, который бы производил работу только за счёт поглащения теплоты из окружающей среды, тоесть без передачи части теплоты холодильнику
