
- •Первый закон термодинамики. Внутренняя энергия-функция состояния системы.
- •Энтальпия.
- •4. Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процессы).
- •5. Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процессы).
- •6. Теплоемкость и ее зависимость от температуры.
- •7. Закон Гесса – основной закон термохимии.
- •8.Уравнение Кирхгоффа в дифференциальной форме.
- •9.Уравнение Киргоффа в интегральной форме.
- •10.Второй з-н термодинамики. Понятие и определение.
- •11. Работа обратимого и необратимого процесса.
- •12. Цикл Карно.
- •13. Энтропия обратимых процессов.
- •14. Энтропия необратимых процессов.
- •15. Смысл энтропии:
- •16.Вычисление энтропий в различных условиях.
- •17. Свободная энергия Гельмгольца.
- •18. Свободная энергия Гиббса.
- •19. Уравнения Гиббса- Гельмгольца.
- •20. Химический потенциал.
- •21. Химический потенциал идеального и реального газа. Летучесть(или фугетивность).
- •22. Закон действующих масс. Константа равновесия.
- •23. Изотерма химической реакции Вант-Гофа.
- •24. Уравнение изобары.
- •25. Уравнение изохоры.
- •1Первый закон термодинамики. Внутренняя энергия-функция состояния системы.
7. Закон Гесса – основной закон термохимии.
Термохимия - представляет собой первый з-н термодинамики к хим. процессам. Изучение закономерности протекания хим. процессов, а также тепловые эффекты реакции. Теоретической основой термохимии является 1-ый з-н термодинамики.
Сущность – разрыв старых связей и образование новых. Исходные в-ва и продукты характеризуются Uисх и Uкон . разница между этими энергиями опред. величину теплового эффекта реакции.
Тепловой эффект реакции – кол-во тепла выделяется или поглощается в процессе реакции при превращении 1 моль исходного в-ва.
Eсли
Q
выделяется –процесс экзотермический(+),
но
![]() H
и U
(-)
H
и U
(-)
Если Q поглощается – процесс эндотермический (-), но ΔH и U (+)
Определим при каких условиях тепловой эффект реакции является состоянием системы
P или V=const
Qv=ΔH Qv=ΔU
в системе соверш. только работа расширения
dA=pdV
температура исх. и конеч. в-в
Это составляет сущность з-на Гесса – основного з-на термохимии
Формулировка:
если из данных исходных в-в можно получить различными путями (продукты) то суммарная теплота процесса равна суммарной теплоте процесса на другом пути.
Тк абсолютное значение энтальпии Н неизвестна следовательно, необходимо выбрать какое-то состояние в-в при, когда Н можно принять =0. Это состояние в-в при стандартных условиях (Т=298, Р=1 атмосфер)
ΔfН0(298 К) кДж/моль
Стандартная теплота образования – теплота образования 1 моль данного соединения из простых в-в в ст. условиях.
1 следствие:
Тепловой эффект реакции равен суме ст. энтальпий образ. Продуктов минус ст. энтальпия образ. исходных в-в, с учетом их стехеометрических коэф.
![]()
для органики 2 следствие:
тепловой эффект реакции равен суме энтальпий сгорания исх в-в минус сума энтальпий сгорания продуктов с учетом коэф.
![]()
8.Уравнение Кирхгоффа в дифференциальной форме.






1 (1,3,2)
проведем реакцию при Т1, при этом выделяется кол-во тепла Q1. нагреем продукты реакции до Т2=Т1+dT . В результате поглощается теплота равная
dQ=C2dT
Ql=Q1-C2dT
ll (1,4,2)
нагреем исходные в-ва до температуры Т2=Т1+dT; в результате поглощается теплота равная dQ=C1dT. Проведем реакцию при данной температуре. В результате выделиться теплота Qll=Q1+dQ
тогда Q11=Q1+dQ-C1dT
В соответствии с з-н Гесса Qll=Ql
 ур-ние
Кирхгоффа в диф. форме
ур-ние
Кирхгоффа в диф. форме
температурный коэф. Реакции равен разности сумм теплоемкости исх. в-в и продуктов реакции
если
с увеличением температуры тепловой эффект увел.
с увеличением температуры тепловой эффект постоянен
с увеличением температуры тепловой эффект понижается
У равнение
Кирхгоффа может качественно указать
на характер изменения Н с изменением
теплоты
равнение
Кирхгоффа может качественно указать
на характер изменения Н с изменением
теплоты
9.Уравнение Киргоффа в интегральной форме.

Q0- стандартная теплота эффекта реакции
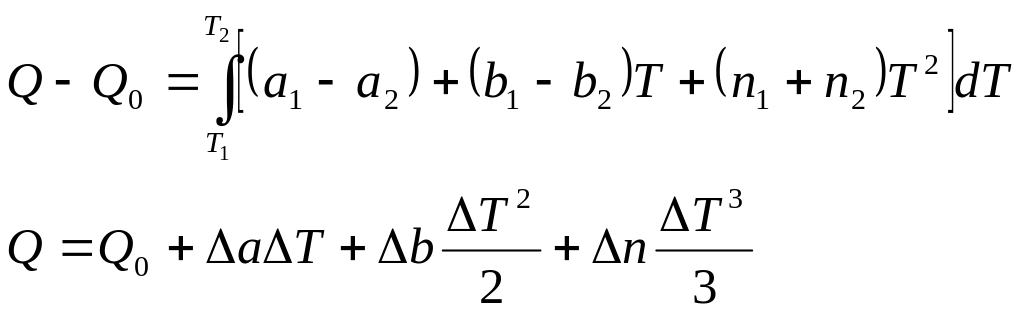
![]() ур-ние Кирхгоффа
в интегральной форме
ур-ние Кирхгоффа
в интегральной форме
![]()
Таким образом ур-ние Кирхгоффа в интегральной форме позволяет определить тепловой эффект реакции при любой температуре, если известен ее тепловой эффект при стандартных условиях (или при других условиях)
