
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
3.5. Метод термодинамических потенциалов
3.5.1. Определение
и физический смысл потенциалов.
Предположим, что находящаяся во внешней
среде система предоставлена самой себе
и над ней не производится никакой работы.
В ней будут происходить самопроизвольные
процессы, приводящие её в равновесное
состояние. В формуле (3.23) следует теперь
положить
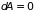 ,
что приводит к неравенству
,
что приводит к неравенству
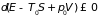 . (3.28)
. (3.28)
Иными словами, при
всех процессах в системе, взаимодействующей
со средой, величина
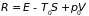 не увеличивается, а в равновесии достигает
минимума. Для замкнутой системы (
и
не увеличивается, а в равновесии достигает
минимума. Для замкнутой системы (
и
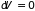 )
из (3.28) следует закон возрастания энтропии
.
)
из (3.28) следует закон возрастания энтропии
.
Максимальная
работа, производимая телом при
изотермо-изохорическом и изотермо-изобарическом
процессах была определена через убыль
функций
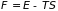 и
и
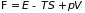 ,
которые получили название свободная
энергия и
основной
термодинамический потенциал
(потенциал
Гиббса),
соответственно. Функция
,
которые получили название свободная
энергия и
основной
термодинамический потенциал
(потенциал
Гиббса),
соответственно. Функция
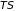 называется связанной
энергией. Их
изменение (
называется связанной
энергией. Их
изменение (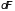 и
и
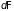 )
также, как и внутренней энергии (
)
в теплоизолированной системе, является
мерой работы в незамкнутых системах
при изотермо-изохорических и
изотермо-изобарических процессах. Для
незамкнутых систем неравенство (3.28) при
и
)
также, как и внутренней энергии (
)
в теплоизолированной системе, является
мерой работы в незамкнутых системах
при изотермо-изохорических и
изотермо-изобарических процессах. Для
незамкнутых систем неравенство (3.28) при
и
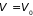 (или
)
принимает вид
(или
)
принимает вид
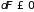 и
и
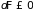 . (3.29)
. (3.29)
Таким образом,
изменение как свободной энергии, так и
потенциала Гиббса, подобно энтропии,
является критерием обратимости (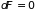 и
и
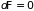 )
или необратимости (
)
или необратимости (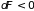 и
и
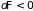 )
процессов и определяет их направление
в незамкнутых системах.
)
процессов и определяет их направление
в незамкнутых системах.
Примером необратимого изотермо-изохорического процесса может служить растворение какого-либо вещества (соли, сахара) в значительном объеме растворителя (воды) при постоянных температуре и объеме раствора. Поэтому, согласно (3.29), свободная энергия раствора будет меньше, чем сумма свободных энергий растворителя и вещества.
Метод термодинамических потенциалов (характеристических функций) был развит Гиббсом. Это аналитический метод, базирующийся на основном термодинамическом равенстве, в котором учитывается работа всех внешних сил
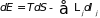 (3.30)
(3.30)
Идея метода состоит в том, что данное равенство позволяет для системы в различных условиях ввести некоторые термодинамические потенциалы, изменение которых в квазистатическом процессе является полным дифференциалом. Используя этот факт, составляются уравнения, необходимые для анализа того или иного явления.
Простые системы с постоянным числом частиц описываются уравнением (3.8):
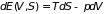 , (3.31)
, (3.31)
где объем
и энтропия
являются независимыми переменными.
Остальные параметры системы определяются,
если известна функция
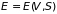 :
:
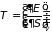 ;
;
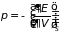 . (3.32)
. (3.32)
Внутренняя энергия
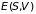 в качестве термодинамического потенциала
с практической точки зрения неудобна
тем, что одна из независимых переменных
– энтропия
не может быть измерена непосредственно.
Если независимыми являются не
и
,
а какие-либо другие величины, то энергия
не является характеристической функцией
(потенциалом) этих величин. При других
переменных вводятся иные потенциалы.
Так, вычитая из обеих частей уравнения
(3.31) дифференциал
в качестве термодинамического потенциала
с практической точки зрения неудобна
тем, что одна из независимых переменных
– энтропия
не может быть измерена непосредственно.
Если независимыми являются не
и
,
а какие-либо другие величины, то энергия
не является характеристической функцией
(потенциалом) этих величин. При других
переменных вводятся иные потенциалы.
Так, вычитая из обеих частей уравнения
(3.31) дифференциал
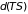 ,
получим
,
получим
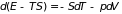 . (3.33)
. (3.33)
Такая операция
дифференциальной формы называется
преобразованием Лежандра. Учитывая,
что
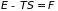 есть свободная энергия, определяем ее
как потенциал относительно переменных
объема и температуры
есть свободная энергия, определяем ее
как потенциал относительно переменных
объема и температуры
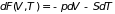 . (3.34)
. (3.34)
Прибавляя к обеим
частям этого уравнения дифференциал
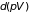 находим потенциал Гиббса по отношению
к переменным давления и температуры
находим потенциал Гиббса по отношению
к переменным давления и температуры
 . (3.35)
. (3.35)
Когда на систему
действуют, кроме механических сил
 ,
и другие немеханические силы (электрические,
магнитные и т.д.), то в (3.35) нужно добавить
их работу
,
и другие немеханические силы (электрические,
магнитные и т.д.), то в (3.35) нужно добавить
их работу
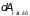 :
:
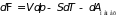 .
.
Отсюда следует,
что убыль потенциала Гиббса при
изотермо-изобарных процессах равна
работе системы против действующих на
нее немеханических сил. Применение
преобразования Лежандра с дифференциалом
к (3.31) приводит к еще одному потенциалу
– энтальпии
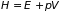 относительно энтропии
и давления
:
относительно энтропии
и давления
:
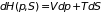 . (3.36)
. (3.36)
Физический
смысл энтальпии в том, что при изобарных
процессах её изменение равно поглощенному
количеству теплоты. По этой причине
потенциал
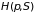 называют еще тепловой функцией или
теплосодержанием системы.
называют еще тепловой функцией или
теплосодержанием системы.
Следствием формул (3.34)-(3.36) являются равенства
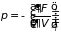 ;
;
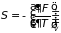 ; (3.37.а)
; (3.37.а)
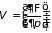 ;
;
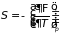 ; (3.37.б)
; (3.37.б)
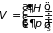 ;
;
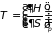 , (3.37.в)
, (3.37.в)
которые совместно с (3.32) определяют основные термодинамические параметры системы при различных процессах. Первое в (3.37.а) играет особую роль в термодинамике и получило название уравнение состояния.
Все термодинамические потенциалы являются, во-первых, аддитивными и однозначными функциями состояния, во-вторых, их убыль при соответствующих условиях определяет работу против действующих на нее сил. Кроме того, с помощью основного термодинамического неравенства они позволяют для необратимых процессов установить общие критерии термодинамического равновесия и устойчивости систем.
Для сложных систем,
состояние которых, кроме объема
(давления), зависит от других внешних
параметров
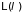 полученные выражения для дифференциалов
потенциалов усложняются за счет
добавления в их правые части соответствующих
слагаемых
полученные выражения для дифференциалов
потенциалов усложняются за счет
добавления в их правые части соответствующих
слагаемых
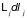 (3.30).
(3.30).
3.5.2. Дифференциальные
соотношения термодинамики. Уравнения
Гиббса-Гельмгольца. Поскольку
(3.31), (3.34)-(3.36) представляют полный
дифференциал соответствующих потенциалов,
то приравнивая смешанные производные
 ,
,
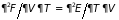 ,
…, получаем уравнения
,
…, получаем уравнения
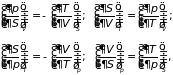 (3.38)
(3.38)
которые носят название дифференциальные соотношения термодинамики (или перекрестные соотношения Максвелла). Справедливы и обращенные равенства, например:
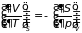 ,
,
 и т.д.
и т.д.
Уравнения (3.38) связывают два свойства системы. В частности, первое из них определяет изменение температуры системы при ее адиабатическом расширении через изменение давления при изохорном подводе тепла. Установление подобных связей и составляет содержание метода термодинамических потенциалов.
Дифференциальные соотношения термодинамики позволяют не только сопоставлять макроскопические характеристики материальных систем, но и заменять исследование одного свойства изучением другого, связанного с ним. Это особенно важно, когда нужно уйти от неизмеряемых (или трудно измеряемых) величин, например, энтропии.
Метод дифференциальных соотношений термодинамики представляет собой общее и эффективное средство исследования конкретных свойств самых разнообразных систем. Общность обусловлена тем, что дифференциальные соотношения являются следствием основного уравнения термодинамики, выражающего такой универсальный принцип, как закон сохранения энергии. Чрезвычайно важным является и то, что дифференциальные соотношения термодинамики отражают глубокую внутреннюю связь между разнородными явлениями, отражают единство различных форм движения материи.
Кроме
установленных соотношений между
различными свойствами системы (3.38),
существует и связь между термодинамическими
потенциалами. Так, из определения
свободной энергии (
),
энтальпии (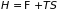 )
и формул (3.37.а), (3.37.б) для
нетрудно получить уравнения
)
и формул (3.37.а), (3.37.б) для
нетрудно получить уравнения
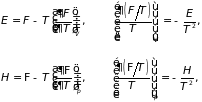 (3.39)
(3.39)
именуемые уравнениями Гиббса-Гельмгольца. Они показывают, что при известных температурных зависимостях внутренней энергии (или энтальпии) системы могут быть найдены её свободная энергия (или потенциал Гиббса):
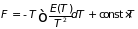 ,
,
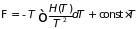 (3.40)
(3.40)
3.5.3. Потенциалы систем с переменным числом частиц. Энергия, энтропия и объем суть аддитивные функции. Поэтому основное термодинамическое равенство (3.31) может быть записано также для их удельных значений, отнесенных к единице массы или одной частицы:
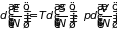 ,
,
где – число частиц в системе. Это равенство не зависит от того, по какой причине изменяются удельные значения. Считая переменными, кроме , , и число частиц, имеем
, (3.41)
где обозначено
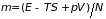 . (3.42)
. (3.42)
Из (3.41) следует
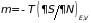 ;
;
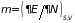 (3.43)
(3.43)
Последние равенства доказывает тождественность величины химическому (парциальному) потенциалу, входящему в большое каноническое распределение Гиббса. Формула (3.41) играет роль основного термодинамического равенства для систем с переменным числом частиц.
Если система
неоднородная, то наряду с изменением
общего числа частиц могут проходить
процессы взаимопревращения частиц
разного сорта. В этом случае в равенстве
(3.41) вместо последнего слагаемого
необходимо ввести сумму по всем сортам
частиц –
 ,
где
,
где
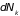 – изменение числа частиц
-го
сорта, а
– изменение числа частиц
-го
сорта, а
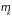 – соответствующий им химический
потенциал. Такие же слагаемые входят в
дифференциалы потенциалов
,
– соответствующий им химический
потенциал. Такие же слагаемые входят в
дифференциалы потенциалов
,
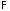 и
,
в частности,
и
,
в частности,
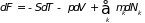 (3.44)
(3.44)
Химический потенциал из этих выражений, очевидно, равен
 . (3.45)
. (3.45)
Таким образом, можно получить дифференцированием любого из термодинамических потенциалов по числу частиц. Однако в каждом случае он будет выражен через различные независимые переменные. Простой формулой определяется связь химического потенциала с потенциалом Гиббса (3.42)
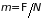 . (3.46)
. (3.46)
При анализе систем
с переменным числом частиц чаще всего
используют такой термодинамический
потенциал, дифференцирование которого
по соответствующим переменным позволяет
найти числа частиц в системе
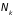 каждого сорта. Чтобы его найти проведем
преобразование Лежандра формулы (3.44)
каждого сорта. Чтобы его найти проведем
преобразование Лежандра формулы (3.44)
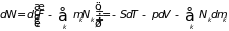 . (3.47)
. (3.47)
Здесь функция
 , (3.48)
, (3.48)
Называется большим термодинамическим потенциалом. Его знание позволяет из (3.47) определить
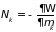 ;
;
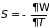 ;
;
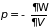 . (3.49)
. (3.49)
