
- •Методические указания и задания к домашним контрольным работам по химии
- •Содержание.
- •Введение.
- •Образец оформления титульного листа.
- •Образец оформления рабочей страницы.
- •Методические указания и задания к контрольной работе: Классы неорганических соединений.
- •1.Методы получения неорганических соединений.
- •2. Расчеты по уравнениям реакций и химическим формулам.
- •2. Оксиды.
- •3. Кислоты.
- •4. Основания.
- •5. Соли.
- •Кислота Анион
- •6. Амфолиты.
- •7. Комплексные соединения.
- •Комплексный ион (заряженный комплекс) – сложная частица, состоящая
- •8. Реакции ионного обмена.
- •9. Оформление и порядок сдачи контрольной работы.
- •2.Задания по контрольной работе «Классы неорганических соединений».
- •1. Методические указания.
- •1. Общие положения.
- •2. Термохимические расчёты.
- •В термохимических расчётах теплоты реакций, как правило, определяются для стандартных условий, для которых формула (2.1) приобретает вид:
- •3. Энергия Гиббса химической реакции.
- •4. Химическая кинетика.
- •5. Химическое равновесие.
- •6. Смещение химического равновесия.
- •2.Задания к контрольной работе «Закономерности химических процессов».
- •2.Строение электронных оболочек атомов. (Задачи №№ 0120)
- •2.1.Квантовые числа.
- •2.2. Принцип Паули. Электронная ёмкость атомной орбитали, энергетических подуровней и энергетических уровней.
- •2.3. Электронные формулы атомов.
- •2.4. Правило Хунда.
- •3. Периодическая система химических элементов д.И. Менделеева. (Задачи №№ 2140)
- •3.1. Связь между строением атомов и периодической системой химических элементов.
- •3.2. Периодическое изменение окислительно-восстановительных свойств элементов.
- •4. Химическая связь.
- •4.1. Метод валентных связей (метод вс). (Задачи №№ 4180)
- •4.2. Метод молекулярных орбиталей (метод мо). (Задачи №№ 81100)
- •2.Задания к контрольной работе «Строение вещества».
- •Методические указания и задания к контрольной работе по химии: «Растворы электролитов».
- •1. Растворы и их концентрация.
- •2. Растворы электролитов.
- •3. Реакции ионного обмена.
- •4. Гидролиз солей.
- •4.1. Гидролиз солей сильных оснований и слабых кислот.
- •4.2. Гидролиз солей слабых оснований и сильных кислот.
- •4.3. Гидролиз солей сильных оснований и сильных кислот.
- •2.Задания к контрольной работе «Растворы электролитов».
- •Методические указания и задания к контрольной работе по химии : «Окислительно-восстановительные процессы».
- •Основные понятия.
- •2. Составление уравнений окислительно-восстановительных реакций.
- •2.1. Метод электронных уравнений.
- •2.2. Метод электронно-ионных уравнений.
- •3. Гальванический элемент.
- •4. Электролиз.
- •2.Задания к контрольной работе «Окислительно-восстановительные процессы».
- •Термодинамические характеристики химических соединений и простых веществ.
- •Стандартные электродные потенциалы окислительно-восстановительных пар.
- •Растворимость солей и оснований в воде.
- •Варианты и номера задач контрольных заданий
4.2. Метод молекулярных орбиталей (метод мо). (Задачи №№ 81100)
Метод МО является более общим и универсальным, чем метод ВС, т.к. позволяет объяснить факты, необъяснимые с позиций метода ВС. В частности, метод МО успешно объясняет образование и свойства не только молекул, но и молекулярных ионов.
Суть метода МО заключается в том, что при соединении атомов или ионов исходные АО превращаются в новые – в молекулярные орбитали (МО), охватывающие все ядра атомов образующейся молекулы или молекулярного иона. При этом количество образующихся МО равно суммарному числу взаимодействующих АО связывающихся атомов, причём, половина из образующихся МО являются связывающими, другая половина – разрыхляющими. Связывающей МО соответствует более низкий, а разрыхляющей – более высокий энергетические уровени по сравнению с исходными АО.
Пример 4.2.1. Образование связывающей и разрыхляющей МО при взаимодействии 2-х АО равной энергии.
Составляем энергетическую схему исходных АО и образующихся МО.
Е

 Разрыхляющая
МО
Разрыхляющая
МО
Связывающая МО
Атомные орбитали могут взаимодействовать, образуя МО по - и -типу. При обозначении МО указывается её тип, подстрочным индексом обозначаются исходные АО, образующие МО, или направление взаимодействующих АО, если МО образуется из p-АО, и далее в строке указываются взаимодействующие АО конкретного подуровня; для обозначения разрыхляющих МО используется надстрочный символ «звёздочка». Например, обозначение s2s означает, что речь идёт о связывающей МО, образованной по -типу в результате взаимодействия s-АО 2s-подуровня; обозначение y*2py отвечает разрыхляющей МО, образованной по -типу взаимодействием p-АО 2p-подуровня, ориентированных в направлении координатной оси «у».
В молекуле или в молекулярном ионе молекулярные орбитали заполняются электронами так же, как и атомные орбитали в атоме, т.е. в соответствии с принципом Паули, принципом наименьшей энергии и правилом Хунда. По уровню энергии молекулярные орбитали, образующихся при взаимодействии АО первых двух электронных слоёв (К- и L-слоёв), располагаются в следующем порядке (в этом же порядке происходит заполнение МО электронами): s1s<s*1s<s2s<s*2s<s2px<y2py=z2pz<y*2py=z*2pz<s*2px.
Электроны связывающих и разрыхляющих МО оказывают противоположное влияние на устойчивость молекулы или молекулярного иона: электроны разрыхляющих МО нивелируют связывающее действие электронов , занимающих связывающие МО. В связи с этим в методе МО порядок (кратность) связи определяется по разности между числом связывающих (ЧСЭ) и числом разрыхляющих электронов (ЧРЭ) по формуле: Порядок связи=(ЧСЭ – ЧРЭ)/2.
Пример 4.2.1. Образование молекулы He2 и молекулярного иона He2+.
Молекула He2 образуется при взаимодействии атомных орбиталей K-электронного слоя двух атомов He[1s2], в результате чего образуются одна связывающая s1s-МО и одна разрыхляющая s*1s-МО, которые и заполняются электронами исходных атомов. Образование связи в молекуле He2 записывается следующим образом:He[1s2]+He[1s2]He2[(s1s)2(s1s)2].16
Определяем порядок связи: порядок связи=(2-2)/2=0 – молекула He2.не существует.
Молекулярный ион He2+ содержит на один электрон меньше, чем молекула He2. Соответственно этому его электронная формула записывается: He2+[(s1s)2(s*1s)1].
Порядок связи в ионе He2+: (2-1)/2=1/2 – порядок связи отличен от нуля, следовательно, молекулярный ион He2+, в отличие от молекулы He2,, может существовать.
Пример 4.2.2. Образование молекулы Li2 и молекулярных ионов Li2+ и Li22-.
Записываем схему образования связи в молекуле Li2: Li[1s22s1]+Li[1s22s1]Li2[(s1s)2(s*1s)2(s2s)2].
Порядок связи =(4-2)/2=1 – молекула Li2 существует, кратность связи равна 1.
Из электронной формулы молекулы видно, что взаимодействие 1s-атомных орбиталей насыщенного K-электронного слоя не приводит к образованию связи: число электронов в s1s- и в s*1s-МО одинаково. Связь образуется исключительно за счёт взаимодействия АО внешнего электронного слоя. Поэтому в электронных формулах молекул и молекулярных ионов такие МО принято обозначать индексами соответствующих электронных слоёв. В связи с этим в упрощённом варианте электронная формула молекулы Li2 записывается: Li2[KK(s2s)2].
Изобразим графически энергетическую схему исходных АО и образующихся МО в системе из двух атомов Li.
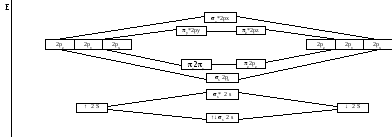
Молекулярный ион Li2+ содержит на один электрон меньше, чем молекула Li2. Его электронная формула записывается: Li2+[KK((s2s)1]. Порядок связи=(1-0)/2=1/2. Следовательно, молекулярный ион Li2+ может существовать.
Молекулярный ион Li22- по сравнению с молекулой Li2 имеет на 2 электрона больше, которые заполняют s*2s-МО. Определяем порядок связи: (2-2)/2=0 – молекулярный ион Li22- существовать не может.
Сопоставляя порядок связи в рассматриваемых частицах, приходим к выводу, что наиболее прочная связь образуется в молекуле Li2.
