
- •Министерство сельского хозяйства российской федерации
- •Ен ф.04. 03. Физическая и коллоидная химия Методические указания для самостоятельной работы студентов Направление подготовки дипломированного специалиста
- •110201 Агрономия
- •Введение
- •Химическая термодинамика и термохимия
- •1.1 Задачи
- •2. Химическая кинетика
- •. Задачи
- •3. Растворы
- •3.1. Задачи
- •4. Электрохимия
- •4.1. Задачи
- •Адсорбция. Коллоидная химия
- •5.1. Задачи
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ
ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ
УНИВЕРСИТЕТ»
Кафедра химии
Уфа – 2006
Рекомендовано к
изданию методической комиссией
факультета пищевых технологий
(протокол № ___ от
«____» ___________ 2006 г).
Составитель:
доцент Нигматуллин Н.Г.
Рецензент
доцент Халимов Р.Ф.
Ответственный
за выпуск заведующий кафедрой химии доцент
Нигматуллин Н.Г.
Физическая и
коллоидная химия, как и химия вообще,
является наукой экспериментальной.
Для овладения ею недостаточно только
теоретической подготовки, знания идей
и законов этой науки. Необходимо также
научиться количественно оценивать
параметры физико-химических процессов,
уметь вычислять их по итогам
экспериментальных данных и определять
физико-химические параметры веществ.
Для этого в литературе имеется ряд
методических пособий и методических
указаний по решению задач. К сожалению
почти все они предназначены для студентов
химических и химико-технологических
специальностей вузов и нет ни одного
сборника задач, предназначенного для
студентов сельскохозяйственных вузов.
Цель данного
методического пособия состоит в том,
чтобы восполнить этот имеющийся пробел
– научиться решать задачи физической
и коллоидной химии, имеющие
сельскохозяйственное содержание.
Термодинамический
метод полезен для прикладной химии
тем, что позволяет рассчитать для
химических реакций и других
физико-химических процессов: а) тепловой
эффект процесса (расчет ΔН), б)
принципиальную возможность протекания
процесса в нужном направлении (расчет
ΔG),
в) глубину протекания процесса, выход
продуктов и ее изменение в зависимости
от условий (расчет КР).
Формулы и уравнения
химической термодинамики и термохимии:
ΔН = ΔU + р ·
ΔV (1.1)
где ΔН –
изменение энтальпии системы в
изобарно-изотермическом процессе,
Дж/моль; ΔU – изменение внутренней
энергии системы, Дж/моль; р – давление
в системе, Па или Н/м2; ΔV –
изменение объема системы, м3.
ΔНР
= Σ (niΔHОобр)прод
- Σ (njΔHОобр)исх
(1.2)
где Σ – знак
суммирования; ni,
nj
– стехиометрические коэффициенты
веществ; ΔHОобр
– стандартные энтальпии образования
веществ, Дж/моль; ΔНР –
тепловой эффект химической реакции,
Дж/моль.
ΔSP
= Σ(niSO)прод
– Σ(njSO)исх
(1.3)
где ΔSP
– изменение энтропии системы, Дж/К·моль;
SO
– стандартные энтропии веществ,
Дж/К·моль;
ΔGP
= Σ(niΔGOобр)прод
– Σ(njGOобр)исх
(1.4)
где ΔGP
– изменение изобарно-изотермического
потенциала реакции (свободной энергии
Гиббса), Дж/моль; GOобр
– стандартные свободные энергии
образования веществ, дж/моль.
ΔGP
= ΔНР – Т · ΔSP
(1.5)
ΔGP
– изменение свободной энергии системы,
Дж/моль; ΔНР – изменение
энтальпии системы, дж/моль; Т –
температура, К; ΔSP
– изменение энтропии системы, Дж/(К·моль).
ΔGP
= -2,3 ·R ·T
·lgKP
(1.6)
ΔGP
– изменение свободной энергии системы,
Дж/моль; R – универсальная
газовая постоянная (R
= 8,31 Дж/моль ·К); Т- температура
равновесной системы, К; КР
– константа равновесия.
1. Определите
тепловой эффект разложения карбоната
кальция. Теплота образования (ΔНОобр)
СаСО3, СаО, СО2 из простых
веществ соответственно равны (кДж/моль):
-1208; -636; -394.
Вычислите теплоту
образования сахарозы С12Н22О11,
если тепловые эффекты реакций сгорания
веществ соответственно равны:
С12Н22О11(крист)
+ 12О2(газ) = 12СО2(газ) +
11Н2О(жидк)
ΔН1
= -1350 ккал/моль
С(тв) + О2(газ)
= СО2(газ) ΔН2
= -94 ккал/моль
2Н2(газ) +
О2(газ) = 2Н2О(жидк)
ΔН3 = -137
ккал/моль
Определите
тепловой эффект процесса фотосинтеза
исходя из следующих значений
ΔНОобр(кДж/моль): глюкоза –1268,
углекислый газ –394, вода –286, кислород
0.
На основании
анализа установлено, что сахарная
свекла на 1 га в день дает привес биомассы
100 кг. Считая, что это масса соответствует
массе образующейся в результате
фотосинтеза глюкозы, вычислите
количество накопленной солнечной
энергии в корнеплодах за один день
(ΔН0обр компонентов
можно взять из условий задачи № 3).
При аэробном
окислении глюкозы в клетке образуется
углекислый газ и вода, а при анаэробной
ферментации (метод получения энергии,
используемый некоторыми микроорганизмами)
основной реакцией является гликолиз,
при котором глюкоза разрушается до
молочной кислоты. Определить на сколько
процентов менее эффективна анаэробная
ферментация глюкозы. ΔН0обр(Дж/моль):
глюкоза –1268, молочная кислота -682,
вода -286, углекислый газ -394.
В пропановые
баллоны заправляют 30 литров жидкого
пропана (ρ = 500 кг/м3), который
находится под давлением 16 атм. Вычислять
необходимое количество баллонов с
пропаном, которые необходимы для
нагрева 10 м3 воды от 100С до
900С, если на нагрев расходуется
всего 25% от получаемого при сгорании
тепла. Теплоты образования С3Н8,
Н2О, СО2, О2 соответственно
равны (ккал/моль): -24,8; -57,7; -94,05; 0.
Определите
разность энтропий 1 г воды и 1 г льда,
находящихся в состоянии равновесия
при 00С и давлении 1 атм. Теплота
плавления льда равна 80 кал/г.
В каком из следующих
случаев реакция возможна при любых
температурах:
а) ΔН < 0, ΔS
> 0; б) ΔН < 0, ΔS
< 0; в) ΔН > 0, ΔS >
0.
9) Гидролизуется
ли мочевина в почвенном растворе при
20 ОС? провести полный термодинамический
анализ гидролиза мочевины исходя из
следующих данных:
Вещество ΔН0обр,
ккал/моль S0,
кал/(моль·К) (NH2)2CO -76,1 35,0 H2O -68,3 16,7 NH3 -19,2 26,6 CO2 -98,9 28,1
Устойчивы ли
стальные конструкции в влажном воздухе
при 250С? Известны справочные
данные: Вещество ΔН0обр,
кДж/моль S0,
Дж(моль·К) Fe 0 27,2 O2 0 205,0 H2O -241,6 188,6 Fe(OH)3
-823,5 96,1
11. Изменение
свободной энергии реакции гидролиза
глюкозы - 1 – фосфата при рН = 7 и 37
0С определили равным –20880 Дж/моль.
Вычислите константу равновесия реакции:
глюкоза - 1-фосфат
+ Н2О → глюкоза + Н3РО4.
12. Изменение
свободной энергии реакции гидролиза
глюкоза-6-фосфата при рН= 7 и 37 0С
составляет – 13780 Дж/моль. Используя
значение ΔGР
из задачи 11 вычислите значение ΔGР
следующей реакции:
глюкоза - 1-фосфат
→ глюкоза + глюкоза-6-фосфат
Определите
направление протекания реакции.
Химическая
кинетика изучает зависимость скорости
реакций от условий ее проведения, а
также механизмы химических реакций.
Скорости различных реакций сравнивают
путем сопоставления их констант
скоростей, определенных при одинаковых
условиях.
Расчетные формулы
для реакций первого порядка:
k
=
k –
константа скорости реакции, с-1;
С0 - концентрация реагента
до начала реакции, моль/л.; Сt
- концентрация реагента через время t
после начала реакции, моль/л.
τ – время
полупревращения реагента, с.
Расчетные формулы
для реакций второго порядка:
k
=
k –
константа скорости реакции, л/(моль·с);
(остальные параметры имеют тот же смысл,
как и в формуле (2.1)).
Влияние температуры
на скорость химических реакций
описывается следующими уравнениями:
v2
и v1 –
скорости данной реакции соответственно
при температурах t02
и t01;
γ – температурный
коэффициент реакции (коэффициент
Вант-Гоффа) (γ=2…4).
k
– константа скорости реакции; А –
константа, характерная для данной
реакции; ΔЕ – энергия активации
реакции, кДж/моль или ккал/моль; R
– универсальная газовая постоянная;
Т – температура реакции, К.
Е – энергия
активации реакции (Дж/моль или ккал/моль);
k2 и k1
– константы скорости реакции при
двух разных при температурах Т2
и Т1; R
– универсальная газовая постоянная
(8,31 Дж/(моль·К) или 1,99 кал/(моль·К)).
Кинетика
ферментативных реакций описывается
уравнением Михаэлиса-Ментен:
V0
– начальная скорость реакции, моль/(л·с);
[S] – концентрация
субстрата, моль/л; Vmax
– начальная скорость реакции, когда
все количество фермента входит в
комплекс с субстратом; КМ
– константа Михаэлиса-Ментен. Параметры
уравнения (2.8) определяются после его
преобразования (уравнение Лайнуивера-Берка):
Реакция
разложения муравьиной кислоты до воды
и угарного газа описывается кинетическим
уравнением первого порядка. Исходная
концентрация кислоты 0,04 моль/ л, время
полупревращения 0,56 часа. Определите
концентрацию кислоты через 3 часа после
начала реакции. Время
полупревращения метафоса в почве
составляет 5 суток. Определить время,
когда уровень концентрации метафоса
в верхнем слое почвы понизится до
уровня предельно допустимой концентрации
(ПДК= 0,02 мг/ кг почвы), если в момент
внесения концентрация его составила
0,4 мг/ кг почвы. Превращение метафоса
описывается кинетическим уравнением
первого порядка.
При средней
температуре почвы 5 0С снижение
концентрации гербицида от 400 мг/ кг
почвы до уровня ПДК (50 мг/ кг почвы)
происходит за 41 день. Определите через
сколько дней можно собирать урожай,
если средняя температура почвы за лето
составила 10 0С и начальная
концентрация его была 300 мг/ кг почвы
(температурный коэффициент реакции
равен 2).
Для реакции
разложения HI получены
следующие значения константы скорости
реакции:
377 0С 2,5 ∙
10-4 с-1
447 0С 7,0 ∙
10-3 с-1
Определите
значение энергии активации (R=8.31
Дж/ (мольК)).
Скорость некоторого
биохимического процесса происходит
со скоростью, значение γ – которого
составляет примерно 600. Рассчитайте
энергию активации этого процесса.
Определите во
сколько раз увеличится скорость прямой
реакции в равновесном процессе:
2SO2+
O2 ↔2SO3
если одновременно
увеличить давление в 5 раз и повысить
температуру на 100 (γ=2).
При ферментативном
гидролизе этилового спирта L-тирозина
в присутствии α-химотрипсина
получены зависимости начальной скорости
реакции от начальной концентрации
субстрата:
1/S,
1/моль 20 50 80 120 150 1/V0,
с/ммоль 120 170 200 260 300
Определите величину
Vmax
и константу Михаэлиса КМ
графическим способом.
Превращение
L-глутамата в α-
оксоглутарат катализируется ферментом
глутаматдегидрогеназа (ГДГ+):
L-глутамат
+ ГДГ+ → α-оксоглутарат + NH3
+ ГДГН + Н+
При разных
концентрациях субстрата получены
следующие значения начальных скоростей
реакции: [S],
моль/л 1,68 3,33 5,00 6,67 10,00 20,00 V0,
ммоль/(л мин) 0,172 0,250 0,286 0,303 0,334 0,384
Начальная
концентрация ГДГ+ во всех опытах
постоянна. Определите КМ
и Vmax
этой реакции путем построения графической
зависимости по уравнению Лайнуивера-Берка.
Широкая
распространенность растворов и их
особая роль во всех физиологических,
почвенных и многих технологических
процессов определяет важное значение
этого раздела физической химии для
агрономического образования. Поскольку
жизненные процессы в организмах, а
также разнообразные процессы в почвах
протекают в водной среде, то для
биологических и сельскохозяйственных
наук особый интерес представляют водные
растворы.
Формулы и уравнения
для решения задач:
ΔР = Р0
– Р; Р0 – давление паров
над растворителем; Р – давление
паров над раствором; n
– число молей растворенного вещества
в растворе; N –
число молей растворителя в растворе.
Δt0з
= К·Сμ (3.2)
Δt0з
= t0р-ль
- t0р-р;
t0р-ль
– температура замерзания растворителя,
0С; t0р-р
– температура замерзания раствора,
0С; К – криоскопическая
константа растворителя
Δt0к
= Э·Сμ (3.3)
Δt0к
= t0р-р
- t0р-ль
; Δt0к
– температура кипения раствора, 0С;
t0р-ль
– температура кипения растворителя,
0С; Э – эбулиоскопическая
константа растворителя
Р = R·CM·T
(3.4)
Р – осмотическое
давление раствора, атм.; R
– универсальная газовая постоянная
(R
= 0,082 л·атм/(моль·К)); СМ –
молярная концентрация, моль/л; Т –
температура раствора, К.
α = nион/n
(3.5)
α – степень
диссоциации слабого электролита; nион
– число молей растворенного вещества,
распавшегося на ионы; n
– общее число молей растворенного
вещества.
i
= 1+α(nи
- 1) (3.6)
i
– изотонический коэффициент раствора;
nи -
число ионов, образующихся при полной
диссоциации одной молекулы растворенного
вещества.
КД
– константа диссоциации слабого
электролита; α – степень диссоциации
электролита; СМ –
молярная концентрация раствора, моль/л.
рН =
рН- показатель
кислотности раствора;
рОН =
рОН – показатель
основности раствора;
CH+
· CОН-
= 10-14 (3.10)
рН + рОН = 14
(3.11)
рН – показатель
кислотности буферного раствора первого
типа;
рН = 14 – рКосн
-
рН – показатель
кислотности буферного раствора второго
типа; рКосн = - lgКосн;
Косн
-константа диссоциации слабого основания
в буферном растворе; Сс
– концентрация соли в буферном растворе,
моль/л; Сосн – концентрация
слабого основания в буферном растворе,
моль/л.
Какой раствор
глюкозы замерзает при более низкой
температуре - содержащий в 1л воды 18 г
глюкозы, или 18 г формальдегида, или 18
г хлорида натрия? Расположите эти
вещества в порядке понижения температуры
замерзания их растворов.
Вычислить
температуру замерзания 40%-ного водного
раствора этилового спирта (ρ = 0,937 г/мл).
Кровь замерзает
при температуре –0,56 ОС. Чему
равно ее осмотическое давление при 37
ОС?
Вычислите
осмотическое давление раствора,
полученного растворением 63 г глюкозы
в 1,4 л воды при 20 ОС.
Рассчитайте
концентрацию раствора NaCl,
изотоничного с клеточным соком картофеля
осмотическое давление которого равно
6,85 атм. при 20ОС. Изотонический
коэффициент раствора NaCl
равен 1,7.
Найти рН 0,1М
раствора уксусной кислоты (Кк
= 1,85·10-5).
Вычислить рН
0,01М раствора NH4OH,
если степень диссоциации равна 0,02.
Определить рН
ацетатного буфера, составленного из
10 мл 0,1М раствора уксусной кислоты и
100 мл 0,1М раствора ацетата натрия (Кк
= 1,85∙10-5).
Смешали 60 мл 0,05Н
раствора NH4Cl
с 20 мл 0,1Н NH4OH.
Чему равен рН буферной смеси? (Косн
= 6,3·10-5).
К 1 л ацетатного
буфера, содержащего 0,1 моль/л уксусной
кислоты и 0,1 моль/л ацетата натрия,
добавили 10 мл 1М раствора НСl.
Определить рН буферного раствора до
и после добавления НСl.
Как изменится рН при добавлении такого
количества НСl к 1 л воды.
В физической химии
рассматриваются преимущественно такие
электродвижущие силы, источником
возникновения которых является
химические реакции. Для выяснения
вопроса о причинах возникновения ЭДС
при химических реакциях прежде всего
необходимо разобраться в электронных
процессах, т.е. в процессах, происходящих
на границе между твердой фазой и
раствором.
Методы электрохимии
лежат в основе потенциометрического
определения рН, концентрации различных
катионов и анионов, а также при определении
окислительно-восстановительного
потенциала почв.
Формулы и уравнения
для решения задач:
χ – удельная
электропроводность раствора, Ом-1·см-1;
λ – эквивалентная
электропроводность, Ом-1·см2·моль-1;
СМ
– молярная концентрация раствора,
моль/л.
λ∞
= λ+ + λ-
(4.2)
λ – эквивалентная
электропроводность при бесконечном
разбавлении;
λ+
и λ- - электролитические
подвижности катиона и аниона.
α – степень
диссоциации электролита λ –
эквивалентная электропроводность
раствора; λ∞ - эквивалентная
электропроводность раствора данного
электролита при бесконечном разбавлении.
Е – потенциал
электрода, погруженного в раствор
собственной соли с концентрацией ионов
металла, равной СМе, В; n
– величина заряда иона металла; Е0
– стандартный электродный потенциал
материала электрода, В.
ε = Е2
– Е1 (4.5)
ε – электродвижущая
сила гальванического элемента, В;
Е1
и Е2 – потенциалы первого
и второго электрода, В.
Вычислить
коэффициент электропроводности 0,1Н
раствора KCl, если удельная
электропроводность равна 1,28·10-2
Ом-1·см-1 (λ∞ =
150).
Вычислить степень
и константу диссоциации слабого
электролита NH4OH
с концентрацией раствора 0,01 моль/л и
эквивалентной электропроводностью
96 Ом-1·см-1 (λ+
= 73,5; λ- = 197,6).
При тировании 25
мл раствора HCl 1,5Н раствором
NaOH получены следующие
результаты:
VNaOH,
мл 0 4,5 6,25 10,0
χ·103,
Ом-1см-1 8,72 2,15 2,90 5,52
Определите
графическим путем объем раствора NaOH,
использованного на нейтрализацию
раствора HCl. Вычислите
нормальность раствора HCl.
Вычислить потенциал
серебряной пластинки, погруженной в
1М раствор AgNO3 при
25 ОС, если кажущая степень
диссоциации соли 60% (Е0Ag
= +0,8В).
При какой
температуре ионов Cu2+
(моль/л) значение потенциала медного
электрода становится равным стандартному
потенциалу водородного электрода?
(Е0Cu
= +0,34В; Е0н = 0
В).
Вычислить ЭДС
гальванического элемента (+)Сu
| Cu+2 || Zn+2
| Zn (-) при
18 0С, если
концентрация ионов меди в растворе 0,1
моль/л, а ионов цинка – 0,01 моль/л (Е0Cu
= +0,34B; Е0Zn
= -0,76В)/
ЭДС концентрированного
элемента, составленного их двух цинковых
электродов, равна 0,33В. Концентрация
ионов цинка в одном из растворов равна
0.1 моль-экв/л. Определить концентрацию
ионов цинка во втором растворе.
Из наиболее важных
проблем в области почвоведения, изучение
которых тесно связано с коллоидной
химией и адсорбцией, является проблема
ионного обмена в почвенных коллоидах.
Ионообменные процессы достаточно
хорошо описываются уравнением
Никольского:
Г1
и Г2
- величина
удельной адсорбции первого и второго
ионов; С1
и С2
– концентрация этих ионов в растворе
после установления ионного равновесия,
моль/л; Кс
– коэффициент селективности, показывающий
характер распределения ионов между
адсорбентом и раствором.
Для описания
адсорбции слабых электролитов почвой
иногда применяют уравнение Фрейндлиха:
Г = К
Г – величина
удельной адсорбции слабого электролита,
ммоль/100г; К и 1/n
– константы уравнения Фрейндлиха; С
– равновесная концентрация слабого
электролита в растворе, ммоль/л.
Величину заряда
коллоидных частиц вычисляют по опытным
данным процесса электрофореза:
ς –
электрокинетический потенциал частиц
золя, мВ; μ
– вязкость пуазы; υ
– скорость перемещения частиц, см/с; Н
– градиент
потенциала внешнего поля, В/см;
D
–
диэлектрическая проницаемость среды.
Сколько органической
кислоты может быть поглощено почвой,
если в почвенном растворе установилась
равновесная концентрация 2,7 моль/л.
Константу уравнения Фрейндлиха равны:
К=4,5; 1/n = 0,4.
С помощью уравнения
Никольского покажите, что промывка
засоленных почв приводит к снижению
опасности их осолонцевания.
Укажите электролиты,
которые могут служить стабилизатором
для H2SiO3,
находящейся в водной среде.
Напишите формулы
мицелл, полученных путем смешения
равных объемов растворов электролитов:
а) 0,01Н KCl и 0,001Н AgNO3;
б) 0,01Н BaCl2 и 0,001Н
Na2SO4.
Который из коагулирующих электролитов
будет иметь меньший порог коагуляции
по отношению к каждому золю – СаСl2
или Na2S?
Пороги коагуляции
электролитов NaNO3,
Na2SO4,
MgCl2 и AlCl3
для исследуемого золя оказались
соответственно равными (ммоль-экв/л)
300; 295; 25 и 0,5. Определите знак заряда
гранулы золя.
Вычислите величину
– потенциала почвенных частиц,
находящихся в водной среде, если
скорость перемещения частиц при
электрофорезе была 0,8·10 см/с при
градиенте внешнего поля 1.2 В/см,
диэлектрической проницаемости воды
81 и вязкости ее 0,01 пуаз.
Расположите ниже
перечисленные электролиты NaCl,
Na2SO4,
CuCl2, Al2(SO4)3,
AlCl3, K3[Fe(CN)6]
в порядке увеличения их коагулирующей
силы для следующих коллоидов:
а) хлорида серебра,
стабилизированного нитратом серебра;
б) минеральный
почвенный коллоид.
8. В растворе
имеется смесь белков – казеин, глиадин
и глобулин. Значения ИЭТ для них
соответственно равны 4,6; 9,8; 5,4. К каким
электродам будут двигаться молекулы
белков при электрофорезе, если значение
рН раствора равно 7,5?
1 16Министерство сельского хозяйства российской федерации

Ен ф.04. 03. Физическая и коллоидная химия Методические указания для самостоятельной работы студентов Направление подготовки дипломированного специалиста
110201 Агрономия
Введение
Химическая термодинамика и термохимия
1.1 Задачи
2. Химическая кинетика
![]() (2.1)
(2.1)![]() (2.2)
(2.2)
![]() (2.3)
(2.3)![]() (2.4)
(2.4)
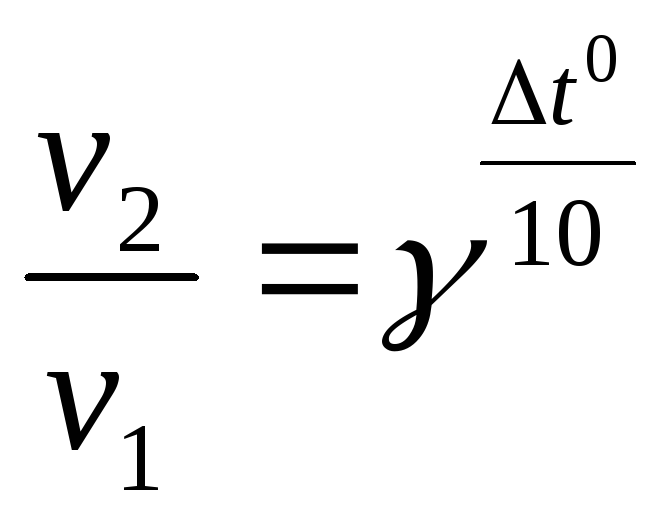 (уравнение
Вант-Гоффа) (2.5)
(уравнение
Вант-Гоффа) (2.5)![]() (уравнение
Аррениуса) (2.6)
(уравнение
Аррениуса) (2.6) (2.7)
(2.7)![]() (2.8)
(2.8)![]() (2.9)
(2.9)
. Задачи
3. Растворы
![]() (3.1)
(3.1)![]() ;
Сμ – моляльная концентрация
вещества в растворе, моль/кг.
;
Сμ – моляльная концентрация
вещества в растворе, моль/кг.![]() ;
Сμ – моляльная концентрация
раствора, моль/кг.
;
Сμ – моляльная концентрация
раствора, моль/кг.![]() (3.7)
(3.7)![]() (3.8)
(3.8)![]() -
концентрация ионов водорода в растворе,
моль/л.
-
концентрация ионов водорода в растворе,
моль/л.![]() (3.9)
(3.9)![]() -
концентрация гидроксид ионов в растворе,
моль/л.
-
концентрация гидроксид ионов в растворе,
моль/л.![]() (3.12)
(3.12)![]() ;
;
![]() –
константа диссоциации слабой кислоты
буферного раствора;
–
константа диссоциации слабой кислоты
буферного раствора;
![]() –
концентрация соли в буферном растворе,
моль/л; Ск -
концентрация слабой кислоты в буферном
растворе, моль/л.
–
концентрация соли в буферном растворе,
моль/л; Ск -
концентрация слабой кислоты в буферном
растворе, моль/л.![]() (3.13)
(3.13)3.1. Задачи
4. Электрохимия
![]() (4.1)
(4.1)![]() (4.3)
(4.3)![]() (4.4)
(4.4)4.1. Задачи
Адсорбция. Коллоидная химия
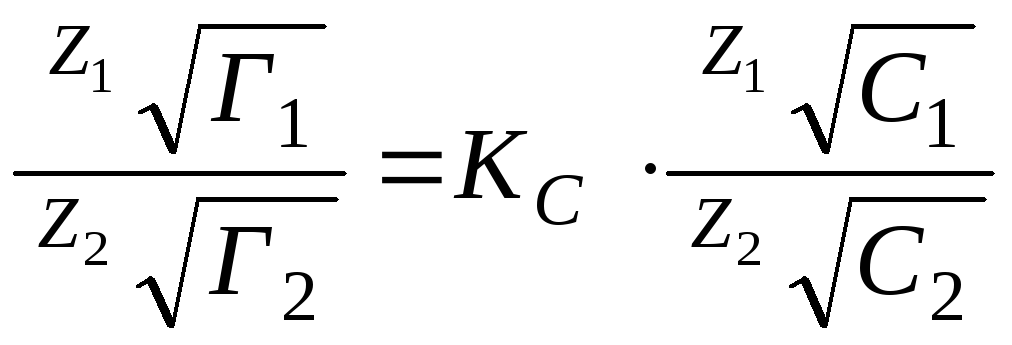 (5.1)
(5.1)![]() (5.2)
(5.2)![]() (5.3)
(5.3)5.1. Задачи
2 15
3 14
4 13
5 12
6 11
7 10
8 9
