
- •Содержание курса химии:
- •Основные понятия и законы химии.
- •Для простых веществ:
- •Масса эквивалента соли
- •Закон Авогадро.
- •Строение вещества.
- •Модель атома вещества по Бору.
- •Квантово механическая модель атома.
- •Основной принцип квантовой механики.
- •Квантовые числа.
- •Распределение электронов в атоме по энергетическим состояниям.
- •Принцип Паули.
- •Энергия ионизации, сродство к электрону и Электроотрицательность.
- •Строение молекул. Химическая связь.
- •Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
- •Свойства ковалентной связи:
- •Ионная связь.
- •Влияние природы химической связи на свойства веществ.
- •Металлическая связь, сходство и различие между металлической и ковалентной связями.
- •Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
- •Основные понятия и законы в термодинамике.
- •Стандартное состояние.
- •Термохимические законы и расчёты по ним:
- •Закон Гесса.
- •2. Закон Лавуазье-Лапласа.
- •Направленность химических реакций.
- •Кинетика химических реакций. Основные понятия химической кинетики.
- •Скорость реакции.
- •Смещение равновесий.
- •Особенности кинетики гетерогенных реакций.
- •Дисперсные системы.
- •Растворы.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Кислоты, основания, соли с точки зрения теории электрической диссоциации.
- •Слабые электролиты.
- •Ионное произведение воды. Водородный показатель.
- •Гидролиз солей.
- •Окислительно-восстановительные реакции.
- •Электрохимия.
- •Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Химические источники тока.
- •Стаканчиковый
- •Аккумуляторы.
- •Ряд напряжений металлов.
- •Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
- •Электролиз расплавов и растворов электролитов.
- •Явление поляризации при электролизе. Природа этого явления.
- •Последовательность разрядки ионов при электролизе на катоде.
- •Электролиз водных растворов электролитов.
- •Законы Фарадея.
- •Коррозия металла.
- •Защита металлов от коррозии.
Строение молекул. Химическая связь.
При взаимодействии атомов, при определенных условиях между ними может возникнуть химическая связь (х.с.), чем прочнее эта связь, тем больше энергии нужно приложить, чтобы ее разрушить, энергия разрыва связи – энергия связи больше нуля (всегда положительна). При образовании связей, энергии выделяется и образование энергии всегда меньше, чем сумма потенциальной энергии атомов, из которых молекула образована.
В современной теории химические связи строятся на основании квантовой механики – метод молекулярных орбиталей (м.м.о.).
Метод валентных схем. Основные положения метода валентных схем:
-
химическая связь образуется двумя электронами с противоположными спинами, причем образующаяся при этом пара принадлежит обоим атомам;
-
химическая связь есть результат перекрывания атомных орбиталей взаимодействующих атомов;
-
химическая связь тем прочнее, чем больше область перекрывания атомных орбиталей.
Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
Образование ковалентной неполярной связи.
H+H![]() H2
H2
![]()
![]()
+
Q

Ковалентная
связь бывает полярной и неполярной.
Ковалентная
неполярная связь
образуется между двумя одинаковыми
атомами (![]() ) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома.
Полярная ковалентная связь образуется
между двумя разными атомами. Различают
ковалентные связи
) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома.
Полярная ковалентная связь образуется
между двумя разными атомами. Различают
ковалентные связи
![]() и ковалентные связи
и ковалентные связи
![]() .
.
Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
![]() связь
– образуется при таком перекрывании
связь
– образуется при таком перекрывании
![]() атомных орбиталей, когда область
максимальной электронной области
находится над и под плоскостью, в которой
лежит прямая соединяющая центры атомов.
атомных орбиталей, когда область
максимальной электронной области
находится над и под плоскостью, в которой
лежит прямая соединяющая центры атомов.

![]()
+![]() Q
Q
![]()
H2O
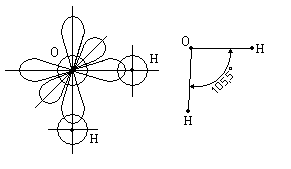
Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды.
Свойства ковалентной связи:
1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи.
2. Ковалентная связь бывает полярной и неполярной:
а)
Ковалентная неполярная связь образуется
между двумя одинаковыми атомами (![]() ) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома. Полярная ковалентная
связь образуется между двумя разными
атомами.
) и число таких связей в молекуле будет
определяться числом не спаренных
электронов во внешнем энергетическом
уровне атома. Полярная ковалентная
связь образуется между двумя разными
атомами.
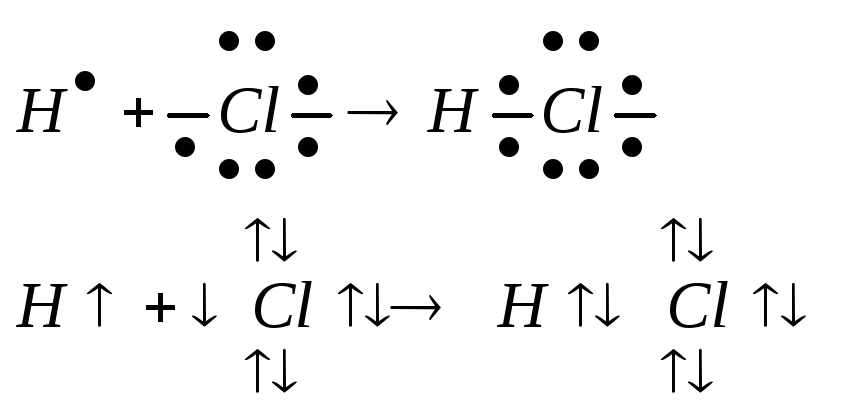
При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи.
Электроотрицательность – это условие вещества, характеризующее свойство данного атома притягивать к себе общую электронную пару при образовании химической связи. Электроотрицательность атомов в ПСХЭ с возрастом порядкового номера в периоде возрастает, в группе уменьшается (F – самый электроотрицательный атом).
В
молекулах с полярной ковалентной связью
электрические заряды распределены
неравномерно и за счет смещения общей
электронной пары в сторону
электроотрицательности атома на нем
появляются избыток отрицательных
зарядов, в то время как на другом атоме
недостаток. Такие молекулы с неравным
распределением зарядов называется
диполями. Молекулы с ковалентной полярной
связью являются диполями. Такие молекулы
надо характеризовать дипольным моментом
![]() ,
q
– заряд, l
– расстояние между атомами. Дипольный
момент измеряется в Дебаях (D),
1D
= 0,33·10-29Кл·м.
,
q
– заряд, l
– расстояние между атомами. Дипольный
момент измеряется в Дебаях (D),
1D
= 0,33·10-29Кл·м.
-
Ковалентные связи поляризуются. Дипольные моменты поляризованных молекул увеличивается во внешних электрических полях, а также если они попадают в окружение других полярных молекул. Поляризация таких моментов может происходить вплоть до ионизации.
![]()
-
Ковалентные связи направлены, т.к. атомные орбитали за счет которых они образуются, определенным образом ориентированы в пространстве. Максимум перекрывания атомных орбиталей обеспечивается при их определенной взаимной ориентации. При этом атомные орбитали, находящиеся в общем владении двух атомов, будут находится под определенным углом друг к другу. Этот угол называется валентным.
-
Ковалентная связь насыщена, каждый из не спаренных электронов атома при ее образовании спаривается, поэтому ковалентная связь может быть кратной.
