
- •Содержание курса химии:
- •Основные понятия и законы химии.
- •Для простых веществ:
- •Масса эквивалента соли
- •Закон Авогадро.
- •Строение вещества.
- •Модель атома вещества по Бору.
- •Квантово механическая модель атома.
- •Основной принцип квантовой механики.
- •Квантовые числа.
- •Распределение электронов в атоме по энергетическим состояниям.
- •Принцип Паули.
- •Энергия ионизации, сродство к электрону и Электроотрицательность.
- •Строение молекул. Химическая связь.
- •Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
- •Свойства ковалентной связи:
- •Ионная связь.
- •Влияние природы химической связи на свойства веществ.
- •Металлическая связь, сходство и различие между металлической и ковалентной связями.
- •Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
- •Основные понятия и законы в термодинамике.
- •Стандартное состояние.
- •Термохимические законы и расчёты по ним:
- •Закон Гесса.
- •2. Закон Лавуазье-Лапласа.
- •Направленность химических реакций.
- •Кинетика химических реакций. Основные понятия химической кинетики.
- •Скорость реакции.
- •Смещение равновесий.
- •Особенности кинетики гетерогенных реакций.
- •Дисперсные системы.
- •Растворы.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Кислоты, основания, соли с точки зрения теории электрической диссоциации.
- •Слабые электролиты.
- •Ионное произведение воды. Водородный показатель.
- •Гидролиз солей.
- •Окислительно-восстановительные реакции.
- •Электрохимия.
- •Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Химические источники тока.
- •Стаканчиковый
- •Аккумуляторы.
- •Ряд напряжений металлов.
- •Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
- •Электролиз расплавов и растворов электролитов.
- •Явление поляризации при электролизе. Природа этого явления.
- •Последовательность разрядки ионов при электролизе на катоде.
- •Электролиз водных растворов электролитов.
- •Законы Фарадея.
- •Коррозия металла.
- •Защита металлов от коррозии.
Содержание курса химии:
-
Строение вещества:
-
строение атома;
-
строение молекулы;
-
ПСХЭ, как классификация атомов по их электронному строению;
-
-
Закономерности протекания химических реакций:
1. энергетика химических реакций (термохимия);
2. кинетика химических реакций;
3. дисперсные системы;
4. электрохимия
5. общее свойство металлов (физико-химический анализ).
Основные понятия и законы химии.
Химия – это наука о веществах и их превращениях.
Вещество – каждый отдельный вид материи, обладающий, при данных физических условиях, определенной совокупностью физических свойств.
Материя – объективная реальность, данная нам в наших ощущениях.
Закон постоянства вещества: каждое вещество имеет постоянный состав независимо от способа получения и местонахождения.
Состав вещества – это относительное содержание в нем атомов различного или одного видов.
Строение вещества – последовательность расположения в пространстве атомов различного или одного вида.
Строение вещества зависит от природы атомов его образующих.
Вещество:
-
Дискретно, т. е. делимо на отдельные части до уровня структурной единицы вещества – атомы, молекулы, ионы.
-
Непрерывно (т.к. оно дискретно), т. е. структурные единицы вещества постоянно взаимодействуют между собой, во всех частях свойства постоянны.
-
Вещество в природе рассеяно, т. е. присутствует в природе в виде смесей. Вещества в чистом виде выделяются из смесей специальными методами, хранятся в специальных устройствах и производятся как товарные продукты.
-
Вещество имеет постоянный состав (Закон постоянного состава вещества). Вещества состоят из атомов химических элементов и при соответствующих условиях могут находится в различных физических состояниях (твердом, жидком, плазменном).
Атом – наименьшая частица элемента, обладающая его химическими свойствами и не делимая при химических реакциях.
Химический элемент – это вид атома, характеризирующийся различным зарядом ядра (всего 107 видов атомов).
Превращение веществ – это процессы, в ходе которых из одних веществ образуются другие. Эти процессы называются – химической реакцией. Атомы, объединяясь, друг с другом, образуют молекулу.
Молекула – наименьшая частица вещества, обладающая его основными химическими свойствами и способная к самостоятельному существованию.
Химические свойства – его способность атомов определенным образом взаимодействовать с другими атомами с образованием молекул веществ.
Размер атомов и молекул – объем и пространство, которое занимает атом. Размеры атомов и их массы чрезвычайно малы, например ma(H) = 1,66·10–27 кг.
Масса атомов – физическая величена являющаяся мерой его инерционных энергетических сил.
![]()
Относительная атомная масса (Ar) – безразмерная величина равная отношению массы атома к 1/12 массы углерода.

Относительная молекулярная масса (Mr) (величина безразмерная).
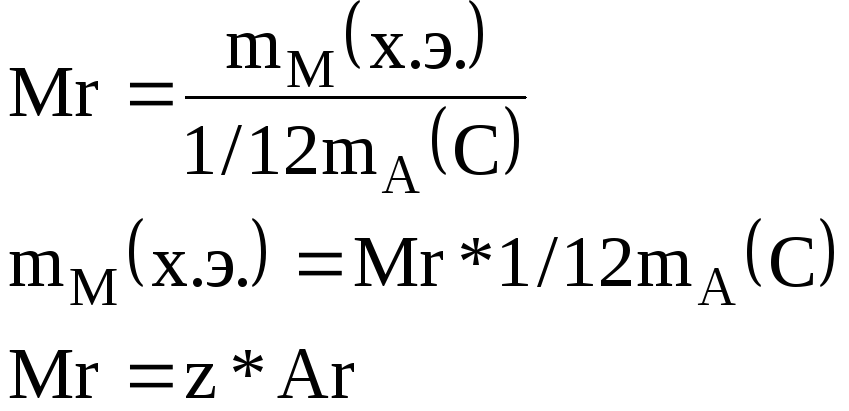
![]()
Количество
вещества (![]() (В))
(В))![]() - физическая величена пропорциональная
числу структурных единиц вещества.
- физическая величена пропорциональная
числу структурных единиц вещества.
![]() ,
если
,
если
![]() ,
то
,
то
![]()
Постоянное Авогадро – это число структурных единиц в одном моль вещества.
![]()
Моль
– такое количество вещества, в котором
содержится столько структурных единиц
(атомов, молекул, ионов, электронов),
сколько атомов содержится в 12 г углерода
(С), т.е. 6,02*10![]()
![]()
Молярная
масса вещества (M,
г/моль) –
это масса 1 моль вещества или
![]() структурных единиц вещества.
структурных единиц вещества.
![]()
Численно молярная масса вещества для веществ состоящих из атомов равна его атомной массе веществ, состоящих из молекул его молекулярной массе.
Массу и объём данной порции вещества можно измерить.
Количество вещества можно рассчитать, если известна формула вещества.
![]()
Зная формулу вещества и пользуясь периодической таблицей Д.И. Менделеева можно рассчитать молекулярную и молярную массы вещества.
Закон сохранения массы вещества.
Закон сохранения массы вещества справедлив только для систем, движущихся со скоростью меньшей скорости света.
Масса вещества до реакции равна массе веществ после реакции, потому что количество вещества до реакции равно числу молекул после реакции.
![]()
![]()


стехиометрические коэффициенты
Учитывая, что в реакции принимают участие атомы, молекулы из одних превращаются в другие, но атомы не превращаются в другие.
Закон эквивалентов.
![]()
Вещества взаимодействуют в эквивалентных количествах.
Эквивалент вещества – это реальная или условная частица вещества в z раз меньшая, чем соответствующая веществу структурная единица.
Эквивалентное
количество вещества
(![]() ,
моль) – это такое количество вещества,
которое в химических реакциях
взаимодействует с 1 моль атомов, ионов
или электронов водорода.
,
моль) – это такое количество вещества,
которое в химических реакциях
взаимодействует с 1 моль атомов, ионов
или электронов водорода.
![]()
![]()
Эквивалентная
масса вещества
(![]() )
– это масса 1 моль эквивалента вещества.
)
– это масса 1 моль эквивалента вещества.

 ,
где z=n
– валентность элемента
,
где z=n
– валентность элемента
Эквивалентные массы и объемы простых и сложных веществ.
