
- •Общие вопросы автоматизации измерений
- •Механизация и автоматизация лабораторий
- •Дискретные анализаторы
- •Непрерывные анализаторы
- •Непрерывный проточный анализ (нпа)
- •Проточно-инжекционный анализ (пиа)
- •Центрифужные анализаторы
- •Элементные анализаторы
- •Лабораторные роботы
- •Химические сенсоры
- •Потенциометрические сенсоры
- •Газочувствительные сенсоры
- •Биокаталитические мембранные сенсоры
- •Амперометрические сенсоры
- •Кондуктометрические сенсоры
- •Оптические сенсоры первого поколения
- •Сенсоры с системами распознавания
- •Оптроды третьего поколения
- •Термические (калориметрические) сенсоры
- •Гравиметрические сенсоры
- •Многоканальные сенсоры
- •Автоматизированный контроль производственных процессов
- •Анализ на основе неселективных характеристик
- •7.4. Литература
- •Иммунный анализ
- •Введение
- •Варианты анализа
- •Конкурентный анализ
- •Сандвичевый анализ
- •Варианты устройства
- •Эффекты поверхностной иммобилизации
- •Физические методы разделения связанной и свободной метки
- •Адсорбция на твердых частицах
- •Метки Радиоактивные метки
- •Гаптены и полипептиды
- •Частицы, рассеивающие свет, в качестве меток
- •Флуоресцентные и хемилюминесцентные метки
- •Ферментные метки
- •7.9.4. Мешающие влияния
- •Эффективная концентрация определяемого вещества
- •Эффективность связывания антител
- •D Биосенсоры—это аналитические устройства.
- •Биораспознающий компонент и преобразователь
- •Создание биологической поверхности
- •Методы иммобилизации
- •Подготовка биопреобразования Амперометрические сенсоры
- •Потенциометрические сенсоры
- •Оптические сенсоры
- •Оптическое детектирование без метки
- •7.8.4. Заключение
- •Обработка сигналов: цифровая фильтрация, преобразование данных
- •Отношение сигнал-шум
- •Аналоговые и цифровые фильтры
- •Фильтрация при помощи скользящего среднего
- •Полиномиальное сглаживание: фильтр Савицкого-Голея
- •Дифференцирование и интегрирование данных
- •4.3 Фильтрация данных с предварительным преобразованием сигнала
- •Фурье-преобразование
- •Дискретное фурье-преобразование
- •Обратное фурье-преобразование
- •Фильтрация данных при помощи фурье-преобразования
- •Литература.
-
Флуоресцентные и хемилюминесцентные метки
Флуоресцентные метки обычно дают лучшую чувствительность, чем колориметрические, потому что длины волн возбуждения и детектирования различны.
Принципы работы с этими оптическими метками во многом те же, что и с радиоактивными метками, за исключением того, что метод детектирования включает спектрофотометрическое измерение. Однако большинство прямых методов с колориметрической меткой, когда длины волн возбуждения и детектирования совпадают, редко достигают высокой чувствительности в иммунном анализе. Но можно получить улучшение на порядок величины, разделив эти длины волн. Существует два основных класса меток, пригодных для этого; флуорофоры и хемилюминесцентные реагенты.
Флуорофоры переходят на более высокий энергетический уровень при поглощении света в одном диапазоне длин волн; в возбужденном состоянии происходит быстрый безызлучательный переход в самое низкое возбужденное состояние и затем возврат в основное состояние с испусканием фотона с большей длиной волны (рис. 7.9-10,а, б); возбужденное состояние имеет типичное вре-
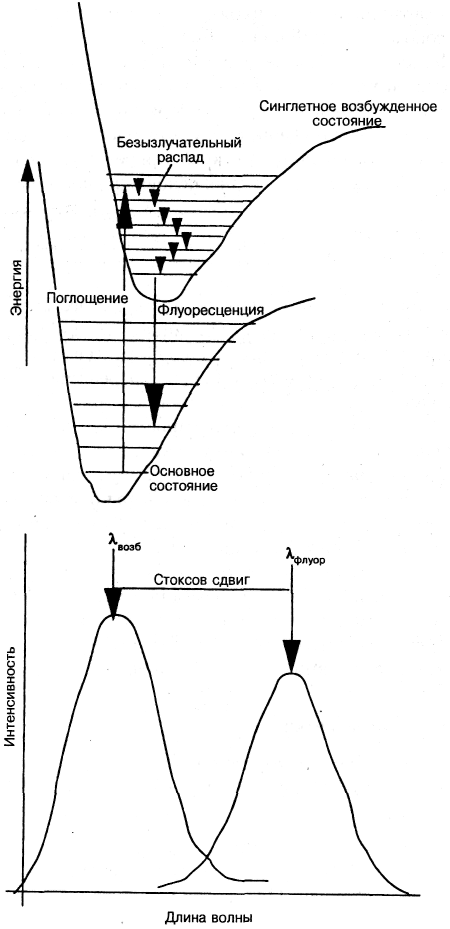
Рис. 7.9-10. Последовательность этапов, приводящая к флуоресценции.
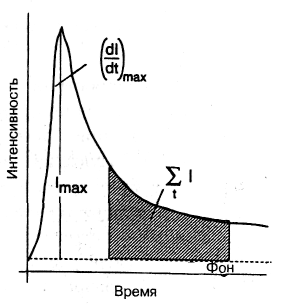
Рис. 7.9-11. Изменение интенсивности люминесценции во времени, показаны различные «окна» обработки сигнала.
частицам и возвращаясь в основное состояние. Такой процесс тушения может приводить к значительной потере сигнала. Кинетика тушения флуоресценции может быть описана конкуренцией двух параллельных процессов:
![]()
Флуоресценция:
![]()
Тушение:
![]()
и уменьшает выход
флуоресценции в соответствии с
соотношением
![]()
что приводит к потере флуоресценции в соответствии с выражением
где![]() —начальная
интенсивность флуоресценции, а
—начальная
интенсивность флуоресценции, а![]() —конечная
интенсивность после тушения.
—конечная
интенсивность после тушения.
Вслед за началом возбуждения интенсивность флуоресценции зависит от концентрации флуорофора в возбужденном состоянии и является функцией времени:
![]()
мя жизни < 10 8 с. Разница между двумя длинами волн известна как стоксов сдвиг, и чем больше сдвиг, тем проще становится отличать интенсивность испускаемой длины волны от интенсивности фона падающей длины волны. Когда квантовый выход (доля переизлученной энергии) высок, т. е. приближается к 1, метка будет наиболее чувствительной.
В течение времени жизни возбужденного состояния молекула может также участвовать в химической реакции, передавая, таким образом, энергию другим
где Ф —квантовый выход. Если возбуждение происходит в режиме короткого импульса, то профиль интенсивности будет иметь форму, показанную на рис. 7.9-11, где за начальным ростом интенсивности после облучения следует затухание по мере завершения возбуждения. Этот профиль открывает несколько различных возможностей для измерения. Если изобразить зависимость интенсивности флуоресценции различных молекул от времени на одном графике, каждая из флуоресцирующих молекул показывает разный результат для указанных параметров, поскольку времена затухания и квантовые выходы индивидуальны для каждого отдельного флуорофора.
«Идеальные» флуоресцентные метки должны иметь большой стоксов сдвиг и возбуждаться с помощью недорогих источников света.
Наиболее распространенные флуорофоры, используемые напрямую в качестве меток, традиционно являются производными флуоресцеина и родамина; в первом случае при присоединении метки в качестве активного интермеди-ата часто используют изотиоцианатное производное. Длины волн возбуждения/испускания этих меток хорошо подходят для большинства флуориметров (рис. 7.9-12), хотя их положение и малый стоксов сдвиг делают затруднительным нахождение недорогих диодных источников возбуждения, которые можно было бы использовать для создания небольшого специализированного прибора.
Непрерывно разрабатываются новые флуоресцентные зонды, чтобы покрыть все более широкий спектр и приспособиться к потребностям специфических длин волн. В табл. 7.9-3 суммированы некоторые из них. Весьма чувствительными флуорофорами являются гидроксильные производные кумарина (умбеллифероны), которые открывают широкие возможности для получения различных флуоресцентных свойств. Многие из производных этого ароматического фенола, такие, как фосфаты, гликозиды и др., не флуоресцируют, но флуоресцирующие частицы могут быть получены при их гидролизе; это свойство также можно использовать в иммунном анализе с меткой, как уже обсуждалось ранее.
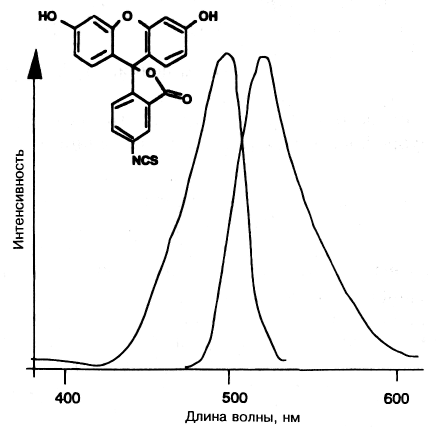
Рис.
7.9-12. Спектры
возбуждения и флуоресценции белка,
меченного изотиоциана-том флуоресцеина.
Таблица 7.9-3. Флуоресцентные свойства некоторых флуоресцентных меток, использ мых в иммунном анализе
|
Флуорофор |
"еозб> НМ |
^флуор) КА* |
Время затухания, НС |
Молярное поглощение, л/моль |
Квантовъ выход |
|
Флуоресцеин |
492 |
520 |
4,5 |
72000 |
0,85 |
|
Родамин С изотиоцианат |
550 |
585 |
3,0 |
103000 |
0,7 |
|
Лиссамин сульфоро- |
|
|
|
|
|
|
дамин С хлорид |
530; 565 |
595 |
1,0 |
|
|
|
Анилинонафталин- |
|
|
|
|
|
|
сульфокислота |
385 |
471 |
16 |
|
0,8 |
|
2-Метокси-2,4-дифенил- |
|
|
|
|
|
|
3(2Н)фуранон |
390 |
480 |
|
|
0,1 |
|
Метилумбеллиферон |
323 |
386 |
|
16000 |
|
|
Дансил хлорид |
340 |
480-520 |
14 |
|
0,3 |
|
Люцифер желтый |
430 |
540 |
3,3 |
13000 |
0,2 |
|
Эритрозин |
492 |
517 |
108 |
101000 |
0,01 |
|
Ru-(dipy)3 |
450 |
625 |
250-500 |
14000 |
0,028 |
|
Pd-Копропорфирин |
396 |
618 |
700000 |
200000 |
0,17 |
|
Пирены |
346 |
395 |
|
16000 |
|
|
Техас красный |
596 |
615 |
|
80000 |
0,3 |
|
Эозин |
520 |
545 |
|
101000 |
|
|
Флуорескамин |
394 |
475 |
7,0 |
|
0,1 |
|
Хлорофилл |
430-453 |
648-669 |
|
|
|
сильную флуоресценцию при 400 нм, которые меняют величину и положение при связывании с белком и/или подложкой. Эти мешающие соединения имеют относительно малые времена затухания, так что метод, пригодный для разделения сигналов метки и фона, должен использовать измерение флуоресценции с временным разрешением (см. рис. 7.9-11).
Для этой цели оказались полезными некоторые комплексы лантаноидов с определенными органическими лигандами, такие, как хелаты европия со сток-совым сдвигом более 200 нм и временами затухания свыше 500нс, в частности, потому, что возможный квантовый выход составляет 30-100%. Эти хелаты использовали разными способами; например, нефлуоресцирующие лиганды, образующие комплексы с европием, можно использовать как метку, а флуоресценция, возникающая при добавлении европия, возникает по окончании имму-нокомплексообразующей стадии анализа. Ион Еи3+ в растворе гидратирован восемью или девятью молекулами воды. В этом состоянии он проявляет только слабую флуоресценцию, но удаление этих молекул воды при комплексообразо-вании с органическими лигандами усиливает флуоресценцию Еи3+. В течение времени жизни возбужденного состояния молекула может также принимать участие в химической реакции, передавая, таким образом, энергию другим частицам и возвращаясь в основное состояние. Такой процесс тушения вызывает значительные потери сигнала.
Этот эффект тушения может также найти полезное применение в флуоресцентном иммунном анализе с передачей возбуждения. В принципе, не тре-

![]()
где Ф, и Ф0 — квантовые выходы донора в присутствии и в отсутствие акцептора, a hq — расстояние, на котором эффективность передачи составляет 50%.
Постоянно используемой парой акцептор—донор являются флуоресцеин и родамин, а получаемое 50%-ное уменьшение флуоресценции донора на ~ 50 Асравнимо с типичным внутримолекулярным расстоянием между рецепторами в IgG (порядка 100 А). Чтобы добиться максимальной близости между донором и акцептором, маркирование антитела следует проводить близко к месту связывания; однако такая направленная модификация антитела меткой затруднительна из-за недостатка уникальных групп в структуре белка. Следовательно, вводят несколько флуорофоров в случайном порядке, но слишком высокий уровень маркирования может привести к нерастворимости, поэтому типичным значением является 10-12 флуорофоров на одну молекулу IgG. Похожие рассуждения применяют и для донора, но в случае гаптена это соотношение может быть ограничено конъюгатом 1:1, а для белка высокая загрузка флуорофора приводит к уменьшению квантовой эффективности из-за самотушения. В принципе, регистрация испускания акцептора должна давать лучший сигнал, но поскольку некоторое прямое возбуждение акцептора может происходить и при длине волны возбуждения донора, это приводит к высокому фону. Выбором, следовательно, является контроль тушения флуоресценции донора.
Для того чтобы отличить сигнал от фона, а в некоторых случаях разделить сигналы связанного и несвязанного меченого антигена, можно использовать и другие молекулярные свойства. Например, когда антиген мал, меченный флуоресцеином аналог способен вращаться с высокой скоростью, а комплекс с антителом имеет значительно меньшую скорость вращения. При возбуждении популяции флуоресцентных молекул линейно поляризованным светом, вероятность возбуждения любой отдельной молекулы определяется ее ориентацией. Если «заморозить» молекулу в определенном положении, так что вращения не происходит, то в результате наблюдают флуоресценцию в плоскостях поперечного электрического (ТЕ, _L) и поперечного магнитного (ТМ, ||) полей по отдельности, а максимальное значение поляризации Р равно 0,5:
![]()
Усиление броуновского движения приводит к уменьшению поляризации. Этот принцип используют во флуоресцентной поляризации, поскольку вращение меченого флуоресцирующего антигена уменьшается при связывании с антителом (рис. 7.9-14). Таким образом, при низкой концентрации антигена в
Рис. 7.Р-13. Иммунный анализ путем передачи возбуждения флуоресценции.



Рис. 7.9-14. Принцип иммунного анализа по поляризации флуоресценции. Связывание антитела с антигеном, меченым флуорофором, увеличивает поляризацию флуоресценции.
пробе поляризация флуоресценции максимальна, поскольку максимальное количество меченого -антигена связано.
Для данного флуорофора изменение поляризации флуоресценции зависит от молекулярной массы антигена и природы комплекса с антителом; должно иметь место надлежащее изменение молекулярной массы, а этого нельзя добиться с большими антигенами. В целом, принято считать, что иммунный анализ по поляризации флуоресценции неприменим к антигенам с молекулярной массой выше 20000.
Основной проблемой гомогенного анализа, описанного выше, является влияние мешающих веществ, что не дает возможности реализовать теоретическую чувствительность. В табл. 7.9-4 проведено сравнение некоторых пределов обнаружения, полученных для отдельных вариантов с использованием флуоресцентной метки.
|
Таблица 7.9-4. Пределы обнаружения некоторых гаптенов, определяемых в различных вариантах иммунного анализа |
|||
|
Вариант метода |
Определяемое вещество |
Предел обнаружения, |
моль/л |
|
Субстратная метка Тушение Передача возбуждения Поляризация |
Теофиллин Гентамицин Кодеин Морфин Гентамицин Фенитоин |
3 • 1СГ8 2 • 1(Г6 1,5- 10~9 1,5 -ID"10 4, 5 -Ю-6 3,5- 1(Г6 |
|
П Хемилюминесцентные метки испускают свет за счет неустойчивого люминес-цирующего продукта реакции.
В отличие от флуорофоров, хемилюминесцентные реагенты не требуют для возбуждения падающего света, а испускают свет в результате химической реакции. Например, арилакридиновые эфиры, присоединенные к рецепторной молекуле через эфирную часть, могут разорвать эфирную связь за счет щелочного гидролиза на одной из стадий анализа с образованием неустойчивого люминесцирующего N-метилакридона, который разлагается с испусканием света (схема 7.9-2). Максимальная интенсивность для таких меток наблюдается обычно в течение 0,4с с периодом полузатухания 0,9с.
Схема
7.9-2. Хемилюминесцентная
реакция с арилакридиновым эфиром.
Это сравнимо с очень медленным испусканием (~ 25 с после инициирования) производных изолюминола. Люминол и его производные относятся к семейству циклических ацилгидразидов и испускают голубой свет (425 нм) при окислении. Изолюминол имеет более низкий квантовый выход, чем люминол, но в отличие от люминола этот выход мало изменяется при соединении с белками через аминогруппу. Синтезированы производные изолюминола с разнообразными мостиковыми группами для присоединения к гаптенам, многие из них нацелены на пептидную связь, например, за счет реакции с карбодиимидной или сукцинимидной активацией (схема 7.9-3). Как показано в следующем разделе, хемилюминесцентный контроль значительно усовершенствован за счет
594
595
идентификации ряда соединений, которые увеличивают испускание света при добавлении в реакционную среду.
