
- •Общие вопросы автоматизации измерений
- •Механизация и автоматизация лабораторий
- •Дискретные анализаторы
- •Непрерывные анализаторы
- •Непрерывный проточный анализ (нпа)
- •Проточно-инжекционный анализ (пиа)
- •Центрифужные анализаторы
- •Элементные анализаторы
- •Лабораторные роботы
- •Химические сенсоры
- •Потенциометрические сенсоры
- •Газочувствительные сенсоры
- •Биокаталитические мембранные сенсоры
- •Амперометрические сенсоры
- •Кондуктометрические сенсоры
- •Оптические сенсоры первого поколения
- •Сенсоры с системами распознавания
- •Оптроды третьего поколения
- •Термические (калориметрические) сенсоры
- •Гравиметрические сенсоры
- •Многоканальные сенсоры
- •Автоматизированный контроль производственных процессов
- •Анализ на основе неселективных характеристик
- •7.4. Литература
- •Иммунный анализ
- •Введение
- •Варианты анализа
- •Конкурентный анализ
- •Сандвичевый анализ
- •Варианты устройства
- •Эффекты поверхностной иммобилизации
- •Физические методы разделения связанной и свободной метки
- •Адсорбция на твердых частицах
- •Метки Радиоактивные метки
- •Гаптены и полипептиды
- •Частицы, рассеивающие свет, в качестве меток
- •Флуоресцентные и хемилюминесцентные метки
- •Ферментные метки
- •7.9.4. Мешающие влияния
- •Эффективная концентрация определяемого вещества
- •Эффективность связывания антител
- •D Биосенсоры—это аналитические устройства.
- •Биораспознающий компонент и преобразователь
- •Создание биологической поверхности
- •Методы иммобилизации
- •Подготовка биопреобразования Амперометрические сенсоры
- •Потенциометрические сенсоры
- •Оптические сенсоры
- •Оптическое детектирование без метки
- •7.8.4. Заключение
- •Обработка сигналов: цифровая фильтрация, преобразование данных
- •Отношение сигнал-шум
- •Аналоговые и цифровые фильтры
- •Фильтрация при помощи скользящего среднего
- •Полиномиальное сглаживание: фильтр Савицкого-Голея
- •Дифференцирование и интегрирование данных
- •4.3 Фильтрация данных с предварительным преобразованием сигнала
- •Фурье-преобразование
- •Дискретное фурье-преобразование
- •Обратное фурье-преобразование
- •Фильтрация данных при помощи фурье-преобразования
- •Литература.
7.4. Литература
H.Bartels, Techniken der Automatisierung chemischer Analysenverfah-ren, in Analytiker-Taschenbuch, Bd. 2, S. 47/63, Akademie-Verlag, Berlin, 1981.
J.Ruzicka, E.H.Hansen, Flow Injection Analysis, 2 ed., Wiley, New York, 1988.
K.Doerffel, H.Miiller, M.Uhlmann, Prozefianalytik, Deutscher Verlag fur Grundstoffindustrie, Leipzig, 1986.
R.Niefiner, Chemische Sensoren: Prinzipien und Anwendungen, in Analytiker-Taschenbuch, Bd.7, S.55, Akademie-Verlag, Berlin, 1987.
-
Иммунный анализ
Цели изучения
-
Изучить равновесия антитело-антиген и их использование в анализе.
-
Понять различные варианты иммунного анализа.
-
Ознакомиться с тем, как можно проводить иммунный анализ с использованием меток.
-
Введение
D Антитело представляет собой белок со специфичным доменом, связывающим антигены.
D Антигены—это молекулы, способные вызывать иммунный ответ.
Иммунный анализ использует уникальную специфичность антитела, связывающего антиген, с целью селективно распознать и определить вещества, которые являются или антителами, или антигенами. Можно добиться высокой селективности иммунного диализа, потому что другие соединения в пробе распознаваться не будут. Антитела представляют собой один из главных классов белков, объединенных названием иммуноглобулины (Ig). Внутри этого семейства наиболее представительными антителами являются IgG (~ 70%), Y-образный белок, состоящий из двух идентичных, связанных дисульфидными мостиками гетеродимеров с тяжелой и легкой цепями (рис. 7.9-1). Имеются два антигенсвязывающих (активных) центра, образованные вариабельными глобулярными доменами тяжелой и легкой цепей в Fab-области; специфичность этих центров к связыванию антигена определяется аминокислотами областей, определяющих комплементарность. В связывающей полости имеется максимум 17 аминокислот, так что активный центр антигена должен иметь размеры такого же порядка. Антиген не обязательно должен быть белком; это может быть любая макромолекула, которая способна индуцировать иммунный ответ и, таким образом, вызвать образования антител против нее. Молекулы с низкой молекулярной массой (такие, как гормоны или наркотики, являющиеся предметом анализа) не являются антигенными, но можно создать антитела с активными центрами, специфичными к этим молекулам, соединяя их с белковым носителем. Такие низкомолекулярные соединения известны как гаптены.
Антитела продуцируются В-лимфоцитами, причем каждая В-клетка проявляет на своей поверхности только одну специфичность, так что инородный антиген связывают только клетки с «подходящими» активными центрами. Это связывание стимулирует деление таких клеток и образование большого количества IgG с той же специфичностью. Активный центр может быть лишь небольшой частью всей молекулы антигена, и, таким образом, у одного и того же антигена может быть несколько потенциальных активных центров. Результатом этого процесса становится образование сыворотки, содержащей неоднородную смесь частиц антител с разнообразным сродством. Такие сыворотки известны как поликлональные и, в отличие от моноклональных антител, в их кинетику распознавания вносит свой вклад каждый из активированных распознающих центров или эпитопов.

Рис. 7.9-1. Структура тяжелых (индекс Н) и легких (индекс L) цепей IgG, показывающая места связывания антигена.
При сближении антитела (Аb) и антигена (Ag) первичная связывающая сила является ионной (дальнее взаимодействие), действующей на расстояниях свыше 10 нм. Медленное удаление гидратационной воды приводит к образованию водородных связей на расстояниях 0,5-0,15 нм, силы Ван-дер-Ваальса (ближнее взаимодействие) между диполями на соседних атомах становятся более значимыми и связь упрочняется. Связывание можно описать с помощью равновесия:
![]() (7.9-1)
(7.9-1)
где Кравн — константа равновесия, a Ab-Ag — комплекс антитело-антиген. Значения Kравн обычно изменяются в диапазоне от 106 л/моль до 1012 л/моль, но значения меньше, чем 108 л/моль, как правило, в иммунном анализе не используют.
Определяя общую концентрацию антител [Аboбщ] как сумму концентраций связанных [Ab-Ag] и свободных [Аb] антител:
![]() (7.9-2)
(7.9-2)
можно переписать уравнение 7.9-1:
![]() (7.9-3)
(7.9-3)
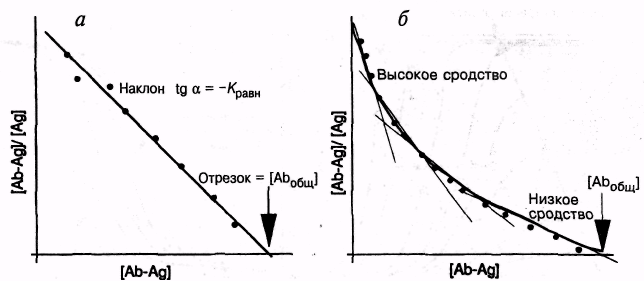
Рис. 7.9-2. График Скэтчарда для моноклонального (а) и поликлонального (б) антитела.
На
графике Скэтчарда строят зависимость
отношения
![]() от [Ab-Ag],
где Кравн определяется наклоном, а
отсекаемый на оси х
отрезок
— [Аbобщ].
от [Ab-Ag],
где Кравн определяется наклоном, а
отсекаемый на оси х
отрезок
— [Аbобщ].
Антитела могут быть моноклональными или поликлональными.
Сыворотка с единственным эпитопом специфичности представляет моноклональную систему. На соответствующем графике Скэтчарда наблюдается прямая линия (рис. 7.9-2,а). Для поликлональной системы график Скэтчарда имеет более сложный вид. Он характеризуется набором многих прямых линий (рис. 7.9-2,5).
При разработке иммунного анализа целью является проследить за равновесием между антителом и антигеном. При анализе исследуют связывание антигена с антителом и различают связанный и несвязанный антиген. Поскольку процесс имеет равновесный характер (уравнение 7.9-1), линейной зависимости от концентрации антигена нет. Следовательно, важно знать характеристический отклик связывания как функцию концентрации антигена.
Из уравнения 7.9-1 и соотношения
![]() (7.9-4)
можем записать:
(7.9-4)
можем записать:
![]() (7.9-5)
(7.9-5)
![]() (7.9-6)
(7.9-6)
Кривые, построенные исходя из этого соотношения для различных концентраций антител, показаны на рис. 7.9-3,а. Можно заметить, что для данной концентрации антител степень связывания меняется как функция концентрации антигена только в критическом диапазоне. Ниже находится область постоянного пропорционального связывания, где изменения концентрации антигена дают незначительные изменения степени связывания. Из рис. 7.9-3,5 очевидно, что увеличение концентрации антител вызывает сдвиг области максимального изменения (т. е. потенциального динамического диапазона измерений) в область более высоких концентраций антигена.
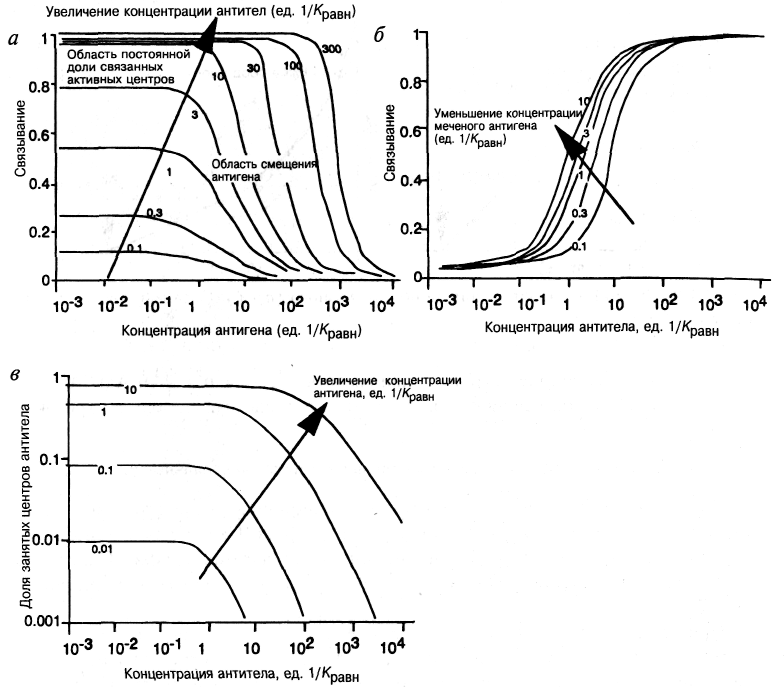
Рис. 7.9-3. а — степень связывания в зависимости от концентрации антигена для различных концентраций антитела; б — степень связывания в зависимости от концентрации антитела для различных концентраций антигена; в — доля занятых центров антитела в зависимости от концентрации антитела для различных концентраций антигена.
С другой стороны, рис. 7.9-3,в показывает, что для довольно низких концентраций антител (< 0,01/Крави) доля занятых активных центров антитела отражает концентрацию определяемого вещества и становится независимой от общей концентрации антител. Однако это не используют широко, хотя подразумевается, что изучаемые концентрации столь малы, что обеднением пробы антигеном за счет связывания можно пренебречь, при этом преимуществом является независимость от объема пробы.
Для того чтобы изучать процесс связывания независимо от уровня концентрации, обычно вводят метку, которую можно контролировать. Пути выполнения этой операции (см. ниже) могут различаться, но при этом всегда следует учитывать ограничения, налагаемые равновесием связывания и необходимым динамическим диапазоном.
