- •Введение
- •Учебный модуль
- •Студент должен знать:
- •Раздел 1
- •Основы медицинской
- •Бактериологии и микробиологии
- •Практическая работа № 1
- •Практическая работа № 2
- •Практическая работа №3
- •Практическая работа №4
- •Рецепты приготовления простых (основных) сред и изотонического раствора натрия хлорида
- •Рецепты приготовления сложных сред
- •Контрольные вопросы.
- •Практическая работа №5
- •Часть 1
- •Практическая работа №5
- •Часть 2
- •Контрольные вопросы
- •Раздел 2
- •Основы медицинской
- •Вирусологии
- •Практическая работа №6
- •1. Заражение лабораторных животных.
- •2. Заражение куриных эмбрионов.
- •3. Культивирование вирусов в культурах клеток.
- •Однослойные культуры клеток.
- •2. Перевиваемые культуры клеток.
- •3. Полуперевиваемые культуры клеток.
- •Раздел 3
- •Основы медицинской
- •Паразитологии
- •Практическая работиа №7
- •Малярийный плазмодий
- •Кровяные формы малярийных плазмодиев
- •Практическая работа № 8
- •Раздел 4
- •Основы общей
- •Микробиологии
- •Практическая работа №9
- •Контрольные вопросы.
- •Раздел 5 основы иммунологии. Практическая работа №10
- •Контрольные вопросы.
- •Практическая работа № 11
- •Контрольные вопросы.
- •Практическая работа №12.
- •Проведение основного опыта
- •Контрольные вопросы.
- •Практическая работа №13
- •Контрольные вопросы.
- •Практическая работа №14
- •Опсонофагоцитарная реакция
- •Контрольные вопросы
- •Практическая работа № 15
- •Контрольные вопросы.
- •Практическая работа №16
- •Список используемой литературы:
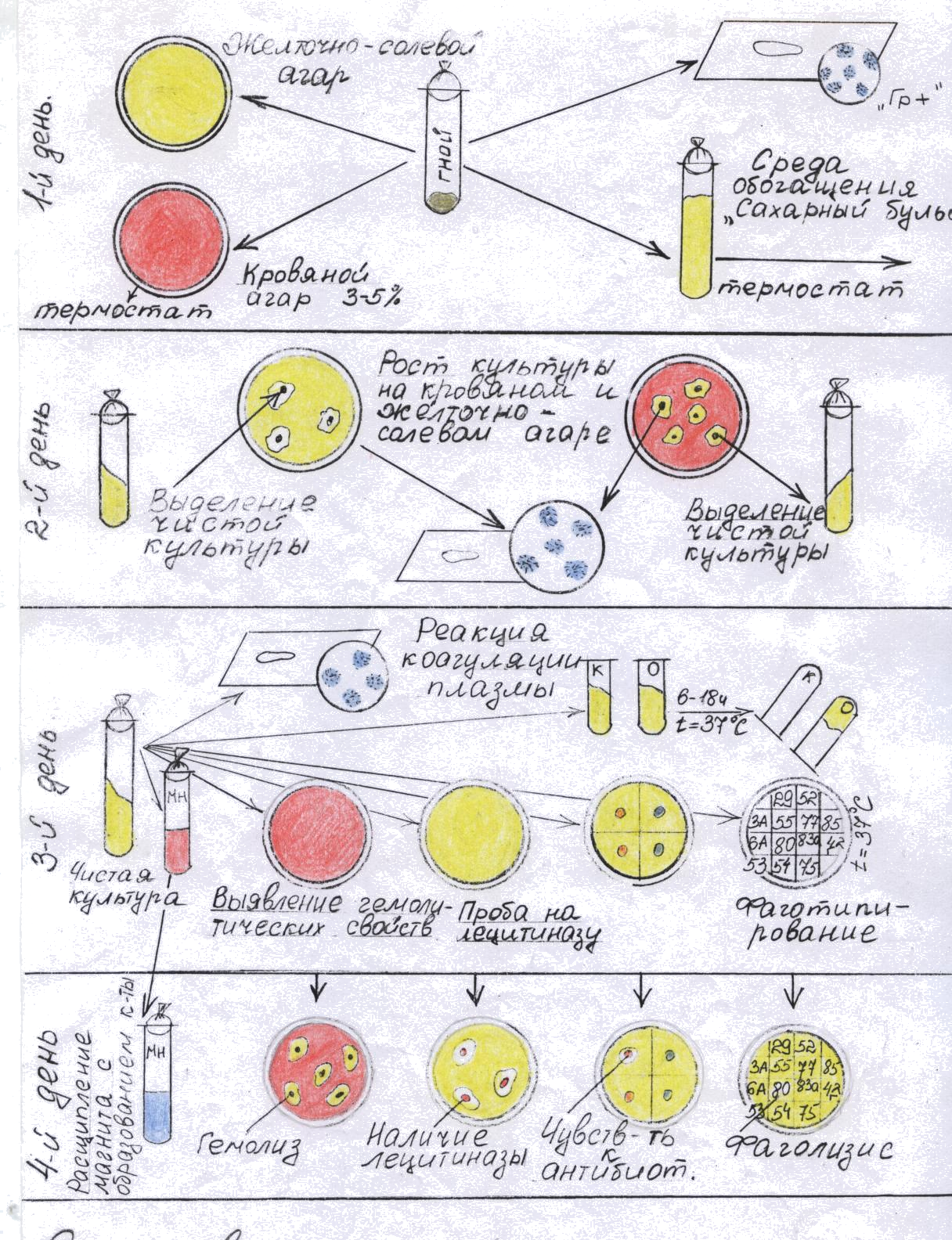
Практическая работа №5
Часть 2
БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
ИССЛЕДОВАНИЯ НА ПРИМЕРЕ СТАФИЛОКОККОВ
Кокки - это обширная группа микроорганизмов, включающая патогенных, условно-патогенных представителей. Общим признаком для всех патогенных кокков является их способность вызывать гнойные процессы. Все патогенные кокки неподвижны. Стафилококки имеют вид круглых шаров, размножаясь они образуют грозди винограда. Вырабатывают сахоролитические и протеолитические ферменты. Вырабатывают экзотоксин, энтеротоксин. К стафилококкам чувствительны скот, лошади, свиньи, куры. Пути передачи: контактно - бытовой, воздушно - капельный, воздушно - пылевой, пищевой. Проникают через кожу и слизистые.
Цель исследования: выделение и идентификация стафилококков.
Материал для исследования:
1. Гной (фурункулы, карбункулы, абсцессы) .
2. Слизь из зева (ангина)
3. Мокрота (пневмония)
4. Моча (цистит )
5. Дуоденальное содержимое (холецистит)
6. Кровь (подозрение на сепсис)
7. Рвотные мессы, промывные воды желудка, пищевые продукты (пищевые - токсикоинфекции или отравления)
8. Слизь из носа (обследование на бактеоносительство).
Основные методы исследования:
-
Микроскопический
-
Биологический
-
Микробиологический
ХОД ИССЛЕДОВАНИЯ:
ПЕРВЫЙ ДЕНЬ ИССЛЕДОВАНИЯ: ,
Способы сбора исследуемого материала:
1. Гной из поражённых участков
Материал следует брать из глубоких слоев поражённого участка. При наличии открытых процессов гной берут стерильным тампоном, пастеровской пипеткой, платиновой петлёй, при закрытых абсцессах - стерильным шприцем.
2. Отделяемое слизистых оболочек носа, зева
Материал берут стерильным тампоном.
3. Мокрота
Собирают в стерильную посуду. :
4. Моча
Собирают в стерильную посуду (следует брать утреннюю мочу катетером)
5. Дуоденальное содержимое
В стерильные пробирки собирают порции А, В, С (можно в одну).
6. Кровь
10-15 мл. Берут стерильным шприцом или иглой из локтевой вены.
7. Рвотные массы
Собирают в стерильную посуду
8. Промывные воды желудка.
Собирают в стерильную посуду
Все посевы ставят в термостат на сутки. Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса в осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Методы исследования:
-
Гной
Засевают на желточно - солевой агар и на агар с 3 - 5% кропи в чашках Петри. Параллельно из гноя делают мазки, окрашивают по методу Грама и микроскопируют.
2. Отделяемое слизистых оболочек
Засевают на желточно - солевой агар и кровяной агар.
3.Моча
Центрифугируют, полученный осадок засевают на желточно - солевой и кровяной агар. Делают мазки, окрашивают по Граму и микроскопируют.
4. Мокрота, дуоденальное содержимое
Засевают на желточно - солевой и кровяной агар.
-
Рвотные массы и пищевые продукты:
Предварительно растирают в ступке и эмульгируют в стерильном изотоническом растворе натрия хлорида. 1 - 2 мл эмульсии засевают на желточно - солевой агар. Для получения изолированных колоний на чашки Петри исследуемый материал тщательно втирают шпателем в поверхность среды.
Кровь засевают в сахарный бульон.
ВТОРОЙ ДЕНЬ ИССЛЕДОВАНИЯ:
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококков колонии, выросшие на желточно – солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой I культуры. При этом учитывают наличие лицетиназы, которое проявляется в образовании венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащем кровь. Колонии с чёткой зоной гемолиза (просветления) вокруг них выделяют на скошенный агар. Посев крови на сахарный бульоне инкубируют 10 суток, производя через 2-3 дня высевы на агар с кровью и желточно - солевую среду. При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
ТРЕТИЙ ДЕНЬ ИССЛЕДОВАНИЯ:
Вынимают посевы из термостата. Из выделенных на скошенном агаре культур делают мазки, окрашивают по методу Грама и микроскопиют. При наличии грамположительных стафилококков проводят дальнейшие изучение выделенной культуры:
1. ставят реакцию плазмокоагуляции
2. изучают гемолитические свойства
3. определяют продукцию ДНКазы
4. определяют ферментацию монната в анаэробных условиях
5. определяют устойчивость к антибиотикам
Реакция плазмокоагуляции.
Цитратную плазму, получаемую из крови кролика, разводят изотоническим раствором натрия хлорида в соответствии 1:4 и наливают в две преципитатные пробирки по 0,3 - 0,5 мл; В одну вносят петлю исследуемой культуры, другая служит контролем. Обе пробирки ставят в термостат при температуре 37 С. Учет реакции производят через 2-3 часа. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре (24 С), после чего учитывают реакцию. При наличии фермента коагулазы плазма свёртывается.
( не выливается из перевёрнутой пробирки).
В контрольной пробирке плазма не изменяет консистенции.
Определение гемолитических свойств:
Производят посев на агар с 5% крови (штаммы, продуцирующие Альфа-гемолизин, дают зоны просветления среды и на кроличий и на бараньей крови; продуцирующие Бетта-гемолизин лизируют только эритроциты барана).
Определение ДНКазы.
Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 часов на чашку с выросшими колониями стафилококков добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу он деполимерезуется ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий ат«р с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18 - 24 часа при температуре 37 С. Положительная реакции характеризуется изменением цвета среды (в среде имеется индикатор).
ЧЕТВЁРТЫЙ ДЕНЬ ИССЛЕДОВАНИЯ:
Для установления эпидемиологической цепочки выделенную культуру фаготипируют.
Фаготипирование может подтвердить идентичность стафилококка, выделенного от разных больных и из объекта внешней среды. Для фаготипирования используют критические тест - разведения фагов. Это максимальное разведение фагов, при котором происходит лизис, соответствующего штамма стафилококка. В чашку Петри наливают 15% МПА, дают ему застыть и подсушивают в термостате в течение 30 - 40 минут. На 1 мл 4-6 часовой культуры выделенного стафилококка, распределённого на поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке.
Дно чашки делят на секторы или квадраты. Число секторов соответствует количеству фагов. Затем на каждый квадрат наносят 1 - ин фаг. Чашки ставят в термостат при температуре 37 С результаты определяют через 6-7 часов. Если чашки оставляют при комнатной температуре, то учёт производится через 18 - 24 часа. Полученную культуру стафилококков проверяют на чувствительность к антибиотикам. | Метод дисков
Взвесь полученной культуру высевают "газоном". В качестве посевного материала используют суточную бульонную культуру или 1 взвесь микробов. Засеянные чашки подсушивают 30 - 40 минут при комнатной температуре. Затем на поверхность засеянного агара накладывают пинцетом бумажные диски, пропитанные растворами различных антибиотиков. Диски накладывают на равном расстоянии друг от друга и на расстоянии 2 см от края чашки, одна чашка служит для изучения 1 - ого штамма к 4 - 5 антибиотикам. Засеянные чашки с нанесёнными на них дисками помещают в термостат при температуре 37 градусов на 18 - 24 часа. Чашки ставят вверх дном, чтобы избежать попадания конденсационной волы на поверхность посева. Учёт результатов:
Действие антибиотиков оценивают по феномену задержки роста вокруг диска. Диаметр зон задержки роста микробов вокруг дисков определяют с помощью линейки, включая диаметр самого диска. Между степенью чувствительности и величиной зоны отсутствия роста есть зависимость. В ответе указывают чувствительность штамма. В ряде случаев определяют чувствительность микроорганизмов к антибиотикам в наживном материале (гной и др.).
УЧЕТ РЕЗУЛЬТАТОВ
Схема выделения и идентификации стафилококка