- •Вопрос №1.
- •Вопрос №2.
- •Вопрос №3.
- •Вопрос №4.
- •Вопрос №5.
- •Вопрос №6.
- •Вопрос №7.
- •Вопрос №9.
- •Вопрос № 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15.
- •Вопрос 16.
- •Вопрос 17.
- •Вопрос 18, 19.
- •Вопрос 20.
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 24. Характеристики химической связи: длина, энергия, валентный угол. Длина и энергия одинарных и кратных связей. Краткое определение типов химических связей.
- •Вопрос 25. Квантово-механическое объяснение образования молекулы водорода из атомов.
- •Вопрос 28. Возможные значения ковалентности для атомов элементов главных подгрупп в нормальном и возбужденном состояниях. Строение молекулы hno3 по методу вс.
- •Вопрос 31. Возможные значения ковалентности атомов p-элементов 7 группы в нормальном и возбужденном состоянии. Строение молекул ClF3 и jf5. Может ли атом фтора проявлять ковалентность больше единицы?
- •Вопрос 32. Метод вс. Гибридизация волновых функций: sp-, sp2-, sp3-гибридизаций. Гибридизация с участием d-орбиталей (sp3d2). Необходимые условия для гибридизации.
- •45 Вопрос
- •46 Вопрос
- •47 Вопрос
- •49 Вопрос
- •Вопрос 76.Теории кислот и оснований. Теория Аррениуса.
- •Теория Льюиса (Электронная Теория Кислот-Оснований)
- •Сопоставление теорий кислот и оснований
- •Сила кислот и оснований По Аррениусу:
- •1). От чего зависит сила кислот и оснований по теории Аррениуса?
- •2). От чего зависит способность кислоты отщеплять протоны, а основания гидроксил-анионы в полярных растворителях (например, воде)?
Вопрос 31. Возможные значения ковалентности атомов p-элементов 7 группы в нормальном и возбужденном состоянии. Строение молекул ClF3 и jf5. Может ли атом фтора проявлять ковалентность больше единицы?
Атом хлора (элемент 7 группы), обладающий в невозбужденном состоянии одним неспаренным электроном, может быть переведен, при затрате некоторой энергии, в возбужденные состояния, характеризующиеся тремя, пятью или семью неспаренными электронами. Поэтому, в отличии от атома фтора, атом хлора может участвовать в образовании не только одной, но также трех, пяти или семи довольно прочных ковалентных связей.
Фтор – одновалентный элемент. Это вытекает из его наивысшей степени электроотрицательности среди элементов, что не способствует участию в донорно-акцепторных взаимосвязях его неподеленных электронных пар. Поэтому ковалентность фтора определяется единственным неспаренным электроном и равна 1.
Вопрос 32. Метод вс. Гибридизация волновых функций: sp-, sp2-, sp3-гибридизаций. Гибридизация с участием d-орбиталей (sp3d2). Необходимые условия для гибридизации.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
sp-гибридизация. В этом явлении принимают участие s- и одна p-орбитали, и в результате образуются две орбитали нового типа, которые называются sp-гибридными. Эти орбитали имеют форму, оси их лежат на одной прямой, образуя угол 180°. В образовании связей в молекуле BeH2 принимают участие sp-гибридные орбитали атома
бериллия и молекула имеет линейное строение;
sp2-гибридизация. Во взаимодействие вступают s- и две p-орбитали, врезультате чего образуются три орбитали нового типа, которые называются sp2-гибридными. Оси этих орбиталей лежат в одной плоскости, и углы между ними равны 120°. Например, атом бора в молекуле BF3 находится в sp2-гибридном состоянии, и эта молекула имеет форму правильного треугольника с атомом бора в центре;
sp3-гибридизация. В этом случае исходными являются s- и три p-орбитали. В результате гибридизации образуются четыре новые орбитали – sp3-гибридные. Оси этих орбиталей направлены от центра к вершинам тетраэдра, углы между осями равны 109°28′. CH4 – молекула метана, где реализуется этот тип гибридизации, имеет тетраэдрическое расположение атомов водорода. В молекуле аммиака (NH3) атом азота тоже находится в sp3-гибридном состоянии, три пары электронов являются общими с атомами водорода и участвуют в образовании связей, а одна электронная пара (неподеленная электронная пара) принадлежит только атому азота. Аналогично можно рассмотреть строение молекулы воды. В ней две неподеленные электронные пары кислорода занимают две вершины тетраэдра, а две другие заняты атомами водорода, что приводит к угловой форме молекулы воды.
Осуществляются два случая гибридизации с участием d-орбиталей: sp3d2 и sp3d. В первом случае молекула реализует октаэдрическое строение, а во втором образуется тригональная бипирамида.
Необходимое условие гибридизации – наличие ковалентной связи. При этом происходит изменение формы и энергии орбиталей атома для достижения более эффективного перекрывания орбиталей.
|
Коорд. число |
Тип гибридизации |
Пространственная конфигурация молекулы, центральный атом которой подвергается гибридизации |
Расположение атомов в молекуле |
Примеры соединений |
|
2 |
sp |
Линейная |
|
BeCl2, CO2, HCN |
|
pd |
Линейная |
↑ |
|
|
|
sd |
Угловая |
|
|
|
|
3 |
sp2 |
Тригональная |
|
BF3, BCl3, NO3-, HgI3-, CdCl3- |
|
sd2, p2d |
Тригональная |
↑ |
|
|
|
spd |
Неправильный треугольник |
|
|
|
|
4 |
sp3 |
Тетраэдрическая |
|
CH4, CCl4, XeO4, HgI4-, BF4- |
|
pd2 |
Тетраэдрическая |
↑ |
|
|
|
p3d, pd3 |
Неправильный тетраэдр |
|
|
|
|
sp2d |
Тетрагональная |
|
[PdCl4]2-, [Pt(NH3)4]2+ |
|
|
p2d2 |
Тетрагональная |
↑ |
|
|
|
5 |
p2d3 |
Пентагональная |
|
|
|
sp3d
|
Пирамидальная |
|
Sb(C6HC5)5 |
|
|
sp2d2, sd4, pd4, p3d2 |
Пирамидальная |
↑ |
|
|
|
sp3d
|
Тригонально-бипирамидальная |
|
PF5, PCl5, SbCl5 |
|
|
spd3 |
Тригонально-бипирамидальная |
↑ |
|
|
|
6 |
sp3d2 |
Октаэдрическая |
|
SF6, PF6-, SiF62- |
|
sp3d2
|
Тригонально-призматическая |
|
|
|
|
spd4, pd5 |
Тригонально-призматическая |
↑ |
|
|
|
p2d3 |
Тригонально-антипризматическая |
|
|
|
|
7 |
sp3d3 |
Пентагонально-бипирамидальная |
|
XeF6, IF7, ZrF73- |
|
8 |
sp3d4 |
Кубическая |
|
PbF48- |
|
sp3d4 |
Тетрагонально-антипризматическая |
|
TaF83-, Cs4[U(NCS)8] |
|
|
12 |
sp3d4 |
Додекаэдрическая |
|
K3[Cr(O2) 4], [Sn(NO3)4] |
Вопрос 33. Определение пространственной конфигурации молекул типа АВn. Понятие о координационном числе центрального атома А, определение σ и π связей, образованных центральным атомом. Строение молекулы СО2.
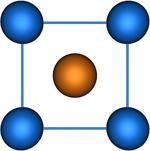
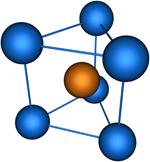
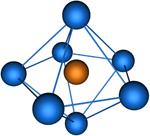
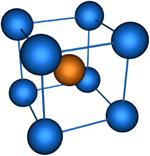
Координационное число (КЧ) – число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Равно числу атомов, ионов или молекул, находящихся в непосредственной близости с данным атомом в молекуле, комплексном соединении или кристалле. В отличие от ковалентности и гетеровалентности, это понятие имеет чисто геометрический смысл и не зависит от характера связи между центральным атомом и лигандом. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура или многогранник, наз. координационными. Значение КЧ колеблется от 2 до 14. Например в структуре алмаза, Ge, Si и ZnS КЧ. равно 4, координац. многогранник — тетраэдр. В структурах типа NaCl КЧ равно 6, координац. многогранник — октаэдр. В некоторых металлах (Cu, Au и др.) КЧ равно 12, многогранник — кубооктаэдр. Понятие «КЧ применяется и при описании структуры аморфных тел и жидкостей. В этом случае оно явл. статистическим, поэтому К. ч. может оказаться не целым. Для жидкостей КЧ— мера ближнего порядка; по тому, насколько КЧ жидкости близко к КЧ. кристалла, судят о близости её структуры к структуре кристалла.
σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи. Вращение по π-связи невозможно без ее разрыва! Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
34.
Гибридизация атомных орбиталей с участием неподелённых пар электронов с и п орбиталях. Строение молекул аммиака и воды. Гибридизация с участием неподелённых електронных пар д орбиталей для образования хим. связи. Строение молекул СФ4, Бром хлор 3.
Гибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме..
sp³-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей. Возникают четыре одинаковые орбитали
sp²-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали
Если у атома А в молекуле (сложном ионе) AВn имеется неподеленная пара электронов, ее тоже следует учитывать при определении типа гибридизации. Эта неподеленная пара электронов считается направленной к "недостающему" атому-партнеру по химической связи.
Например, это имеет место в тетраэдрических молекулах аммиака NH3 и воды H2O. Такие тетраэдры называют незавершенными; кроме того, электростатическое отталкивание атомов водорода от неподеленной пары атома азота N или двух неподеленных пар атома кислорода O несколько искажает тетраэдрическую форму частицы и уменьшает углы между связями H−N−H и H−O−H.
Типы гибридизации sp3d (тригональная бипирамида) и sp3d2 (октаэдр) встречаются у атома серы S в молекулах SF4 и SF6 (при образовании связей S−F используются также 3d-орбитали, на которых в свободном атоме серы S электроны отсутствуют).
36.
Образование кратных связей по методу ВС. Сигма и Пи связи, их особенности. Объясните их электронное строение молекул Ц2Аш6, Ц2Аш4, Ц2Аш2.
Кратность связи. s- и p-Связи
Связь между двумя атомами может осуществляться не только одной, но и несколькими электронными парами. Именно числом этих электронных пар и определяется в методе ВС кратность – одно из свойств ковалентной связи. Например, в молекуле этана С2Н6 связь между атомами углерода одинарная (однократная), в молекуле этилена С2Н4 – двойная, а в молекуле ацетилена С2Н2 – тройная. С увеличением кратности связи, как и следовало ожидать, уменьшается ее длина. Кратность связи увеличивается дискретно, т. е. в целое число раз, поэтому, если бы все связи были одинаковы, энергия также увеличилась бы в соответствующее число раз. Однако, как видно из табл., энергия связи растет менее интенсивно, чем кратность. Следовательно, связи неравноценны. Это можно объяснить различием геометрических способов перекрывания орбиталей. Рассмотрим эти различия.
Связь, образованная перекрыванием электронных облаков по оси, проходящей через ядра атомов, называется s-связью.
Если связь одинарная, то это обязательно s-связь, если кратная, то одна из связей непременно s-связь.
Между двумя атомами может быть только одна s-связь.
Связь, образованная перекрыванием электронных облаков по обе стороны от оси, проходящей через ядра атомов, называется p-связью. Увеличение кратности связи означает образование p-связей, которые имеют меньшую энергию по сравнению с s-связью. В этом и есть причина нелинейного увеличения энергии связи в сравнении с увеличением кратности.
Связи σ и π. Одинарные и кратные связи
Два атома между собой могут образовывать и кратные связи, то есть двойные и тройные. При этом составляющая, образующаяся первой, всегда будет σ-связью (обладает наибольшей прочностью и определяет геометрическую форму молекулы).
Вторая и третья составляющие называются π-связями, они образуются при боковом перекрывании любых орбиталей, кроме s-орбиталей:\
Например, 2p-орбитали двух атомов углерода могут сформировать между собой одинарную, двойную и тройную связи. В первом случае образуется остов молекулы этана C2H6.
При двойном связывании атомов углерода первые 2p-орбитали создают σ-связь, а вторые - π-связь; в этом случае образуется остов молекулы этилена C2H4.
При тройном связывании (одна σ-связь, две π-связи) образуется остов молекулы ацетилена C2H2.
Такие кратные связи всегда короче и прочнее, чем одинарные, их труднее разорвать. Часто именно этим объясняется химическая инертность веществ - таких, как азот N2 (:N≡N:) и диоксид углерода CO2 (O=C=O).
Примеры частиц с кратными связями - это также молекулы SO3, SO2, NO2 и анионы CO32−, SO42−, SO32−
39.
Метод МО. Его применение для объяснения электронного строения частиц: BN, CO, NO, NO+, CN-/.
Парамагнитны М., обладающие постоянным магнитным моментом. Таковы М. с нечётным числом электронов во внешней оболочке, М., содержащие атомы с незамкнутыми (незаполненными) внутренними оболочками (переходные металлы и др
Слева и справа на вертикальных осях энергии отмечены энергии перекрывающихся 1s-АО двух атомов Н, а посередине — электроны на энергетическом уровне молекулы. Энергия МО ниже, чем исходных АО.
Разность энергий АО и МО, т.е. энергия, выделяющаяся при переходе электронов с АО на МО, является энергией связи.
Энергия связи тем больше, а связь тем прочнее, чем выше электронная плотность между ядрами. Последняя, при прочих равных условиях, зависит от размеров соединяющихся атомов. Чем атомы меньше, тем выше электронная плотность на их АО, следовательно, и на образующихся МО.
Соблюдаются следующие условия: АО должны иметь близкие энергии, перекрываться в значительной степени, иметь одинаковую симметрию относительно линии связи, число МО должно быть равно числу образующих их АО.
Итак, рассмотрим гомоатомные молекулы второго периода.
Если
подуровни 2s-
и 2p-состояний
достаточно разделены по энергии,
комбинации s-
и p-АО
можно рассматривать раздельно; 2s-орбитали
образуют МО
![]() и
и![]() *
*
![]() возможно
образование молекулы
возможно
образование молекулы![]()
![]() , но не
, но не![]() ,
поскольку
,
поскольку
![]() и
и
![]() *
заселены одинаково. Одна из 2p-орбиталей,
например,
*
заселены одинаково. Одна из 2p-орбиталей,
например,![]() -орбиталь, при комбинации с
-орбиталь, при комбинации с
![]() -орбиталью
другого атома образует связь
-орбиталью
другого атома образует связь
![]() -типа.
Оставшиеся две АО
-типа.
Оставшиеся две АО
![]() и
и
![]() перпендикулярны
линии связи (оси x)
и энергетически равноценны. Поэтому
они образуют два вырожденных уровня
энергии, соответствующих МО
перпендикулярны
линии связи (оси x)
и энергетически равноценны. Поэтому
они образуют два вырожденных уровня
энергии, соответствующих МО
![]() ,
,
![]() и
и
![]() *,
*,
![]() *.
В начале периода s-
и p-подуровни
близки по энергии, поэтому уровень
*.
В начале периода s-
и p-подуровни
близки по энергии, поэтому уровень
![]() расположен выше
расположен выше
![]() -,
-,
![]() -уровней
(рис. 3.10). Поскольку расстояние между s-
и p-подуровнями
увеличивается в периоде с ростом Z,
то схема уровней на рис. 3.11 лучше всего
описывает молекулы элементов конца
периода, начиная с кислорода.
-уровней
(рис. 3.10). Поскольку расстояние между s-
и p-подуровнями
увеличивается в периоде с ростом Z,
то схема уровней на рис. 3.11 лучше всего
описывает молекулы элементов конца
периода, начиная с кислорода.

Рисунок 3.10. Уровни энергии МО элементов 2 периода (начало периода). Заселение МО указано для B2.

Рисунок 3.11. Уровни энергии МО элементов 2 периода (конец периода).
Заселение МО указано для О2.кратность, длина и энергия связи определяются числом связывающих и разрыхляющих электронов.Если воспользоваться рассмотренными символами, то электронную формулу молекулы кислорода можно записать так: (σs)2(σs*)2(σx)2 (πy, πz)4(πy*, πz*)2.В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью (рис. 3.12), и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома.
Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов.
Однако в отличие от гомоядерных эти молекулы образованы атомами с неодинаковыми зарядами атомов Z. Например, в молекуле СО АО кислорода лежат ниже АО углерода (это различие отражается на величинах потенциалов ионизации атомов: I1 углерода – 11,09 эВ, I1 кислорода – 13,62 эВ). Схема МО молекул СО, BF и молекулярных ионов NO+, CN– несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул. На рис. 3.13 приведена энергетическая диаграмма МО молекулы СО. При сохранении кратности связи энергия связи СО равна 1070 кДж∙моль–1 против 842 кДж∙моль–1 в N2. Это увеличение вызвано дополнительным вкладом ионной составляющей из-за разности электроотрицательностей атомов углерода и кислорода. Адекватное экспериментальным данным строение монооксида углерода соответствует формуле C– ≡ O+. Такое необычное распределение зарядов обусловлено переходом лишней по сравнению с углеродом () электроннной пары O() на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду.

40.
Типы молекулярных взаимодействий (ориентационная, деформационное, дисперсионное). Агрегатные состояния как проявление взаимодействия между веществами. Водородная связь и межмолекулярное донорно – акцепторное взаимодействие.
Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания.Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.

Индукционное взаимодействие
Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.

Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:

Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами.
Межмолекулярное отталкивание
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться. Силы межмолекулярного отталкивания действуют на очень малых расстояниях.
Водородная связь — разновидность донорно-акцепторной связи.
Особенностями водородной связи, по которым ее выделяют в отдельный вид, является ее не очень высокая прочность, распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода
Природа водородной связи
Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Атом с большой электроотрицательностью, например, фтор в молекуле HF смещает на себя электронное облако, приобретая значительный эффективный отрицательный заряд, а ядро атома водорода (протон) почти лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Атом водорода, соединенный с атомом сильно электроотрицательного элемента, способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом.
Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи, однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты.
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Донорно-акцепторный механизм возникает часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору) и обобществляемой при образовании связи. Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связующих электронов. Например, реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленной электронной паре донора (азота): В ионе NH4+ вce четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов может выполнять протон, а также атомы с незаполненным октетом (напр., атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое).
41.
Краткая характеристика агрегатных состояний. Типы кристаллических решёток. Физико-химические свойства веществ с различным типом кристаллических решёток.
Твёрдое тело
Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Ж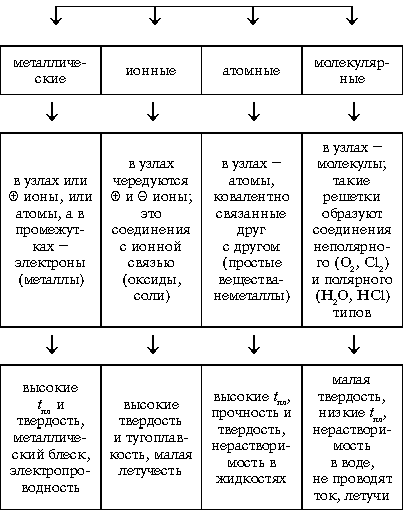 идкость
идкость
Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в которую она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ
Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Плазма
Часто причисляемая к агрегатным состояниям вещества, плазма отличается от газа большой степенью ионизации атомов. Фазовым состоянием большей части барионного вещества (по массе ок. 99,9 %) во Вселенной является плазма.
Типы кристаллических решоток
42.
Ионная химическая связь. Цикл Борна-Габера для образования ионных молекул. Поляризуемость ионов и их взаимное поляризующее действие. Влияние степени поляризации ионов на свойство молекул.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
![]()
На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т.д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, "растаскивают" молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются).
цикла Борна–Габера. Этот цикл позволяет выяснить, какой вклад в тепловой эффект реакции вносит та или иная ее стадия. Пусть, например, речь идет об образовании твердого ионного соединения фторида натрия при экзотермической реакции газа фтора и металлического натрия. Если реакцию проводить при 25 °С, то, по данным экспериментальных определений, при образовании 1 моль NaF выделяется 569,1 кДж, так что:
Na (кр.) + 0,5F2 (г.) = NaF (кр.) + 569,1 кДж/моль.
Иначе
говоря, в этом случае Qэксп = 569,1 кДж/моль,
а
![]() Hэксп
= –569,1 кДж/моль. Отметим, что химические
уравнения, в которых приведены данные
о тепловом эффекте реакции (об ее
энтальпии), называют термохимическими.
Hэксп
= –569,1 кДж/моль. Отметим, что химические
уравнения, в которых приведены данные
о тепловом эффекте реакции (об ее
энтальпии), называют термохимическими.
Поляризуемость и поляризующее действие ионов и молекул
В электрическом поле ион или молекула деформируются, т.е. в них происходит относительное смещение ядер и электронов. Такая деформируемость ионов и молекул называется поляризуемостью. Поскольку наименее прочно в атоме связаны электроны внешнего слоя, то они испытывают смещение в первую очередь.
Поляризуемость анионов, как правило, значительно выше поляризуемости катионов.
В пределах периода поляризуемость атомов с увеличением порядкового номера уменьшается, а в пределах группы увеличивается.
Электрическое поле может быть создано как заряженным электродом, так и ионом. Таким образом, ион сам может оказывать поляризующее действие (поляризацию) на другие ионы или молекулы. Поляризующее действие иона возрастает с увеличением его заряда и уменьшением радиуса.
Поляризующее действие анионов, как правило, значительно меньше, чем поляризующее действие катионов. Это объясняется большими размерами анионов по сравнению с катионами.
Молекулы обладают поляризующим действием в том случае, если они полярны; поляризующее действие тем выше, чем больше дипольный момент молекулы.
43.
Полярность и поляризуемость ковалентной химической связи. Эффективные заряды атомов в молекулах. Дипольный момент в хим. связи и молекулы. Строение и дипольные моменты сложных молекул.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Полярность ковалентной связи
Полярность химической связи зависит от разности электроотрицательностей связываемых атомов.
Электроотрицательность − условная величина, характеризующая способность атома в молекуле притягивать электроны.
Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними.
В зависимости от того, как происходит перераспределение электронной плотности при образовании химической связи, различают несколько ее типов. Предельный случай поляризации химической связи - полный переход электрона от одного атома к другому. При этом образуются два иона, между которыми возникает ионная связь. Для того чтобы два атома смогли создать ионную связь, необходимо, чтобы их электроотрицательности очень сильно различались. Если электроотрицательности атомов равны (при образовании молекул из одинаковых атомов), связь называют неполярной ковалентной. Чаще всего встречается полярная ковалентная связь - она образуется между любыми атомами, имеющими разные значения электроотрицательности.
Количественной оценкой полярности ("ионности") связи могут служить эффективные заряды атомов. Эффективный заряд атома характеризует разность между числом электронов, принадлежащих данному атому в химическом соединении, и числом электронов свободного атома. Для оценок эффективного заряда атома используют модели, в к-рых экспериментально определяемые величины представляют как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; Эффективные заряды атомов можно определить также на основе квантовохимических расчетов.
Атом более электроотрицательного элемента притягивает электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд, который называют и эффективным, а у его партнера появляется такой же положительный заряд. Если электроны, образующие связь между атомами, принадлежат им в равной степени, эффективные заряды равны нулю. В ионных соединениях эффективные заряды должны совпадать с зарядами ионов. А для всех других частиц они имеют промежуточные значения.
Качественно распределение заряда можно оценить по шкале электроотрицательности. Используют также различные экспериментальные методы.
Дипольный момент связи является векторной величиной. Он направлен от положительно заряженной части молекулы к ее отрицательной части. На основании измерения дипольного момента было установлено, что в молекуле хлороводорода HCl на атоме водорода имеется положительный заряд +0,2 доли заряда электрона, а на атоме хлора отрицательный заряд −0,2. Значит, связь H−Cl на 20% имеет ионный характер. А связь Na−Cl является ионной на 90%.
Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул. Полярные молекулы поляризуются в электрическом поле, устанавливаясь по силовым линиям поля, ориентируются в электических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя.
Не следует путать дипольный момент связи и дипольный момент молекулы, так как в молекуле могут существовать несколько связей, дипольные моменты которых суммируются как векторы. Кроме того, на величину дипольного момента молекулы могут влиять магнитные поля орбиталей, содержащих электронную пару,- "неподеленные" электроны. Большое влияние на полярность молекулы оказывает ее симметрия.
Например, молекула метана CH4 обладает высокой степенью симметрии
(центрированный тетраэдр), и поэтому векторная сумма дипольных моментов связей (?=0,4D) равна нулю:
Если заменить водородные атомы на атомы хлора и получить молекулу CCl4, у которой дипольный момент связи ?=2,05D, те в пять раз больший, чем для C-
H, то результат останется прежним, так как молекула CCl4 обладает таким же строением.
Таким образом, полярность молекул определяется довольно сложно, так как она учитывает все взаимодействия, которые могут возникнуть в такой сложной структуре, как молекула. Кроме того, ”полярность” молекулы не определяется лишь величиной дипольного момента, а зависит также от размеров и конфигурации молекул. Например, молекула воды более резко проявляет свои полярные свойства (образование гидратов, растворимость и т.д.), чем молекула этилового спирта, хотя дипольные моменты у них почти одинаковые
Дипольный момент полярной молекулы может изменять свою величину под действием внешних электрических полей, а также под действием электрических полей других полярных молекул, однако при удалении внешних воздействий дипольный момент принимает прежнюю величину.
Физико-химические особенности полярных молекул определяются их способностью реагировать на внешние электрические поля (электрическая поляризация) и на поля, созданные другими полярными молекулами. В частности, за счет взаимодействия с полярными молекулами воды такие полярные молекулы, как HF, HCl и др.,могут подвергаться электролитической диссоциации.
Дипольный момент сложной молекулы определяется как векторная сумма дипольных моментов всех связей. Поэтому если молекула АВn симметрична относительно линии каждой связи, суммарный дипольный момент такой неполярной молекулы, несмотря на полярность связей А–В, равен нулю: Примером могут служить симметричные молекулы, связи в которых образованы только гибридными орбиталями: ВеF2, ВF3, СН4, SF6 и др.
Молекулы, связи в которых образованы негибридными орбиталями, а также гибридными орбиталями с участием орбиталей неподеленных пар электронов, не обладают такой симметрией. Примерами таких полярных молекул являются: H2S, NH3, H2O и др.
44.
Металлическое состояние, его особенности. Металлическая связь, как предельный случай делокализованной хим. связи. Проводники, полупроводники и диэлектрики. Понятие об электронной и дырочной проводимости.
металлы отличаются от других веществ только некоторыми свойствами, которые мы назвали металлическими: блеск, хорошая тепло- и электропроводность, прочность и способность к пластической деформации и т.д. У разных металлов названные свойства выражены в различной степени, и в зависимости от того, какие из них считать определяющими, одно вещество будет более «металлическим», а другое—менее. С этой точки зрения, по-видимому, не так уж неправ был Ломоносов, который не причислял к металлам ртуть—ведь существенными признаками металлов он считал блеск и ковкость.
А возможно ли, чтобы вещество, которое мы без колебаний относим к числу неметаллов, при определенных условиях проявляло металлические свойства? Действительно, подобное наблюдается при очень высоких давлениях. Например, красный фосфор превращается в черный и приобретает металлические свойства.
Не менее удивительные результаты получены для кремния и углерода. Если эти неметаллы подвергнуть высокому давлению, порядка 10000 МПа (мегапаскалей), или 100000 ат, то оба они переходят в металлическое состояние.
Особенно интересным кажется предположение о металлических свойствах водорода. Как известно, при нормальных условиях водород—газ, при температуре — 253° он становится жидкостью, а при — 259 С затвердевает. Во всех трех состояниях водород—явно выраженный неметалл. Однако, согласно современной теории твердого тела, при достаточно высоком давлении и низкой температуре все вещества должны переходить в металлическое состояние. Известны даже условия, при которых должен наступить такой переход у водорода: давление около 200000 МПа (2 млн. ат) и температура приблизительно — 260° С. Еще совсем недавно такие условия находились за пределами экспериментальных возможностей. Однако уже удалось получить доказательство того, что при чрезвычайно низких температурах и высоком давлении водород действительно превращается в металл.
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
При образовании твердого тела в смысле кристаллизации атомов в жесткую структуру каждый энергетический электронный уровень в атомах расщепляется на ряд близких подуровней, объединенных в энергетическую полосу или зону. Все электроны, находящиеся в данной энергетической полосе, обладают очень близкими энергиями. На близких к ядру орбитах электроны находятся в связанном состоянии: они неспособны оторваться от ядра, поскольку, хотя теоретически перескок электрона из одного атома в другой — на ту же по энергии орбиту — возможен, все нижние орбиты соседних атомов заняты, и реальная миграция электронов между ними невозможна.
Поэтому самой важной с точки зрения теории электрической проводимости является валентная зона — размытый на подуровни внешний слой электронной оболочки атомов, который у большинства веществ не заполнен (исключение — инертные газы, но они кристаллизуются лишь при сверхнизких температурах). Поскольку внешний слой не насыщен электронами, в нем всегда имеются свободные подуровни, которые могут занять электроны из внешней оболочки соседних атомов. И электроны, действительно, проявляют удивительную подвижность, хаотично мигрируя от атома к атому в пределах валентной зоны, а в присутствии внешней разности электрических потенциалов они дружно «маршируют» в одном направлении, и мы наблюдаем электрический ток. Именно поэтому нижний слой, в котором имеются свободно перемещающиеся электроны, принято называть зоной проводимости — при этом это даже не обязательно самый верхний (валентный) орбитальный слой электронов в атоме.
Многозонную теорию строения твердого тела можно использовать для объяснения электропроводности вещества. Если валентная зона твердого тела заполнена, а до следующей незаполненной энергетической зоны далеко, вероятность того, что электрон на нее перейдет, близка к нулю. Значит, электроны прочно привязаны к атомам и практически не образуют проводящего слоя. Соответственно, и под воздействием электрической разности потенциалов с места они не двигаются, и мы имеем изолятор — вещество, не проводящее электрический ток.
Проводник, с другой стороны, как раз представляет собой вещество с частично заполненной зоной валентных электронов, внутри которой электроны имеют значительную свободу перемещения от атома к атому. Наконец, полупроводники — это кристаллические вещества с заполненной валентной зоной, и в этом они подобны изоляторам, однако разность энергий между валентным уровнем и следующим, проводящим энергетическим уровнем у них настолько незначительна, что электроны преодолевают ее при обычных температурах чисто в силу теплового движения.
Проводимость полупроводников при наличии примесей называется примесной проводимостью. Различают два типа примесной проводимости – электронную и дырочную.
Электронная проводимость возникает, когда в кристалл германия с четырехвалентными атомами введены пятивалентные атомы (например, атомы мышьяка, As).
Примесь из атомов с валентностью, превышающей валентность основных атомов полупроводникового кристалла, называется донорной примесью. В результате ее введения в кристалле появляется значительное число свободных электронов. Это приводит к резкому уменьшению удельного сопротивления полупроводника – в тысячи и даже миллионы раз. Удельное сопротивление проводника с большим содержанием примесей может приближаться к удельному сопротивлению металлического проводника.
В кристалле германия с примесью мышьяка есть электроны и дырки, ответственные за собственную проводимость кристалла. Но основным типом носителей свободного заряда являются электроны, оторвавшиеся от атомов мышьяка. В таком кристалле nn >> np. Такая проводимость называется электронной, а полупроводник, обладающий электронной проводимостью, называется полупроводником n-типа.
Дырочная проводимость возникает, когда в кристалл германия введены трехвалентные атомы (например, атомы индия, In). Примесь атомов, способных захватывать электроны, называется акцепторной примесью. В результате введения акцепторной примеси в кристалле разрывается множество ковалентных связей и образуются вакантные места (дырки). На эти места могут перескакивать электроны из соседних ковалентных связей, что приводит к хаотическому блужданию дырок по кристаллу.
Наличие акцепторной примеси резко снижает удельное сопротивление полупроводника за счет появления большого числа свободных дырок. Концентрация дырок в полупроводнике с акцепторной примесью значительно превышает концентрацию электронов, которые возникли из-за механизма собственной электропроводности полупроводника: np >> nn. Проводимость такого типа называется дырочной проводимостью. Примесный полупроводник с дырочной проводимостью называется полупроводником p-типа. Основными носителями свободного заряда в полупроводниках p-типа являются дырки.