
- •1) Предмет и методы химической термодинамики. Взаимосвязь между
- •2) Основные понятия термодинамики. Интенсивные и экстенсивные
- •3) Типы термодинамических систем (изолированные, закрытые, открытые).
- •4) Типы термодинамических процессов (изотермические, изобарные,
- •5) Первое начало термодинамики.
- •6) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •Способы расчета стандартной энтальпии химической реакции
- •7) Закон Гесса.
- •8) Применение первого начала термодинамики к биосистемам. (?)
- •9) Второе начало термодинамики. Обратимые и необратимые в
- •10) Энергия Гиббса. Прогнозирование направления самопроизвольно
- •11) Стандартная энергия Гиббса образования вещества, стандартная энергия
- •12) Понятие экзергонических и эндергонических процессов, протекающих в
- •17) Уравнения изотермы и изобары химической реакции.
- •18) Предмет химической кинетики.
- •19) Скорость реакции, средняя скорость реакции в интервале, истинная
- •20) Классификации реакций, применяющиеся в кинетике: реакции,
- •21) Молекулярность элементарного акта реакции.
- •27) Экспериментальные методы определения скорости и константы
- •28) Зависимость скорости реакции от температуры. Правило Вант-
- •29) Уравнение Аррениуса. Энергетический профиль реакции; энергия
- •30) Понятие о теории активных соударений.
- •31) Роль стерического фактора.
- •32) Понятие о теории переходного состояния.
- •33) Катализ. Гомогенный и гетерогенный катализ. Энергетический
- •34) Особенности каталитической активности ферментов. Уравнение
- •32) Понятие о теории переходного состояния (более полная версия научным языком).
21) Молекулярность элементарного акта реакции.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
22-23-24) Порядок реакции. Период полупревращения. Закон действующих масс. Зависимость скорости реакции от концентрации.
Порядок реакции по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Время полупревращения t1/2 - время, за которое концентрация исходного вещества уменьшиться в 2 раза (см. табл. ниже)
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс:
Закон действующих масс:
w=![]()
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в некоторых степенях. Эти степени называются частными порядками реакции:
p - частный порядок реакции по веществу А,
q - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=p+q.
k - константа скорости реакции, это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
25-26) Константа скорости химической реакции. Кинетические уравнения реакций нулевого, первого, второго порядков.
Константа скорости реакции - это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением (см.табл).
|
Порядок реакции Z |
Кинетическое уравнение, размерность |
Период полупревращения, ττ |
|
1 |
[с–1] |
|
|
2 |
[л∙моль∙с–1] |
|
|
0 |
[моль/л∙t] |
|
t – время от начала реакции до достижения концентрации с;
а - концентрация вещества А при t=0,
с - концентрация вещества А в момент времени t .
27) Экспериментальные методы определения скорости и константы
скорости реакций.
Экспериментально скорость реакции определяют измерением концентрации реагирующих веществ за определенный промежуток времени с последующим расчетом по формулам средней или истинной скорости реакции.
Константу скорости реакции можно определить представив экспериментальные данные в линейных координатах кинетического уравнения соответствующего порядка.
28) Зависимость скорости реакции от температуры. Правило Вант-
Гоффа. Температурный коэффициент скорости реакции и его
особенности для биохимических процессов.(?)
Скорость химической реакции увеличивается с повышением температуры. Приблизительно оценить влияние температуры на скорость реакции можно по правилу Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2-4 раза.
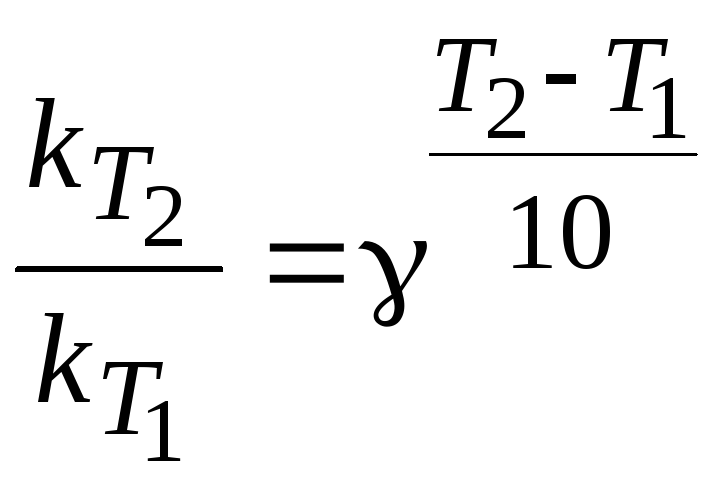 ,
,
где - температурный коэффициент Вант-Гоффа (температурный коэффициент скорости реакции).
k (T1) и k (T2) – константы скорости реакции при температурах Т1 и Т2 .
Для биологических процессов важен определенный температурный интервал, вне которого процесс прекращается. В этом интервале увеличение температуры активизирует протекание жизненно важных процессов до оптимального, а последующее повышение температуры быстро снижает скорость процесса вплоть до прекращения жизнедеятельности организма. Это связано с необратимой тепловой денатурацией белков биологических тканей, а также с инактивацией ферментов (биологических катализаторов).

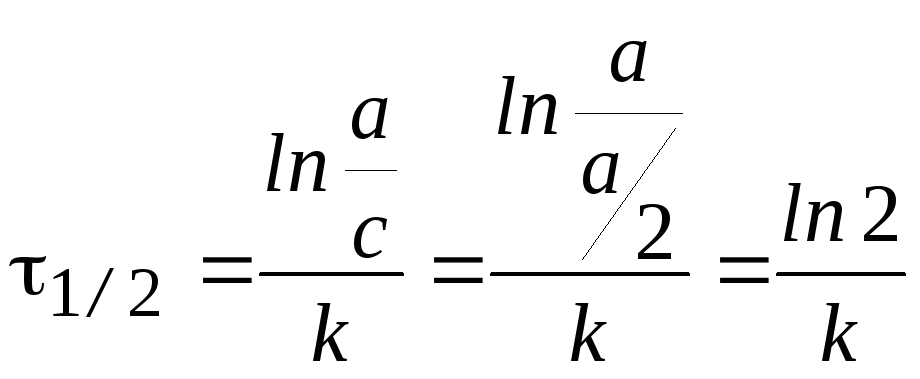 [с–1]
[с–1]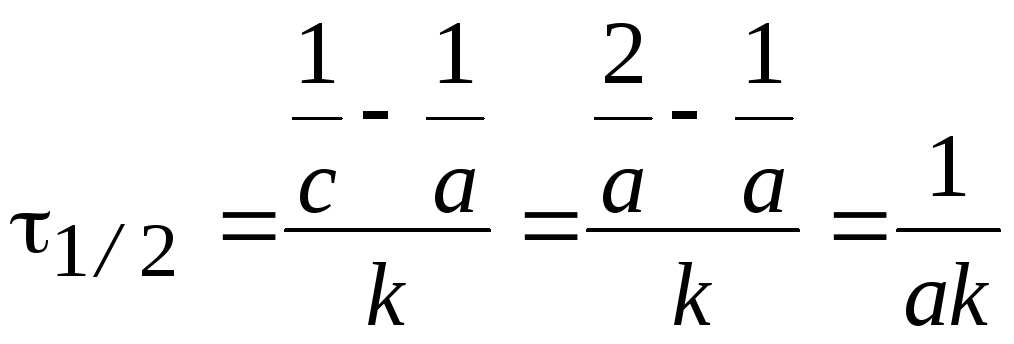 [л∙моль–1∙с–1]
[л∙моль–1∙с–1]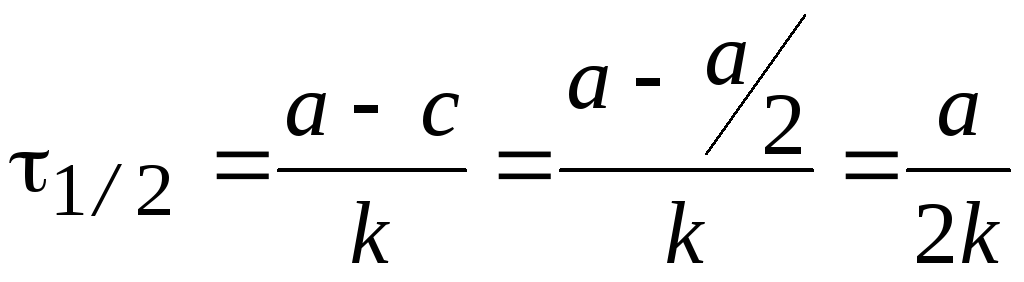 [моль/л∙t]
[моль/л∙t]